Клиническая химия в диагностике и лечении. Обмен натрия и воды обмен калия лечение диуретиками гомеостаз ионов водорода
 Скачать 3.99 Mb. Скачать 3.99 Mb.
|
ОБМЕН ПУРИНОВ И СОЛЕЙ МОЧЕВОЙ КИСЛОТЫГИПЕРУРИКЕМИЯ И ПОДАГРА Гиперурикемия может быть либо бессимптомной, либо приводящей к развитию клинического синдрома подагры. В случаях высоких уровней уратов в крови требуется лечение, даже если клинические симптомы отсутствуют, так как относительно мало растворимые соли мочевой кислоты могут, подобно кальцию, образовать осадки в тканях. Отложение этих солей в почках может привести к их поражению. Гиперурикемия может быть обусловлена как первичным нарушением обмена пуринов, так и представлять собой следствие целого ряда других патологических состояний (вторичная гиперурикемия). Синдром первичной гиперурикемии наследуется. При свойственном плазме крови рН большинство уратов ионизированы в положении 8 (рис. 43). Эта анионная группа ассоциирована с натрием как количественно преобладающим внеклеточным катионом. Однозамещенный урат натрия хотя и отличается относительно низкой растворимостью, все же более растворим, чем менее ионизированная мочевая кислота, образующаяся при. понижении рН до величин, не превышающих приблизительно 6, как это может происходить в моче. Обмен солей мочевой кислоты в норме У приматов, включая человека, ураты являются конечными продуктами обмена пуринов. У большинства других млекопитающих ураты подвергаются дальнейшему распаду до растворимогосоединения аллантоина. Низкая растворимость уратов делает организм человека склонным к развитию клинических симптомов подагры и поражений почек. Пурины аденин и гуанин входят в. состав обоих типов нуклеиновых кислот (ДНК и РНК). Пурины,. используемые в организме для синтеза нуклеиновых кислот, могут быть либо продуктами распада поступающих в пищеварительный тракт нуклеиновых кислот (преимущественно с мясом, богатым клеточными элементами), либо продуктами происходящего в организме биосинтеза из низкомолекулярных соединений de novo. Синтез пуринов Путь синтеза пуринов сложен. В ходе этого процесса многие низкомолекулярные соединения включаются в относительно сложное пуриновое кольцо. В верхней части рис. 43 представлены некоторые наиболее важные этапы этого синтетического процесса. Цитотоксические средства блокируют различные этапы указанного процесса, предотвращая образование ДНК и рост клетки. 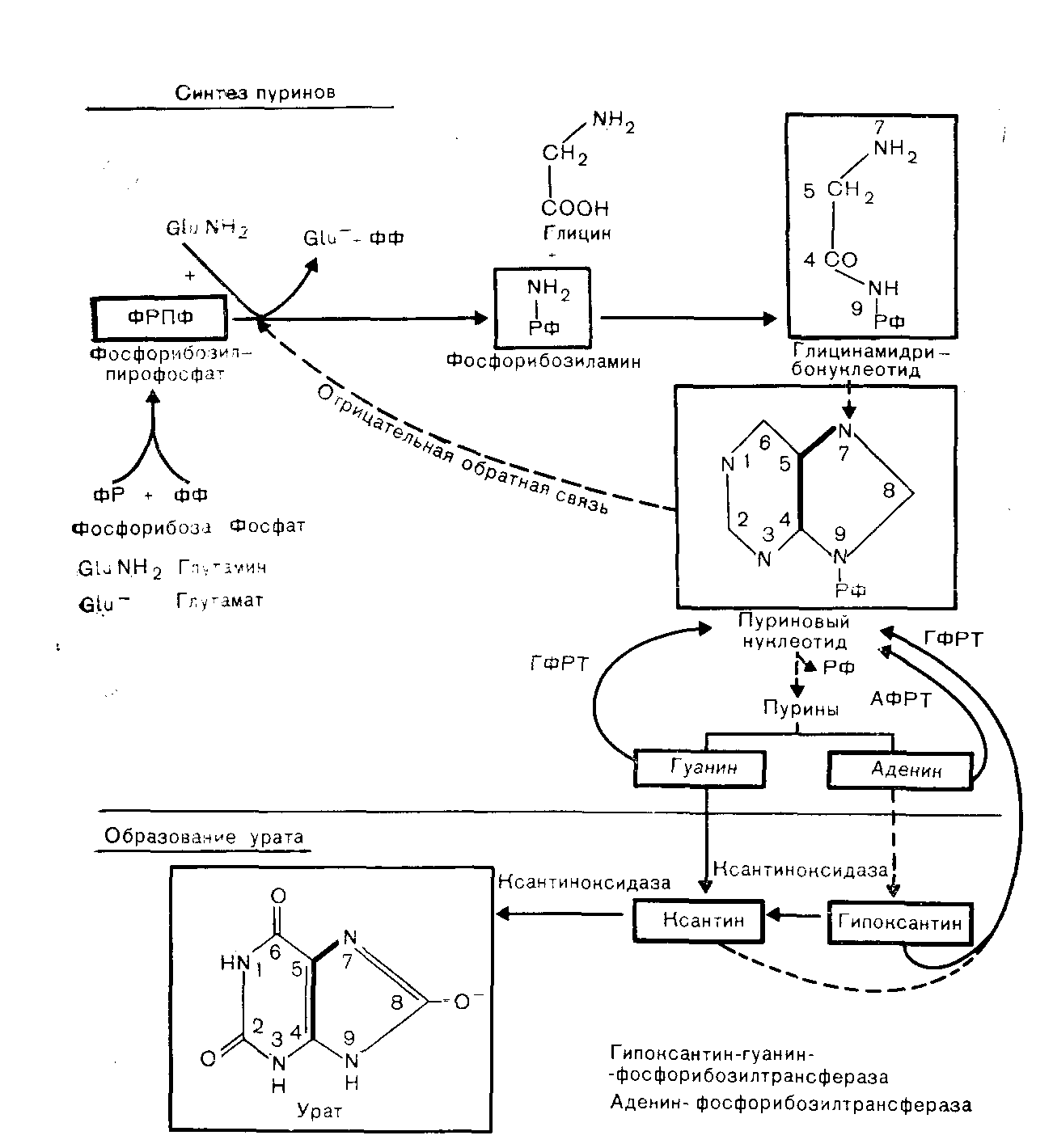 Рис. 43. Краткая схема синтеза и распада пуринов, указывающая этапы, важные для клиники. Особого внимания заслуживают следующие указанные на рис. 43 этапы: 1) первым этапом синтеза пуринов является конденсация пирофосфата и фосфорибозы с образованием фосфорибозилпирофосфата (ФРПФ); 2) затем в молекулу рибозофосфата включается аминогруппа глутамина и высвобождается пирофосфат. Этот ограничивающий скорость (ключевой) этап синтеза пуринов катализирует амидофосфорибозилтрансфераза, блокируемая по механизму обратной связи нарастающими концентрациями пуриновых нуклеотидов. Таким образом, скорость биосинтеза снижается, когда концентрация продуктов реакции повышается. При первичной подагре этот этап процесса может быть нарушен; 3) далее к фосфорибозиламину присоединяется глицин. Меченый глицин можно использовать для изучения скорости синтеза пурияов. На схеме мы пронумеровали атомы в молекуле глицина, чтобы показать их соответствие атомам молекул пуринов и уратов; жирными линиями указано окончательное расположение остатка данной аминокислоты в этих молекулах. При помощи меченого глицина было установлено, что при первичной подагре синтез пуринов стимулирован. После многих сложных превращений образуются пуриновые рибонуклеотиды (пуриновые рибозофосфаты). Как мы уже укааывали, их концентрация регулирует первый этап биосинтетического процесса. При высвобождении пуринов происходит отщепление рибозофосфата. Метаболизм пуринов Пурины, синтезируемые в организме, поступающие с продуктами питания и высвобождаемые при распаде эндогенных нуклеиновых кислот, могут подвергаться дальнейшим превращениям в соответствии с одним из следующих двух путей. Пурины могут быть либо повторно использованы для синтеза нуклеиновых кислот, либо окислены до уратов. Образование уратов из пуринов. Как показано в нижней части рис. 43, аденин частично окисляется до гппоксантина, который далее окисляется до ксантина. Из гуанина также может образоваться ксантин. В свою очередь ксантин окисляется с образованием уратов. Окисление как гипоксантина, так и ксантина катализирует фермент печени ксантиноксидаза. Таким образом, образование уратов из пуринов зависит от активности ксантиноксидазы; этот факт имеет важное значение при лечении подагры. Повторная утилизация пуринов. Ксантин, гипоксантин и гуанин могут быть частично использованы повторно для синтеза пуриновых нуклеотидов в результате превращений, катализируемых наряду с другими ферментами, гипоксантингуанинфосфорибозилтрансферазой (ГФРТ) и аденинфосфорибозилтрансферазой (АФРТ). Экскреция уратов. Выведение уратов из организма преимущественно (на 75%) осуществляется путем экскреции с мочой; 25% уратов поступает в кишечник, где при участии микроорганизмов происходит их распад (уриколиз). Фильтрующиеся в почечных клубочках ураты, по-видимому, почти полностью реабсорбируются в канальцах. Ураты в моче преимущественно являются продуктом активной секреции клеток почечных канальцев. У мужчин с мочой экскретируется несколько меньше уратов, чем у женщин. Этот факт, по-видимому, объясняет более высокую заболеваемость гиперурикемией у мужчин. Некоторые лекарственные средства, применяемые для лечения гиперурикемии, могут стимулировать секрецию уратов в почках. Такие органические кислоты, как молочная и оксокислоты, могут угнетать экскрецию уратов с мочой. 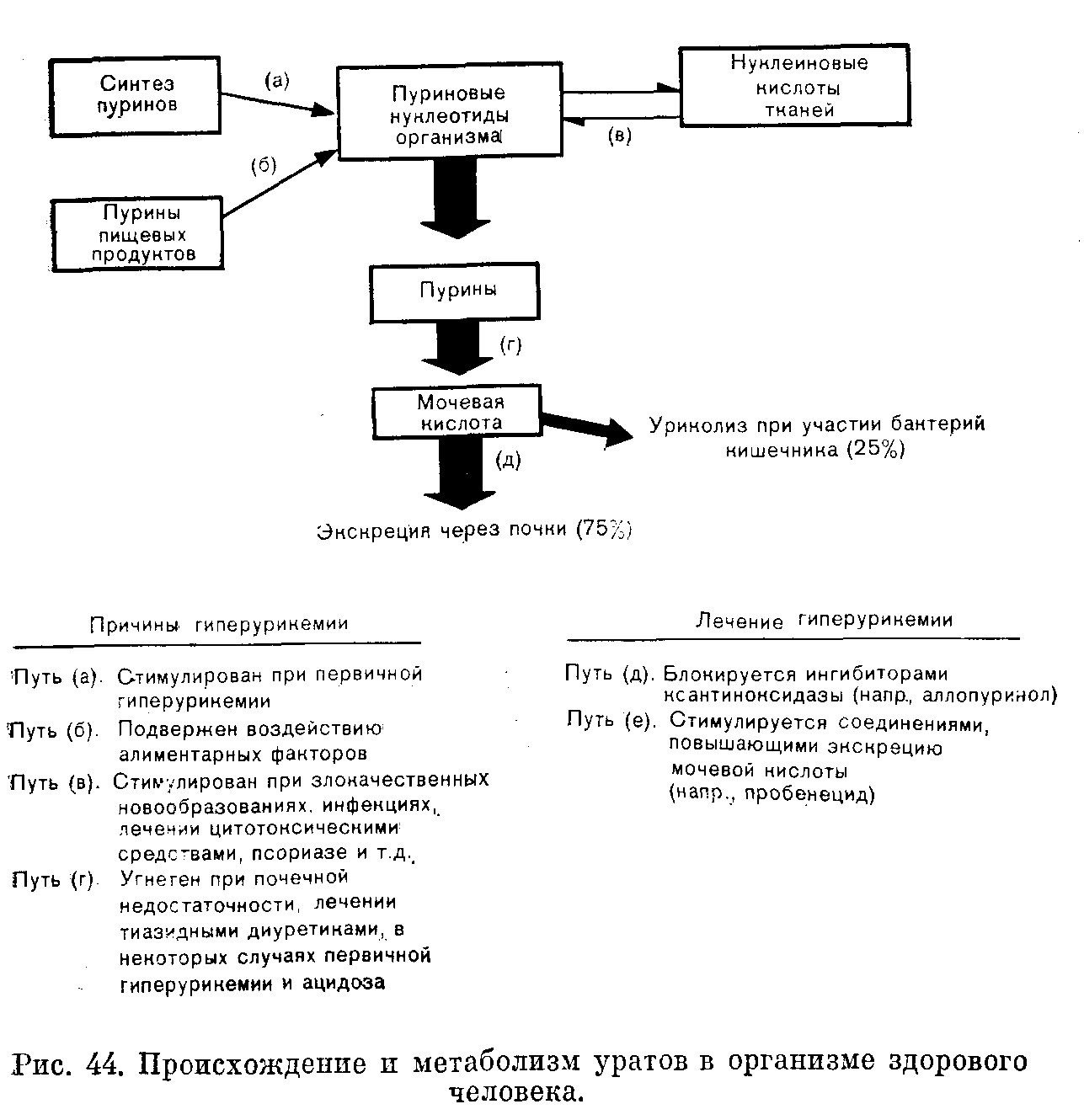 Причины гиперурикемии На рис. 44 перечислены факторы, которые могут участвовать в развитии гиперурикемии. Эти факторы связаны либо с повышением скорости образования уратов [повышение синтеза пуринов (этап а), повышение содержания пуринов в пище (этап б), стимуляция обновления нуклеиновых кислот (этап в)], либо со снижением скорости экскреции уратов (этап д). Нарушения этапов (б), (в) и (д) вызывают вторичную гиперурикемию. Наиболее важные механизмы развития первичной гиперурикемии, по-видимому, связаны со стимуляцией процессов синтеза. Последствия гиперурикемии Растворимость уратов в плазме крови ограничена. Образованию их осадков в тканях может благоприятствовать целый ряд локальных факторов, из которых наиболее важными, по-видимому, являются рН тканп и травма. Кристаллизация уратов в суставах (особенно ног) приводит к развитию классической картины подагры, описанной впервые Гиппократом в 460 г. до н. э. Полагают, что местный воспалительный процесс, обусловленный преципитацией уратов, вызывает увеличение числа лейкоцитов в очаге воспаления, образование этими клетками молочной кислоты понижает локальный рН. Эти процессы приводят к уменьшению растворимости уратов и установлению порочного цикла, следствием чего является дальнейшая преципитация уратов. Следует отметить, что для появления приступов острого подагрического артрита местные факторы более важны, чем концентрация уратов в плазме крови; последняя может даже быть в пределах нормы во время приступа. Преципитация уратов может происходить также в других тканях. Накопления уратов под кожей (что встречается особенно часто в ушах. локтевых и коленных суставных сумках или сухожилиях) называют подагрическими узелками (отложениями). Приступы подагры крайне болезненны и неприятны; они могут приводить к необратимой деформации суставов. Подагрические узелки сами по себе безвредны, но обезображивают больного. Серьезные последствия гиперурикемии обусловлены преципитацией уратов в почках, что приводит к их повреждению. Именно по этой причине рекомендуется лечить даже бессимптомные случаи гиперурикемии, когда концентрация уратов в плазме крови длительно сохраняется на уровне, превышающем 0,6 ммоль/л (10 мг/дл). Первичная гиперурикемия и подагра Заболеваемость и наследственность. В 150 г. н. э. Гален указывал, что подагра обусловлена «распущенностью, несдержанностью и наследственностью». Как мы увидим, «несдержанность» может усугублять проявления заболевания. Поразительная взаимосвязь между заболеваемостью и наследственностью в случаях гиперурикемии подтверждает значение фактора «наследственности». В этом отношении, однако, мы информированы немногим лучше Галена, поскольку характер наследования (как и при сахарном диабете) все еще окончательно не выяснен. Пол, возраст и заболеваемость. Подагра и гиперурикемия редки у женщин репродуктивного возраста и очень редки у детей. Различие в заболеваемости между мужчинами и женщинами не обусловлено сцепленным с полом наследованием, поскольку мужчины могут быть гетерозиготными носителями патологического состояния. Концентрация уратов в плазме крови, низкая у детей, нарастает при половом созревании, причем в большей степени у мужчин, чем у женщин. Женщины становятся более склонными к гиперурикемии и подагре в период, следующий за наступлением менопаузы (сравните с данными о содержании холестерина и железа в плазме крови). Возможно, что уровень половых гормонов оказывает воздействие на экскрецию уратов с мочой. Способствующие факторы. Классический образ больного, страдающего подагрой, — краснолицый, живущий в достатке и много» пьющий помещик, каким его изображали и описывали в XVIII веке. Гален упоминал о «распущенности и несдержанности», характеризуя причины подагры. У людей этого типа, по-видимому, высокая заболеваемость клинически диагностируемой подагрой объясняется воздействием двух факторов: алкоголя и мясной пищи. Показано, что алкоголь уменьшает экскрецию уратов с мочой. Этот эффект может быть связан с увеличением образования молочной кислоты, угнетающей экскрецию уратов. Диета, богатая мясными продуктами, отличается высоким содержанием пуринов. Ни один из этих факторов не способствует развитию подагрыу здорового человека, но может оказать действие на человека, предрасположенного к гиперурпкемии. По еще по выясненным причинам, гипорурпкемия и даже клинически диагностируемая подагра относительно часто встречаются у больных с гиперкальциемией (вне зависимости от вызвавшей ее причины) и у лиц с повторно образующимися кальцийсодержащими почечными камнями, даже без гиперкальциемпи. Нарушения биохимических процессов при первичной гиперурикемии. При помощи меченого глицина было установлено, что приблизительно в 25% случаев первичной гиперурикемии синтез пуринов стимулирован. Возможно повышение активности фермента, катализирующего образование фосфорибозиламина (см. рис. 43). Это явление может быть обусловлено нарушением свойственного норме угнетающего (по принципу обратной связи) эффекта пуклеотидов на синтез пуринов. В других случаях первичной гиперурикемии было также показано угнетение секреции уратов в почках. У многих больных может быть и повышенный синтез, и пониженная экскреция" уратов. Принципы лечения при гиперурикемии. Лечение может быть основано на следующих подходах: 1) снижение поступления пуринов с пищей [этап (б), см. рис. 44]. Этот подход сам по себ& не очень эффективен; 2) повышение экскреции уратов с мочой с помощью таких стимулирующих выведение уратов соединений,. как пробенецид и салицилаты в высоких дозах [этап (д), см.рис. 44]. При нормальном функционировании почек такие средства очень эффективны, но они бесполезны в условиях почечной" недостаточности. Необходимо обеспечить поступление в организм' больших объемов жидкости. Низкие дозы препаратов, стимулирующих выведение уратов, как правило, понижают их секрецию; 3) уменьшение образования уратов с помощью таких блокирующих ксантиноксидазу [этап (г), см. рис. 44] препаратов, как аллопуринол (оксипиразолопиримидин). Это соединение, сходное по структуре с гипоксантином, действует как конкурентный ингибитор указанного фермента и может также угнетать синтез ксантиноксидазы de novo; 4) колхицин, оказывающий противовоспалительный эффект при остром подагрическом артрите, не влияет на обмен уратов. Ювенильная гиперурикемия (синдром Леша—Нихена). При этом крайне редком врожденном заболевании (наследуемом, по-видимому, по Хсцепленному рецессивному типу) у маленьких мальчиков развивается тяжелая гиперурикемия. У больных отмечают недостаточность фермента гипоксантингуанинфосфорибозилтрансферазы (ГФРТ). При этом для синтеза пуриновых нуклеотидов не могут быть повторно использованы гипоксантпн п другие пурппы, в результате чего, вероятно, происходит стимуляция образования из них уратов. При этом синдроме наблюдается умственная отсталость, склонность к самоистязанию, агрессивное поведение, атетоз и спастическая параплегия. Недостаточность глюкозо6фосфатазы. Склонность к развитию гиперурикемни у больных с недостаточностью глюкозо6фосфатазы непосредственно связана с нарушением превращения глюкозо6фосфата в глюкозу. В этих условиях нарастает количество Г6Ф, участвующего в следующих внутриклеточных превращениях: 1) реакция пептозофосфатного пути, обеспечивающая стимуляцию синтеза рибозофосфата (фосфорибозы). Это может способствовать ускорению первого этапа синтеза пуринов, следствием чего будет чрезмерное образование уратов; 2) гликолиз, обеспечивающий образование молочной кислоты. Молочная кислота может уменьшать экскрецию уратов с мочой. Вторичная гиперурикемия Высокие уровни уратов в плазме крови могут быть обусловлены: усиленным обменом нуклеиновых кислот {(в), см. рис. 44], быстро растущими злокачественными новообразованиями (особенно лейкозы и истинная полицитемия), лечением злокачественных опухолей, псориазом, усиленным распадом тканей (острое голодание, повреждение тканей), снижением экскреции уратов [этап (д), см. рис. 44], что происходит при недостаточности почечных клубочков, лечении диуретиками, ацидозе. Усиленный обмен нуклеиновых кислот при злокачественных новообразованиях может вызвать гиперурикемию. Лечение больших опухолей методами радиотерапии пли с помощью цитотоксических лекарственных средств может вызвать высвобождение больших количеств уратов. При этом в результате блокирования почечных канальцев кристаллами мочевой кислоты может развиться острая почечная недостаточность. Во время указанных лечебных процедур рекомендуется назначать аллопуринол; при удовлетворительном функционировании почек следует вводить в организм большие объемы жидкости. Голодание и повреждение тканей. При остром голодании или повреждении тканей происходит усиленный эндогенный распад тканей, что сопровождается повышением количеств образующихся уратов. В условиях обоих указанных патологических состояний, по-видимому, развивается ацидоз (обусловленный в случаях .кетоза голоданием, а при обоих состояниях — процессами тканевого катаболизма), причем кислоты, очевидно, подавляют экскрецию уратов с мочой, усугубляя проявления гиперурикемии. При полном голодании концентрация уратов может достигать 0,9 ммоль/л (15 мг/дл) и более. Недостаточность почечных клубочков вызывает задержку в организме уратов и других конечных продуктов обмена веществ. Определяя содержание уратов в плазме крови, всегда следует измерять концентрацию мочевниы в этой же пробе, чтобы исключить недостаточность почечных клубочков в качестве причины гиперурикемии. Мы уже упоминали о том, что гиперурикемия может вызывать почечную недостаточность, а в условиях уремии может быть трудно отличить причину от следствия. При концентрации мочевины около 50 ммоль/л (300 мг/дл) можно ожидать, что содержание уратов в плазме крови будет приблизительно 0,6—0,7 ммоль/л (10—12 мг/дл); если обнаружены значительно более высокие величины, следует предполагать, что первичной причиной почечной недостаточности является гиперурикемия. При вторичной гиперурикемии, обусловленной почечной недостаточностью, клинически диагностируемая подагра встречается редко. Существует мнение, что при почечной недостаточности усиливается секреторная деятельность кишечника и бактериальный уриколиз. Это может объяснить тот факт, что, хотя увеличение концентраций мочевины и уратов в плазме крови происходит параллельно, при расчете на моль увеличение содержания уратов меньше увеличения содержания мочевины. При лечении диуретиками гиперурикемия встречается относительно часто, хотя развитие при этом клинических симптомов подагры является редким осложнением. Диуретики угнетают экскрецию уратов с мочой. Ложная подагра. Ложная подагра не является нарушением обмена пуринов, но приводит к развитию клинической картины, напоминающей подагру. В полостях суставов образуется осадок пирофосфата кальция; рентгенологически обнаруживают кальцификацию хрящей. Кристаллы можно идентифицировать с помощью поляризационного микроскопа. Содержание уратов в плазме крови в пределах нормы. ГИПОУРИКЕМИЯ Гипоурикемия встречается редко, за исключением тех случаев, когда она возникает при лечении гиперурикемии. Данные о гипоурикемии представляют собой информацию второстепенного значения, указывающую на поражение проксимальных отделов почечных канальцев при пониженной реабсорбции уратов. Ксантинурией называют очень редкое врожденное нарушение обмена, при котором существует недостаточность ксантиноксидазы печени. Процесс распада пуринов оказывается блокированным на этапе превращения гипоксантина в ксантин. Уровни уратов в ллазме кровп и моче очень низкие. Повышение экскреции ксантина с мочой может приводить к образованию ксантиновых камней (не выяснено, по какой причине это не происходит во время лечения ингибиторами ксантиноксидазы; возможно, вследствие угнетения процессов биосинтеза). Характер наследования, по-видимому, аутосомнорецессивный. ЗАКЛЮЧЕНИЕ 1. Ураты представляют собой конечный продукт метаболизма пуринов. 2. Гиперурикемия может быть результатом усиленного обмена нуклеиновых кислот (злокачественные новообразования, повреждения тканей, голодание), усиленного синтеза пуринов (первичная подагра), снижения скорости экскреции уратов с мочой (недостаточность клубочков, тиазидные диуретики, ацидоз). 3. Гиперурикемию могут усугублять продукты питания, богатые пуринами, ацидоз или потребление больших количеств .алкоголя. 4. Первичная гиперурикемия и подагра, редко встречающиеся у женщин репродуктивного возраста, являются наследственными патологическими состояниями. 5. Поскольку тяжелая гиперурикемия может вызвать поражение почек, она требует лечения даже в отсутствие клинических симптомов. 6. Гипоурикемия встречается редко и обычно важного значения не имеет. Она наблюдается при очень редком врожденном нарушении метаболизма ксантинурии. ГЛАВА XVIII |
