Начальные лекции по фармакологии общие вопросы, рецептура, фармакокинетика и фармакодинамика.. Начальные лекции по фармакологии общие вопросы, рецептура, фарма. Общая фармакология и рецептура
 Скачать 0.63 Mb. Скачать 0.63 Mb.
|
|
8. Перенос лекарств в организме. Водная диффузия и диффузия в липидах (закон Фика). Активный транспорт. Перенос ЛС в организме может осуществляться водной и липидной диффузией, активным транспортом, эндо- и пиноцитозом. Особености перенос ЛС в организме водной диффузией: 1. Эпителиальные покровы (слизистые ЖКТ, полости рта и др.) – водная диффузия только очень малых молекул (метанол, ионы лития и т.д.) 2. Капилляры (кроме мозговых) – фильтрация веществ с молекулярной массой до 20-30 тыс. Да. 3. Капилляры мозга – в основном не имеют водных пор, за исключением областей гипофиза, эпифиза, зоны IV желудочка, хориоидного сплетения, медианного возвышения 4. Плацента – не имеет водных пор (хотя вопрос спорный). 5. Связывание ЛС с белками крови препятствует их выходу из кровяного русла, а значит, и водной диффузии 6. Диффузия в воде зависит от размеров молекул ЛС и водных пор Особенности липидной диффузии: 1. Основной механизм переноса ЛС через клеточные мембраны 2. Определяется липофильностью диффундируемого вещества (т.е. коэффициентом распределения «масло/вода») и градиентом концентрации, может быть ограничена очень низкой растворимостью вещества в воде (что препятствует проникновению ЛС в водную фазу мембран) 3. Легко диффундируют неполярные соединения, трудно – ионы. Любая диффузия (и водная, и в липидах) подчиняется закону диффузии Фика: Скорость диффузии – количество переносимых в единицу времени молекул лекарства; С1 - концентрация вещества снаружи мембраны;С2 - концентрация вещества изнутри мембраны. Следствие из закона Фика: 1) фильтрация ЛС тем выше, чем больше его концентрация в месте введения {S абсорбируемой поверхности в кишечнике больше, чем в желудке, поэтому абсорбция ЛС в кишечника более быстрая} 2) фильтрация ЛС тем выше, чем больше концентрация ЛС в месте введения 3) фильтрация ЛС тем выше, чем меньше толщина преодолеваемой биологической мембраны {толщина барьера в альвеолах легких значительно меньше, чем кожи, поэтому скорость абсорбции выше в легких} Активный транспорт – перенос ЛC независимо от градиента концентрации с использованием энергии АТФ, характерен для гидрофильных полярных молекул, ряда неорганических ионов, сахаров, аминокислот, пиримидинов. Характеризуется: а) избирательностью к определенным соединениям б) возможностью конкуренции двух веществ за один транспортный механизм в) насыщаемостью при высоких концентрациях вещества г) возможностью транспорта против градиента концентрации д) затратой энергии. 9. Центральный постулат фармакокинетики концентрация лекарства в крови – основной параметр для управления терапевтическим эффектом. Задачи, решаемые на основании знания этого постулата. Центральный постулат (догма) фармакокинетики: концентрация ЛВ в плазме крови детерминирует (количественно определяет) фармакологический эффект. В большинстве случаев скорость всасывания, распределения, метаболизма и экскреции ЛС пропорциональна их концентрации в плазме крови (подчиняется закону действующих масс), поэтому зная ее возможно: 1) определить период полуэлиминации (для ЛС с кинетикой первого порядка) 2) объяснить длительность некоторых токсических эффектов ЛС (для ЛС в высоких дозах с кинетикой насыщения) 3) рассчитать загрузочную и поддерживающие дозы ЛС, необходимые для обеспечения адекватного терапевтического действия 10. Биодоступность лекарств – определение, сущность, количественное выражение, детерминанты. Понятие о биодоступности Биодоступность (F) – характеризует полноту и скорость всасывания ЛС при внесистемных путях введения - отражает количество неизмененного вещества, которое достигло системного кровотока, относительно исходной дозы препарата. F составляет 100% для ЛС, которые вводят внутривенно. При введении другими путями F обычно меньше из-за неполной абсорбции и частичного метаболизма в периферических тканях. F равна 0, если ЛС не всасывается из просвета ЖКТ. Для оценки F строят кривую зависимости концентрации ЛС в крови от времени после его введения внутривенно, а также после введения исследуемым путем. Это т.н. фармакокинетические кривые зависимости «время-концентрация». Путем интегрирования находят значения площади под фармакокинетической кривой и рассчитывают F как отношение: Биодоступность > 70% считается высокой, ниже 30% - низкой. Детерминанты биодоступности: 1) скорость всасывания 2) полнота всасывания - недостаточная абсорбция ЛС вследствие его очень высокой гидрофильности или липофильности, метаболизма бактериями кишечника при энтеральном введении и т.д. 3) пресистемная элиминация – при высокой биотрансформация в печени F ЛС низкая (нитроглицерин при пероральном введении). 4) лекарственная форма - сублингвальные таблетки и ректальные суппозитории помогают ЛС избежать пресистемной элиминации. 11. Распределение лекарств в организме. Отсеки, лиганды. Основные детерминанты распределения. Распределение ЛС - процесс распространения ЛС по органам и тканям после того, как они поступят в системный кровоток. Отсеки распределения: 1. Внеклеточное пространство (плазма, межклеточная жидкость) 2. Клетки (цитоплазма, мембрана органелл) 3. Жировая и костная ткань (депонирование ЛС) У 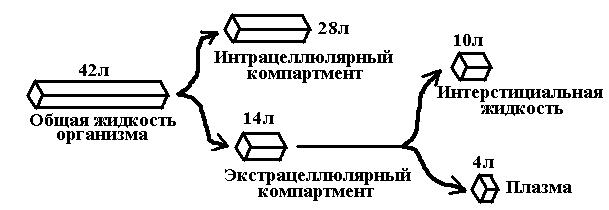 человека массой 70 кг объемы жидких сред составляют в целом 42 л, тогда если: человека массой 70 кг объемы жидких сред составляют в целом 42 л, тогда если:
Молекулярные лиганды ЛС: а) специфические и неспецифические рецепторы б) белки крови (альбумин, гликопротеин) и тканей в) полисахариды соединительной ткани г) нуклеопротеиды (ДНК, РНК) Детерминанты распределения:
Количественной характеристикой распределения лекарства является кажущийся объем распределения (Vd). Кажущийся объем распределения Vd – это гипотетический объем жидкости, в котором может распределиться вся введенная доза лекарства, чтобы создалась концентрация, равная концентрации в плазме крови. Vd равен отношению введенной дозы (общего количества лекарства в организме) к его концентрации в плазме крови: Чем больше кажущийся объем распределения, тем большая часть лекарств распределяется в ткани. 12. Константа элиминации, ее сущность, размерность, связь с другими фармакокинетическими параметрами. Константа скорости элиминации (kel, мин-1) – показывает, какая часть ЛС элиминируется из организма в единицу времени Kel = Aвыд/Аобщ, где Авыд – количество ЛС, выделяемое в ед. времени, Аобщ – общее количество ЛС в организме. Значение kel обычно находят путем решения фармакокинетического уравнения, описывающего процесс элиминации лекарства из крови, поэтому kel называют модельным показателем кинетики. Непосредственного отношения к планированию режима дозирования kel не имеет, но ее значение используют для расчета других фармакокинетических параметров. Константа элиминации прямо пропорциональна клиренсу и обратно пропорционально объему распределения (из определения клиренса): Kel=CL/Vd; [Ke] = час-1/мин-1=доля в час. 13. Период полувыведения лекарств, его сущность, размерность, взаимосвязь с другими фармакокинетическими параметрами. Период полуэлиминации (t½, мин) – это время, необходимое для снижения концентрации ЛС в крови ровно наполовину. При этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов. Период полуэлиминации определяют по формуле: Период полувыведения – важнейший фармакокинетический параметр, позволяющий: а) рассчитать время наступления равновесной концентрации (равно 5 периодам полуэлиминации) б) определить время полной элиминации препарата в) предсказать концентрацию ЛС в любой момент времени (для ЛС с кинетикой первого порядка) 14. Клиренс как главный параметр фармакокинетики для управления режимом дозирования. Его сущность, размерность и связь с другими фармакокинетическими показателями. Клиренс (Cl, мл/мин) - объем крови, который очищается от ЛС за единицу времени. Т.к. плазма (кровь) - «видимая» часть объема распределения, то клиренс – фракция объема распределения, из которой лекарство выделяется в единицу времени. Если обозначить общее количество лекарства в организме через Аобщ, а количество, которое выделилось через Авыд, то : С Таким образом, клиренс – отношение скорости выведения лекарственного средства к его концентрации в плазме крови. В таком виде формулу клиренса используют для расчета поддерживающей дозы лекарства (Dп), т.е той дозы лекарственного средства, которая должна скомпенсировать потерю лекарства и поддержать его уровень на постоянном уровне: Скорость введения = скорость выведения = ClCтер (доза/мин) Dп = скорость введения ( - интервал, между приемом лекарства) Клиренс аддитивен, т.е. элиминация вещества из организма может происходить с участием процессов, идущих в почках, легких, печени и других органах: Clсистемный = Clпочечн. + Clпечени + Clдр. Клиренс связан с периодом полуэлиминации ЛС и объемом распределения: t1/2=0,7*Vd/Cl. 15. Доза. Виды доз. Единицы дозирования лекарственных средств. Цели дозирования лекарств, способы и варианты введения, интервал введения. Действие ЛС на организм в большей степени определяется их дозой. Доза - количество вещества, введенное в организм за один прием; выражается в весовых, объемных или условных (биологических) единицах. Виды доз: а) разовая доза – количество вещества на один прием б) суточная доза - количество препарата, назначаемое на сутки в один или несколько приемов в) курсовая доза - общее количество препарата на курс лечения г) терапевтические дозы - дозы, в которых препарат используют с лечебными или профилактическими целями (пороговые, или минимальные действующие, средние терапевтические и высшие терапевтические дозы). д) токсические и смертельные дозы – дозы ЛВ, при которых они начинают оказывать выраженные токсические эффекты или вызывать смерть организма. е) загрузочная (вводная) доза – кол-во вводимого ЛС, которое заполняет весь объем распределения организма в действующей (терапевтической) концентрации: ВД = (Css * Vd)/F ж) поддерживающая доза – систематически вводимое количество ЛС, которое компенсирует потери ЛС с клиренсом: ПД = (Css * Cl * T)/F Единицы дозирования ЛС: 1) в граммах или долях грамма ЛС 2) количество ЛС в расчете на 1 кг массы тела (например, 1 мг/кг) или на единицу поверхности тела (например, 1 мг/м2) Цели дозирования ЛС: 1) определить количество ЛС, необходимое для того, чтобы вызвать нужный терапевтический эффект с определенной длительностью 2) избежать явлений интоксикации и побочных эффектов при введении ЛС Способы введения ЛС: 1) энтерально 2) парентерально (см. в. 5) Варианты введения ЛС: а) непрерывный (путем длительных внутрисосудистых инфузий ЛС капельно или через автоматические дозаторы). При непрерывном введении ЛС его концентрация в организме изменяется плавно и не подвергается значительным колебаниям б) прерывистое введение (инъекционным или неинъекционным способами) - введение лекарства через определенные промежутки времени (интервалы дозирования). При прерывистом введении ЛС его концентрация в организме непрерывно колеблется. После приема определенной дозы она вначале повышается, а затем постепенно снижается, достигая минимальных значений перед очередным введением лекарства. Колебания концентрации тем значительнее, чем больше вводимая доза лекарства и интервал между введениями. Интервал введения – интервал между вводимыми дозами, обеспечивающий поддержание терапевтической концентрации вещества в крови. 16. Введение лекарств с постоянной скоростью. Кинетика концентрации препарата в крови. Стационарная концентрация препарата в крови (Css), время ее достижения, расчет и управление ею.  Особенность введения ЛС с постоянной скоростью - плавное изменение его концентрации в крови при введении, при этом: Особенность введения ЛС с постоянной скоростью - плавное изменение его концентрации в крови при введении, при этом:1) время достижения стационарной концентрации лекарства составляет 4-5t½ и не зависит от скорости инфузии (величины вводимой дозы) 2) при увеличении скорости инфузии (вводимой дозы) величина СSS также увеличивается в пропорциональное число раз 3) элиминация лекарства из организма после прекращения инфузии занимает 4-5t½. Сss – равновесная стационарная концентрация – концентрация ЛС, достигаемая при скорости введения равной скорости выведения, поэтому: За каждый последующий период полувыведения концентрация ЛС прирастает на половину от оставшейся концентрации. Все ЛС, подчиняющиеся закону элиминации первого порядка, будут достигать Css через 4-5 периодов полувыведения. Подходы к управлению уровнем Сss: изменить вводимую дозу ЛС или интервал введения 17. Прерывистое введение лекарств. Кинетика концентрации препарата в крови, терапевтический и токсический диапазон концентраций. Расчет стационарной концентрации (C ss), границ ее колебаний и управление ею. Адекватный интервал введения дискретных доз. К  олебания концентрации ЛС в плазме крови: 1 - при постоянном внутривенном капельном введении; 2 —при дробном введении той же суточной дозы с интервалом 8 ч;3 — при введении суточной дозы с интервалом 24 ч. олебания концентрации ЛС в плазме крови: 1 - при постоянном внутривенном капельном введении; 2 —при дробном введении той же суточной дозы с интервалом 8 ч;3 — при введении суточной дозы с интервалом 24 ч.Прерывистое введение ЛС – введение определенного количества ЛС через некоторые промежутки времени. Равновесная стационарная концентрация достигается через 4-5 периодов полуэлиминации, время ее достижения не зависит от дозы (в начале, когда уровень концентрации ЛС невысок, скорость его элиминации также невысока; по мере увеличения количества вещества в организме нарастает и скорость его элиминации, поэтому рано или поздно наступит такой момент, когда возросшая скорость элиминации уравновесит вводимую дозу ЛС и дальнейший рост концентрации прекратиться) Границы колебаний Css: |
