Микробиология. Общая микробиология
 Скачать 476.77 Kb. Скачать 476.77 Kb.
|
|
Антигены: определение, строение, основные свойства. Антигены бактерий и вирусов. Антиген – это биополимер органической природы, генетически чужеродный для макроорганизма, который при попадании в последний распознаётся его иммунной системой и вызывает иммунные реакции, направленные на его устранение. Антигены обладают рядом характерных свойств: антигенностью, специфичностью и иммуногенностью. Антигенность. Под антигенностью понимают потенциальную способность молекулы антигена активировать компоненты иммунной системы и специфически взаимодействовать с факторами иммунитета (антитела, клон эффекторных лимфоцитов). Иными словами, антиген должен выступать специфическим раздражителем по отношению к иммунокомпетентным клеткам. При этом взаимодействие компоненты иммунной системы происходит не со всей молекулой одновременно, а только с ее небольшим участком, который получил название «антигенная детерминанта», или «эпитоп». Чужеродность является обязательным условием для реализации антигенности. По этому критерию система приобретенного иммунитета дифференцирует потенциально опасные объекты биологического мира, синтезированные с чужеродной генетической матрицы. Понятие «чужеродность» относительное, так как имму-нокомпетентные клетки не способны напрямую анализировать чужеродный генетический код. Они воспринимают лишь опосредованную информацию, которая, как в зеркале, отражена в молекулярной структуре вещества. Иммуногенность — потенциальная способность антигена вызывать по отношению к себе в макроорганизме специфическую защитную реакцию. Степень иммуногенности зависит от ряда факторов, которые можно объединить в три группы: 1. Молекулярные особенности антигена; 2. Клиренс антигена в организме; 3. Реактивность макроорганизма. К первой группе факторов отнесены природа, химический состав, молекулярный вес, структура и некоторые другие характеристики. Иммуногенность в значительной степени зависит от природы антигена. Важна также оптическая изомерия аминокислот, составляющих молекулу белка. Большое значение имеет размер и молекулярная масса антигена. На степень иммуногенности также оказывает влияние пространственная структура антигена. Оказалась также существенной стерическая стабильность молекулы антигена. Еще одним важным условием иммуногенности является растворимость антигена. Вторая группа факторов связана с динамикой поступления антигена в организм и его выведения. Так, хорошо известна зависимость иммуногенности антигена от способа его введения. На иммунный ответ влияет количество поступающего антигена: чем его больше, тем более выражен иммунный ответ. Третья группа объединяет факторы, определяющие зависимость иммуногенности от состояния макроорганизма. В этой связи на первый план выступают наследственные факторы. Специфичностьюназывают способность антигена индуцировать иммунный ответ к строго определенному эпитопу. Это свойство обусловлено особенностями формирования иммунного ответа — необходима комплементарность рецепторного аппарата иммунокомпетентных клеток к конкретной антигенной детерминанте. Поэтому специфичность антигена во многом определяется свойствами составляющих его эпитопов. Однако при этом следует учитывать условность границ эпитопов, их структурное разнообразие и гетерогенность клонов антигенреактивных лимфоцитовой специфичности. В результате этого организм на антигенное раздражение всегда отвечает поликлональными иммунным ответом. Антигены бактерий и вирусов Бактериальные антигены. Стенка (наружная мембрана) бактериальной клетки значительно плотнее, чем мембрана животных клеток. В случае грамотрицательных бактерий в ней содержится ЛПС; некоторые виды бактерий образуют еще и поверхностную полисахаридную капсулу, а другие способны экскретировать полисахариды (например, декстраны). Все это служит источником полисахаридных антигенов микрорганизма. Если бактерии или простейшие подвижны, то антигеном может быть белок жгутиков, а в других случаях (гонококки) – белок пилей, также выходящих на клеточную поверхность. Кроме поверхностных (обычно – протективных) антигенов, в бактериях имеются и глубоко лежащие (например, нуклеопротеины, белки клеточных органелл, некоторые ферменты). Они также вызывают образование антител, но обычно к протективным не относятся, хотя возможны и исключения, когда тот или иной белок является фактором патогенности. Ввиду значительных различий по свойствам между капсульными полисахаридами и ЛПС – с одной стороны – и белковыми антигенами – с другой, удобно рассматривать первую группу антигенов особо. Классические антигенные белки – это анатоксины (дифтерийный, столбнячный и др.). Вирусы – чрезвычайно гетерогенная группа возбудителей инфекционных заболеваний. Инфекционные частицы (вирионы) различных вирусов обладают различной степенью сложности, различным размером, различными молекулярными механизмами репликации (в частности, одни из них содержат ДНК, другие – РНК). Особенности вирусных инфекций создают большое разнообразие во взаимоотношениях между возбудителями и иммунной системой. Все вирусные антигены имеют белковую природу; среди них – гликопротеины (обычно – поверхностные), фосфопротеины, нуклеопротеины. Чаще всего протективными являются поверхностные в вирионе гликопротеины, хотя образуемые в ходе иммунного ответа антитела направлены против многих белков, в том числе и расположенных в нуклеокапсиде, "в глубине" вириона. Принципиальная, отличительная от других возбудителей особенность репродукции вирусов заключается в том, что не все белки, синтез которых индуцируется в инфицированной клетке, входят затем в состав вириона. Часть из них является вспомогательными, обеспечивающими процесс репродукции. Тем не менее, они также могут попадать во внеклеточную среду и служить иммунизирующим материалом. У большинства вирусов имеются суперокапсидные – поверхностные оболочечные, белковые и гликопротеидные АГ (например, гемагглютинин и нейраминидаза вируса гриппа), капсидные – оболочечные и нуклеопротеидные (сердцевинные) АГ. Все вирусные антигены – Т-зависимые. Строение молекулы иммуноглобулина. Классы иммуноглобулинов, их характеристика, структура и функции. Антителообразование: первичный и вторичный ответы. Природа иммуноглобулинов. В ответ на введение антигена иммунная система вырабатывает антитела — белки, способные специфически соединяться с антигеном, вызвавшим их образование, и таким образом участвовать в иммунологических реакциях. Относятся антитела к γ-глобулинам, т. е. наименее подвижной в электрическом поле фракции белков сыворотки крови. В организме γ-глобулины вырабатываются особыми клетками — плазмоцитами. γ-глобулины, несущие функции антител, получили название иммуноглобулинов и обозначаются символом Ig. Следовательно, антитела — это иммуноглобулины, вырабатываемые в ответ на введение антигена и способные специфически взаимодействовать с этим же антигеном. Функции. Первичная функция состоит во взаимодсйствии их активных центров с комплементарными им детерминантами антигенов. Вторичная функция состоит в их способности: • связывать антиген с целью его нейтрализации и элиминации из организма, т. е. принимать участие в формировании защиты от антигена; • участвовать в распознавании «чужого» антигена; • обеспечивать кооперацию иммунокомпетентных клеток (макрофагов, Т- и В-лимфоцитов); • участвовать в различных формах иммунного ответа (фагоцитоз, киллерная функция, ГНТ, ГЗТ, иммунологическая толерантность, иммунологическая память). Структура антител. Белки иммуноглобулинов по химическому составу относятся к гликопротеидам, так как состоят из протеина и Сахаров; построены из 18 аминокислот. Имеют видовые отличия, связанные главным образом с набором аминокислот. Их молекулы имеют цилиндрическую форму, они видны в электронном микроскопе. До 80 % иммуноглобулинов имеют константу седиментации 7S; устойчивы к слабым кислотам, щелочам, нагреванию до 60 °С. Выделить иммуноглобулины из сыворотки крови можно физическими и химическими методами (электрофорез, изоэлектрическое осаждение спиртом и кислотами, высаливание, аффинная хроматография и др.). Эти методы используют в производстве при приготовлении иммунобиологических препаратов. Иммуноглобулины по структуре, антигенным и иммунобиологическим свойствам разделяются на пять классов: IgM, IgG, IgA, IgE, IgD. Иммуноглобулины М, G, А имеют подклассы. Например, IgG имеет четыре подкласса (IgG,, IgG2, IgG3, IgG4). Все классы и подклассы различаются по аминокислотной последовательности. Молекулы иммуноглобулинов всех пяти классов состоят из полипептидных цепей: двух одинаковых тяжелых цепей Н и двух одинаковых легких цепей — L, соединенных между собой дисульфидными мостиками. Соответственно каждому классу иммуноглобулинов, т.е. М, G, A, E, D, различают пять типов тяжелых цепей: μ (мю), γ (гамма), α (альфа), ε (эпсилон) и Δ (дельта), различающихся по антигенности. Легкие цепи всех пяти классов являются общими и бывают двух типов: κ (каппа) и λ (ламбда); L-цепи иммуноглобулинов различных классов могут вступать в соединение (рекомбинироваться) как с гомологичными, так и с гетерологичными Н-цепями. Однако в одной и той же молекуле могут быть только идентичные L-цепи (κ или λ). Как в Н-, так и в L-цепях имеется вариабельная — V область, в которой последовательность аминокислот непостоянна, и константная — С область с постоянным набором аминокислот. В легких и тяжелых цепях различают NH2- и СООН-концевые группы. При обработке γ -глобулина меркаптоэтанолом разрушаются дисульфидные связи и молекула иммуноглобулина распадается на отдельные цепи полипептидов. При воздействии протеолитическим ферментом папаином иммуноглобулин расщепляется на три фрагмента: два не кристаллизующихся, содержащих детерминантные группы к антигену и названных Fab-фрагментами I и II и один кристаллизующий Fc-фрагмент. FabI- и FabII-фрагменты сходны по свойствам и аминокислотному составу и отличаются от Fc-фрагмента; Fab-и Fc-фрагменты являются компактными образованиями, соединенными между собой гибкими участками Н-цепи, благодаря чему молекулы иммуноглобулина имеют гибкую структуру. Как Н-цепи, так и L-цепи имеют отдельные, линейно связанные компактные участки, названные доменами; в Н-цепи их по 4, а в L-цепи — по 2. Активные центры, или детерминанты, которые формируются в V-областях, занимают примерно 2 % поверхности молекулы иммуноглобулина. В каждой молекуле имеются две детерминанты, относящиеся к гипервариабельным участкам Н-и L-цепей, т. е. каждая молекула иммуноглобулина может связать две молекулы антигена. Поэтому антитела являются двухвалентными. Типовой структурой молекулы иммуноглобулина является IgG. Остальные классы иммуноглобулинов отличаются от IgG дополнительными элементами организации их молекулы. В ответ на введение любого антигена могут вырабатываться антитела всех пяти классов. Обычно вначале вырабатывается IgM, затем IgG, остальные — несколько позже Существует пять классов иммуноглобулинов у человека 1. Иммуноглобулины G – это мономеры, включающие в себя четыре субкласса (IgG1; IgG2; IgG3; IgG4), которые отличаются друг от друга по аминокислотному составу и антигенным свойствам. Антитела субклассов IgG1 и IgG4 специфически связываются через Fc-фрагменты с возбудителем (иммунное опсонирование), а благодаря Fc-фрагментам взаимодействуют с Fc-рецепторами фагоцитов, способствуя фагоцитозу возбудителя. IgG4 участвует в аллергических реакциях и неспособен фиксировать комплемент. Свойства иммуноглобулинов G: 1) играют основополагающую роль в гуморальном иммунитете при инфекционных заболеваниях; 2) проникают через плаценту и формируют антиинфекционный иммунитет у новорожденных; 3) способны нейтрализовать бактериальные экзотоксины, связывать комплемент, участвовать в реакции преципитации. 2. Иммуноглобулины М включают в себя два субкласса: IgM1 и IgM2. Свойства иммуноглобулинов М: 1) не проникают через плаценту; 2) появляются у плода и участвуют в антиинфекционной защите; 3) способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент; 4) играют важную роль в элиминации возбудителя из кровеносного русла, активации фагоцитоза; 5) образуются на ранних сроках инфекционного процесса; 6) отличаются высокой активностью в реакциях агглютинации, лизиса и связывания эндотоксинов грамотрицательных бактерий. 3. Иммуноглобулины А – это секреторные иммуноглобулины, включающие в себя два субкласса: IgA1 и IgA2. В состав IgA входит секреторный компонент, состоящий из нескольких полипептидов, который повышает устойчивость IgA к действию ферментов. Свойства иммуноглобулинов А: 1) содержатся в молоке, молозиве, слюне, слезном, бронхиальном и желудочно-кишечном секрете, желчи, моче; 2) участвуют в местном иммунитете; 3) препятствуют прикреплению бактерий к слизистой; 4) нейтрализуют энтеротоксин, активируют фагоцитоз и комплемент. 4. Иммуноглобулины Е – это мономеры, содержание которых в сыворотке крови ничтожно мало. К этому классу относится основная масса аллергических антител – реагинов. Уровень IgE значительно повышается у людей, страдающих аллергией и зараженных гельминтами. IgE связывается с Fc-рецепторами тучных клеток и базофилов. Свойства иммуноглобулинов Е: при контакте с аллергеном образуются мостики, что сопровождается выделением БАВ, вызывающих аллергические реакции немедленного типа. 5. Иммуноглобулины D – это мономеры. Функционируют в основном в качестве мембранных рецепторов для антигена. Плазматические клетки, секретирующие IgD, локализуются преимущественно в миндалинах и аденоидной ткани. Свойства иммуноглобулинов D: 1) участвуют в развитии местного иммунитета; 2) обладают антивирусной активностью; 3) активируют комплемент (в редких случаях); 4) участвуют в дифференцировке В-клеток, способствуют развитию антиидиотипического ответа; 5) участвуют в аутоиммунных процессах. Антителообразование: Способность к образованию антител появляется во внутриутробном периоде у 20-недельного эмбриона; после рождения начинается собственная продукция иммуноглобулинов, которая увеличивается до наступления зрелого возраста и несколько снижается к старости. Динамика образования антител имеет различный характер в зависимости от силы антигенного воздействия (дозы антигена), частоты воздействия антигена, состояния организма и его иммунной системы. При первичном и повторном введении антигена динамика антителообразования также различна и протекает в несколько стадий. Выделяют латентную, логарифмическую, стационарную фазу и фазу снижения. 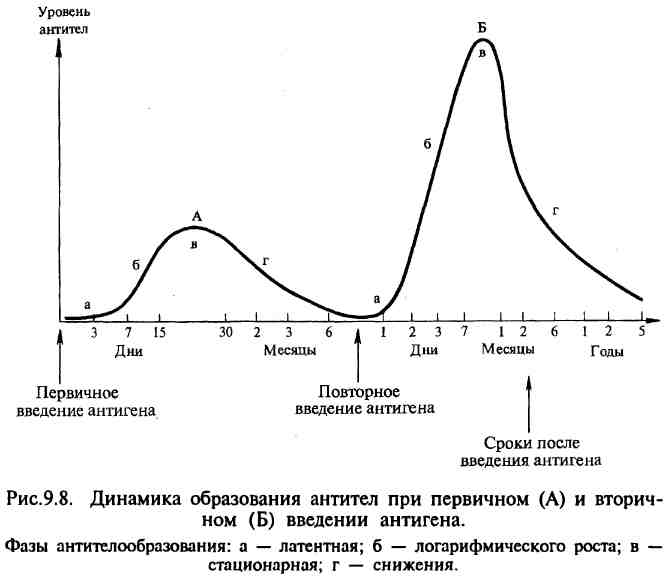 В латентной фазе происходят переработка и представление антигена иммунокомпетентным клеткам, размножение клона клеток, специализированного на выработку антител к данному антигену, начинается синтез антител. В этот период антитела в крови не обнаруживаются. Во время логарифмической фазы синтезированные антитела высвобождаются из плазмоцитов и поступают в лимфу и кровь. В стационарной фазе количество антител достигает максимума и стабилизируется, затем наступает фаза снижения уровня антител. При первичном введении антигена (первичный иммунный ответ) латентная фаза составляет 3—5 сут, логарифмическая — 7— 15 сут, стационарная — 15—30 сут и фаза снижения — 1—6 мес и более. Особенностью первичного иммунного ответа является то, что первоначально синтезируется IgM, а затем IgG. В отличие от первичного иммунного ответа при вторичном введении антигена (вторичный иммунный ответ) латентный период укорочен до нескольких часов или 1—2 сут, логарифмическая фаза характеризуется быстрым нарастанием и значительно более высоким уровнем антител, который в последующих фазах длительно удерживается и медленно, иногда в течение нескольких лет, снижается. При вторичном иммунном ответе в отличие от первичного синтезируются главным образом IgG. Такое различие динамики антителообразования при первичном и вторичном иммунном ответе объясняется тем, что после первичного введения антигена в иммунной системе формируется клон лимфоцитов, несущих иммунологическую память о данном антигене. После повторной встречи с этим же антигеном клон лимфоцитов с иммунологической памятью быстро размножается и интенсивно включает процесс антителогенеза. Очень быстрое и энергичное антителообразование при повторной встрече с антигеном используется в практических целях при необходимости получения высоких титров антител при производстве диагностических и лечебных сывороток от иммунизированных животных, а также для экстренного создания иммунитета при вакцинации. Схема Th1 ответа. Эффекторы клеточного ответа. Пусковым звеном в формировании клеточного типа иммунного ответа является продукция макрофагом, на территории которого идет процессинг антигена, интерлейкина ИЛ-12. События развиваются следующим образом. ГКГС - I макрофага презентирует пептид (антиген) Т-хелперу (CD 4 ). Под влиянием ИЛ-12, продуцируемого этим же макрофагом, Th трансформируется в Th 1. g - IFN является важнейшим из цитокинов , выделяемых Th 1. Он активирует контакт Т CD 8 с рецептором ГКГС - I макрофага, на котором представлен тот же антиген. Выделяемый Th 1 ИЛ-2 стимулирует пролиферацию таких, уже антигенспецифических Т-цитолитических лимфоцитов (Тс). Главной функцией Т с в противоинфекционной защите является уничтожение соматических клеток организма, внутри которых находится возбудитель, а на поверхности - метка, комплекс ГКГС-I - антиген патогена . При прямом контакте с такой клеткой Т с выделят гранулы, содержащие белки - перфорин , гранзим . Перфорин встраивается в мембрану соматической клетки, образует в ней каналы «поры» и может действовать как мембраноатакующий белок. Гранзим ( сериновые протеиназы ) индуцирует один из вариантов апоптоза и гибель соматической клетки вместе с находящимися в ней микробами. Выделяют три основные группы Т- лимфоцитов- помощники (активаторы), эффекторы, регуляторы. Первая группа- помощники (активаторы), в состав которых входят Т- хелперы1, Т- хелперы2, индукторы Т- хелперов, индукторы Т- супрессоров. 1. Т- хелперы1 несут рецепторы CD4 (как и Т- хелперы2) и CD44, отвечают за созревание Т- цитотоксических лимфоцитов (Т- киллеров), активируют Т- хелперы2 и цитотоксическую функцию макрофагов, секретируют ИЛ-2, ИЛ-3 и другие цитокины. 2. Т- хелперы2 имеют общий для хелперов CD4 и специфический CD28 рецепторы, обеспечивают пролиферацию и дифференцировку В- лимфоцитов в антителпродуцирующие (плазматические) клетки, синтез антител, тормозят функцию Т- хелперов1, секретируют ИЛ-4, ИЛ-5 и ИЛ-6. 3. Индукторы Т- хелперов несут CD29, отвечают за экспрессию антигенов HLA класса 2 на макрофагах и других А- клетках. 4. Индукторы Т- супрессоров несут CD45 специфический рецептор, отвечают за секрецию ИЛ-1 макрофагами, активацию дифференцировки предшественников Т- супрессоров. Вторая группа- Т- эффекторы. В нее входит только одна субпопуляция. 5. Т- цитотоксические лимфоциты (Т- киллеры). Имеют специфический рецептор CD8, лизируют клетки- мишени, несущие чужеродные антигены или измененные аутоантигены (трансплантант, опухоль, вирус и др.). ЦТЛ распознают чужеродный эпитоп вирусного или опухолевого антигена в комплексе с молекулой класса 1 HLA в плазматической мембране клетки- мишени. Третья группа- Т-клетки- регуляторы. Представлена двумя основными субпопуляциями. 6. Т- супрессоры имеют важное значение в регуляции иммунитета, обеспечивая подавление функций Т- хелперов 1 и 2, В- лимфоцитов. Имеют рецепторы CD11, CD8. Группа функционально разнородна. Их активация происходит в результате непосредственной стимуляции антигеном без существенного участия главной системы гистосовместимости. 7. Т- контсупрессоры. Не имеют CD4, CD8, имеют рецептор к особому лейкину. Способствуют подавлению |
