Микробиология. Общая микробиология
 Скачать 476.77 Kb. Скачать 476.77 Kb.
|
|
Способы получения энергии бактериями (дыхание, брожение). Принципы и методы выделения чистых культур аэробных бактерий. Дыхание, или биологическое окисление, основано на окислительно-восстановительных реакциях, идущих с образованием АТФ-универсального аккумулятора химической энергии. Энергия необходима микробной клетке для ее жизнедеятельности. При дыхании происходят процессы окисления и восстановления: окисление — отдача донорами (молекулами или атомами) водорода или электронов; восстановление — присоединение водорода или электронов к акцептору. Акцептором водорода или электронов может быть молекулярный кислород (такое дыхание называется аэробным) или нитрат, сульфат, фумарат (такое дыхание называется анаэробным — нитратным, сульфатным, фумаратным). Анаэробиоз (от греч. аег — воздух + bios — жизнь) — жизнедеятельность, протекающая при отсутствии свободного кислорода. Если донорами и акцепторами водорода являются органические соединения, то такой процесс называется брожением. При брожении происходит ферментативное расщепление органических соединений, преимущественно углеводов, в анаэробных условиях. С учетом конечного продукта расщепления углеводов различают спиртовое, молочнокислое, уксуснокислое и другие виды брожения. По отношению к молекулярному кислороду бактерии можно разделить на три основные группы: облигатные, т.е. обязательные, аэробы, облигатные анаэробы и факультативные анаэробы. Методы культивирования анаэробов. Для культивирования анаэробов необходимо понизить окислительно-восстановительный потенциал среды, создать условия анаэробиоза, т. е. пониженного содержания кислорода в среде и окружающем ее пространстве. Это достигается применением физических, химических и биологических методов. Физические методы. Основаны на выращивании микроорганизмов в безвоздушной среде, что достигается: 1) посевом в среды, содержащие редуцирующие и легко окисляемые вещества; 2) посевом микроорганизмов в глубину плотных питательных сред; 3) механическим удалением воздуха из сосудов, в которых выращиваются анаэробные микроорганизмы; 4) заменой воздуха в сосудах каким-либо индифферентным газом. В качестве редуцирующих веществ обычно используют кусочки (около 0,5 г) животных или растительных тканей (печень, мозг, почки, селезенка, кровь, картофель, вата). Эти ткани связывают растворенный в среде кислород и адсорбируют бактерии. Чтобы уменьшить содержание кислорода в питательной среде, ее перед посевом кипятят 10—15 мин, а затем быстро охлаждают и заливают сверху небольшим количеством стерильного вазелинового масла. Высота слоя масла в пробирке около 1 см. В качестве легко окисляемых веществ используют глюкозу, лактозу и муравьинокислый натрий. Лучшей жидкой питательной средой с редуцирующими веществами является среда Китта — Тароцци, которая используется с успехом для накопления анаэробов при первичном посеве из исследуемого материала и для поддержания роста выделенной чистой культуры анаэробов. Посев микроорганизмов в глубину плотных сред производят по способу Виньяль — Вейона, который состоит в механической защите посевов анаэробов от кислорода воздуха. Берут стеклянную трубку длиной 30 см и диаметром 3—6 мм. Один конец трубки вытягивают в капилляр в виде пастеровской пипетки, а у другого конца делают перетяжку. В оставшийся широкий конец трубки вставляют ватную пробку. В пробирки с расплавленным и охлажденным до 50°С питательным агаром засевают исследуемый материал. Затем насасывают засеянный агар в стерильные трубки Виньяль — Вейона. Капиллярный конец трубки запаивают в пламени горелки и трубки помещают в термостат. Так создаются благоприятные условия для роста самых строгих анаэробов. Для выделения отдельной колонии трубку надрезают напильником, соблюдая правила асептики, на уровне колонии, ломают, а колонию захватывают стерильной петлей и переносят в пробирку с питательной средой для дальнейшего выращивания и изучения в чистом виде. Удаление воздуха производят путем его механического откачивания из специальных приборов — анаэроста-тов, в которые помещают чашки с посевом анаэробов. Переносный анаэростат представляет собой толстостенный металлический цилиндр с хорошо притертой крышкой (с резиновой прокладкой), снабженный отводящим краном и вакуумметром. После размещения засеянных чашек или пробирок воздух из анаэростата удаляют с помощью вакуумного насоса. Замену воздуха индифферентным газом (азотом, водородом, аргоном, углекислым газом) можно производить в тех же анаэростатах путем вытеснения его газом из баллона. Химические методы. Основаны на поглощении кислорода воздуха в герметически закрытом сосуде (анаэро-стате, эксикаторе) такими веществами, как пирогаллол или гидросульфит натрия Na2S204. Биологические методы. Основаны на совместном выращивании анаэробов со строгими аэробами. Для этого из застывшей агаровой пластинки по диаметру чашки вырезают стерильным скальпелем полоску агара шириной около 1 см. Получается два агаровых полудиска в одной чашке. На одну сторону агаровой пластинки засевают аэроб, например часто используют S. aureus или Serratia marcescens. На другую сторону засевают анаэроб. Края чашки заклеивают пластилином или заливают расплавленным парафином и помещают в термостат. При наличии подходящих условий в чашке начнут размножаться аэробы. После того, как весь кислород в пространстве чашки будет ими использован, начнется рост анаэробов (через 3—4 сут). В целях сокращения воздушного пространства в чашке питательную среду наливают возможно более толстым слоем. Комбинированные методы. Основаны на сочетании физических, химических и биологических методов создания анаэробиоза. Рост и размножение бактерий. Фазы размножения бактерий в замкнутой среде (периодическая культура). Непрерывное культивирование. Промышленное культивирование бактерий. Жизнедеятельность бактерий характеризуется ростом — формированием структурно-функциональных компонентов клетки и увеличением самой бактериальной клетки, а также размножением — самовоспроизведением, приводящим к увеличению количества бактериальных клеток в популяции. Бактерии размножаются путем бинарного деления пополам, реже путем почкования. Актиномицеты, как и грибы, могут размножаться спорами. Актиномицеты, являясь ветвящимися бактериями, размножаются путем фрагментации нитевидных клеток. Грамположительные бактерии делятся путем врастания синтезирующихся перегородок деления внутрь клетки, а грамотрицательные — путем перетяжки, в результате образования гантелевид-ных фигур, из которых образуются две одинаковые клетки. Делению клеток предшествует репликация бактериальной хромосомы по полуконсервативному типу (двуспиральная цепь ДНК раскрывается и каждая нить достраивается комплементарной нитью), приводящая к удвоению молекул ДНК бактериального ядра — нуклеоида. Репликация ДНК происходит в три этапа: инициация, элонгация, или рост цепи, и терминация. Размножение бактерий в жидкой питательной среде. Бактерии, засеянные в определенный, не изменяющийся объем питательной среды, размножаясь, потребляют питательные элементы, что приводит в дальнейшем к истощению питательной среды и прекращению роста бактерий. Культивирование бактерий в такой системе называют периодическим культивированием, а культуру — периодической. Если же условия культивирования поддерживаются путем непрерывной подачи свежей питательной среды и оттока такого же объема культуральной жидкости, то такое культивирование называется непрерывным, а культура — непрерывной. При выращивании бактерий на жидкой питательной среде наблюдается придонный, диффузный или поверхностный (в виде пленки) рост культуры. Рост периодической культуры бактерий, выращиваемых на жидкой питательной среде, подразделяют на несколько фаз, или периодов: 1. лаг-фаза; 2. фаза логарифмического роста; 3. фаза стационарного роста, или максимальной концентрации бактерий; 4. фаза гибели бактерий. Эти фазы можно изобразить графически в виде отрезков кривой размножения бактерий, отражающей зависимость логарифма числа живых клеток от времени их культивирования. 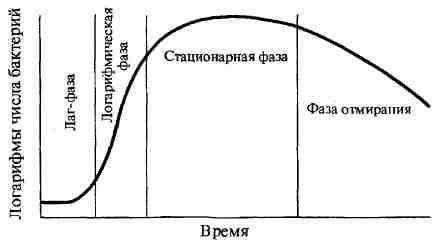 Лаг-фаза — период между посевом бактерий и началом размножения. Продолжительность лаг-фазы в среднем 4—5 ч. Бактерии при этом увеличиваются в размерах и готовятся к делению; нарастает количество нуклеиновых кислот, белка и других компонентов. Фаза логарифмического (экспоненциального) роста является периодом интенсивного деления бактерий. Продолжительность ее около 5— 6 ч. При оптимальных условиях роста бактерии могут делиться каждые 20—40 мин. Во время этой фазы бактерии наиболее ранимы, что объясняется высокой чувствительностью компонентов метаболизма интенсивно растущей клетки к ингибиторам синтеза белка, нуклеиновых кислот и др. Затем наступает фаза стационарного роста, при которой количество жизнеспособных клеток остается без изменений, составляя максимальный уровень (М-концентрация). Ее продолжительность выражается в часах и колеблется в зависимости от вида бактерий, их особенностей и культивирования. Завершает процесс роста бактерий фаза гибели, характеризующаяся отмиранием бактерий в условиях истощения источников питательной среды и накопления в ней продуктов метаболизма бактерий. Продолжительность ее колеблется от 10 ч до нескольких недель. Интенсивность роста и размножения бактерий зависит от многих факторов, в том числе оптимального состава питательной среды, окислительно-восстановительного потенциала, рН, температуры и др. Размножение бактерий на плотной питательной среде. Бактерии, растущие на плотных питательных средах, образуют изолированные колонии округлой формы с ровными или неровными краями (S- и R-формы), различной консистенции и цвета, зависящего от пигмента бактерий. Пигменты, растворимые в воде, диффундируют в питательную среду и окрашивают её. Другая группа пигментов нерастворима в воде, но растворима в органических растворителях. И, наконец, существуют пигменты, не растворимые ни в воде, ни в органических соединениях. Наиболее распространены среди микроорганизмов такие пигменты, как каротины, ксантофиллы и меланины. Меланины являются нерастворимыми пигментами черного, коричневого или красного цвета, синтезирующимися из фенольных соединений. Меланины наряду с каталазой, супероксидцисмутазой и пероксидазами защищают микроорганизмы от воздействия токсичных перекисных радикалов кислорода. Многие пигменты обладают антимикробным, антибиотикоподобным действием. Основные принципы культивирования бактерий. Аппаратура для культивирования микроорганизмов. Культуральные свойства бактерий. Чистой культурой называется популяция бактерий одного вида или одной разновидности, выращенная на питательной среде. Многие виды бактерий подразделяют по одному признаку на биологические варианты — биовары. Биовары, различающиеся по биохимическим свойствам, называют хемоварами, по антигенным свойствам — сероварами, по чувствительности к фагу — фаговарами. Культуры микроорганизмов одного и того же вида, или биовара, выделенные из различных источников или в разное время из одного и того же источника, называют штаммами, которые обычно обозначаются номерами или какими-либо символами. Чистые культуры бактерий в диагностических бактериологических лабораториях получают из изолированных колоний, пересевая их петлей в пробирки с твердыми или, реже, жидкими питательными средами. Колония представляет собой видимое изолированное скопление особей одного вида микроорганизмов, образующееся в результате размножения одной бактериальной клетки на плотной питательной среде (на поверхности или в глубине ее). Колонии бактерий разных видов отличаются друг от друга по своей морфологии, цвету и другим признакам. Чистую культуру бактерий получают для проведения диагностических исследований — идентификации, которая достигается путем определения морфологических, культуральных, биохимических и других признаков микроорганизма. Морфологические и тинкториальные признаки бактерий изучают при микроскопическом исследовании мазков, окрашенных разными методами, и нативных препаратов. Культуральные свойства характеризуются питательными потребностями, условиями и типом роста бактерий на плотных и жидких питательных средах. Они устанавливаются по морфологии колоний и особенностям роста культуры. Биохимические признаки бактерий определяются набором конститутивных и индуцибельных ферментов, присущих определенному роду, виду, варианту. В бактериологической практике таксономическое значение имеют чаще всего сахаролитические и протеолитические ферменты бактерий, которые определяют на дифференциально-диагностических средах. При идентификации бактерий до рода и вида обращают внимание на пигменты, окрашивающие колонии и культуральную среду в разнообразные цвета. Например, красный пигмент образуют Serratia marcescens, золотистый пигмент — Staphylococcus aureus (золотистый стафилококк), сине-зеленый пигмент — Pseu-domonas aeruginosa. Для установления биовара (хемовара, серовара, фаготипа) проводят дополнительные исследования по выялвениб соответствующего маркера – определению фермента, антигена, чувствительности к Фанам. Методы выделения чистых культур бактерий. Универсальным инструментом для производства посевов является бактериальная петля. Кроме нее, для посева уколом применяют специальную бактериальную иглу, а для посевов на чашках Петри — металлические или стеклянные шпатели. Для посевов жидких материалов наряду с петлей используют пастеровские и градуированные пипетки. Первые предварительно изготовляют из стерильных легкоплавких стеклянных трубочек, которые вытягивают на пламени в виде капилляров. Конец капилляра сразу же запаивают для сохранения стерильности. У пастеровских и градуированных пипеток широкий конец закрывают ватой, после чего их помещают в специальные пеналы или обертывают бумагой и стерилизуют. При пересеве бактериальной культуры берут пробирку в левую руку, а правой, обхватив ватную пробку IV и V пальцами, вынимают ее, пронося над пламенем горелки. Удерживая другими пальцами той же руки петлю, набирают ею посевной материал, после чего закрывают пробирку пробкой. Затем в пробирку со скошенным агаром вносят петлю с посевным материалом, опуская ее до конденсата в нижней части среды, и зигзагообразным движением распределяют мате риал по скошенной поверхности агара. Вынув петлю, обжигают край пробирки и закрывают ее пробкой. Петлю стерилизуют в пламени горелки и ставят в штатив. Пробирки с посевами надг писывают, указывая дату посева и характер посевного материала (номер исследования или название культуры). Посевы «газоном» производят шпателем на питательный агар в чашке Петри. Для этого, приоткрыв левой рукой крышку, петлей или пипеткой наносят посевной материал на поверхность питательного агара. Затем проводят шпатель через пламя горелки, остужают его о внутреннюю сторону крышки и растирают материал по всей поверхности среды. После инкубации посева появляется равномерный сплошной рост бактерий. Аппаратура для выращивания микроорганизмов, стерилизации и других микробиологических исследований 1. Термостат – аппарат для выращивания микроорганизмов, в котором поддерживается температура в пределах 28-43оС. Термостаты выпускают водяными или суховоздушными. 2. Микроанаэростат – аппарат для выращивания микроорганизмов в бескислородных условиях. Универсальным инструментом для производства посевов является бактериальная петля. Кроме нее, используют иглу, а для посевов на среды в чашках Петри – металлические и стеклянные шпатели. Для посевов жидких материалов, кроме петли, используют пастеровские и градуированные пипетки. культуральные свойства бактерий. Колонии характеризуют по величине, форме, контуру края, рельефу, поверхности, цвету, структуре и консистенции. Величина колонии определяется ее диаметром. В за-висимости от диаметра различают колонии точечные (диаметр меньше 1 мм), мелкие (диаметр 1—2 мм), средние (диаметр 2—4 мм) и крупные (диаметр 4—6 мм и более). Форма колонии бывает правильная — круглая, неправильная — амебовидная, ризоидная — корневидная, напоминающая переплетающиеся корни деревьев. Характер контура края определяют при рассмотрении колонии под лупой или микроскопом с малым увеличением. Различают ровные края в виде четко выраженной линии и неровные. Последние делят на: 1. фестончатый край, состоящий из крупных, слегка округлых или уплощенных зубцов правильной формы; 2. волнистый край, который несколько отличается от фестончатого тем, что крупные зубцы его выражены нечетко; 3. эрозированный, или зазубренный, край, состоящий из острых зубцов различной величины и формы; 4. бахромчатый край, имеющий нежные ворсинки. В некоторых случаях четко выраженная линия, отграничивающая колонию от поверхности среды, отсутствует. Такой край колонии называется расплывчатым. Рельеф колонии характеризуется приподнятостью ее над поверхностью питательной среды и контуром формы в вертикальном разрезе. Определяется рельеф колонии невооруженным глазом или с лупой при рассматривании сверху и сбоку. Различают: 1) каплеобразные и куполообразные колонии правильной круглой формы с различно выраженной степенью выпуклости, которые в вертикальном разрезе представляют собой сегмент шара и отличаются только длиной радиуса. Колонии слабовыпуклые имеют большую длину радиуса; куполо-образные — меньшую; 2) колонии плосковыпуклые с плоским верхом, пологими или круто обрывающимися краями; имеют в вертикальном разрезе форму трапеции; 3) колонии конусообразные, имеющие в вертикальном разрезе форму треугольника: 4) колонии с приподнятой в виде соска серединой и ва-ликом по периферии; 5) колонии с вдавленным центром; 6) колонии плоские, стелющиеся по поверхности среды. Поверхность колонии изучают с помощью лупы или под микроскопом при малом увеличении. Поверхность колоний бывает матовая или блестящая с глянцем, сухая или влажная, гладкая или шероховатая. Цвет колонии определяется пигментом, который продуцирует культура микробов. Преобладающее большинство патогенных бактерий пигмента не образует, вследствие чего колонии их бесцветны или молочно-мутного цвета, похожи на опал. В проходящем свете такие колонии в большей или меньшей степени прозрачны. Пигментообразующие виды микробов дают колонии различных цветов: кремовые, желтые, золотисто-оранжевые, синие, красные, сиреневые, черные и др. Структура колоний определяется в проходящем свете при слабом увеличении микроскопа, суженной диафрагме или при несколько опущенном конденсоре. У пигментированных колоний и колоний, не пропускающих света, она не определяется. По характеру структуры различают следующие виды колоний: 1) гиалиновые — бесцветные, прозрачные, без видимой определенной структуры; 2) ) зернистые, которые в зависимости от величины зерен разделяются на мелко - и грубозернистые 3) нитевидные или волокнистые, характеризующиеся наличием длинных, густо переплетающихся нитей в толще колонии Колонии бывают однородные и неоднородные. Строение первых одинаково во всех частях, у вторых центральная часть отличается от периферической или отдельные сектора имеют строение, неодинаковое с остальной массой Консистенцию колонии, определяющую ее физическое состояние, исследуют посредством прикосновения или взятия из нее части материала бактериальной петлей. По характеру консистенции колонии бывают: 1) пастообразные, легко снимающиеся и размывающиеся по поверхности питательной среды наподобие сливочного масла; 2) вязкие или слизистые, прилипающие и тянущиеся за петлей; 3) волокнистые или кожистые, плотные, снимающиеся с поверхности питательной среды в виде упругой пленки, соответствующей величине и форме колонии; 4) хрупкие, сухие, рассыпающиеся при прикосновении петли |
