Микробиология. Общая микробиология
 Скачать 476.77 Kb. Скачать 476.77 Kb.
|
|
Антибиотики: классификация по источнику получения, способу получения, по химической структуре, по механизму и спектру действия. Антибиотики – разновидность химиотерапевтических препаратов, содержащих специфические вещества, которые образуются клеткой в процессе жизнедеятельности, а также их производные и синтетические аналоги, обладающие способностью избирательно воздействовать на микроорганизм. Классификация антибиотиков: По источникам выделения: Выделенные из грибов (пенициллин) Выделенные из бактерий (грамицидин, полимиксин и др.) Выделенные из тканей животных (лизоцим, экмолин) Полученные из растений – фитонциды (аллицин, новоиманин). По хим.составу: Беталактамные антибиотики, или беталактамиды (пенициллины, цефалоспорины) Тетрациклин и его полусинтетические производные Аминогликозиды (группа стрептомицина, неомицина, канамицина, пентамицина) Макролиды (эритромицин, олеандомицин) Левомицетин Рифампицин Полиеновые антибиотики (нистатин, леворин) По механизму антимикробного действия: Ингибирующие синтез клеточной стенки (пенициллины, цефалоспорины, циклосерин) Нарушающие ф-ции ЦПМ (полиеновые антибиотики, полимиксины) Ингибирующие синтез белков на рибосомах (аминогликозиды, тетрациклины, левомицетин, макролиды) Угнетающие синтез нуклеиновых кислот (рифампицин) По антимикробному спектору: Узкого спектра действия (бензилпенициллин, нистатин, леворин и др.) Широкого спектра действия (цефалоспорины, тетрациклины, левомицетин, аминогликозиды, рифампицин) Механизм действия: Антибиотики, ингибирующие синтез клеточной стенки. Пептидогликан — основа клеточной стенки бактерий — уникален и жизненно необходим для прокариот, он есть у большинства бактерий, за исключением не имеющих клеточной стенки. Ингибирование пенициллинсвязывающих белков приводит к накоплению предшественников пептидогликана в бактериальной клетке. В результате ненормально большое количество этих предшественников запускает в бактериальной клетке систему их уничтожения — аутентические ферменты, которые в норме расщепляют пептидогликан при делении бактериальных клеток. В результате действия аутолитических ферментов и происходит лизис бактериальной клетки. бета-лактамные антибиотики — пенициллины, цефалоспорины, монобактамы и карбопенемы гликопептиды — ванкомицин, клиндамицин Антибиотики, вызывающие повреждение цитоплазматической мембраны. ЦПМ есть у всех живых клеток, но у прокариот (бактерий) и эукариот ее структура различна. Число антибиотиков, специфически действующих на мембраны бактерий, невелико. Наиболее известны полимиксины (полипептиды), к которым чувствительны только Г- бактерии. Они лизируют клетки, повреждая фосфолипиды клеточных мембран. Противогрибковые препараты (антимикотики) повреждают эргостеролы (полиеновые антибиотики) и ингибируют фермент биосинтеза эргостеролов (имидазолы). полиеновые антибиотики полипептидные антибиотики Антибиотики, подавляющие белковый синтез. Синтез белка — многоступенчатый процесс, в котором задействовано множество ферментов и структурных субъединиц. Аминогликозиды и тетрациклины связываются с 30S-субъединицей, блокируя процесс еще до начала синтеза белка. Аминогликозиды необратимо ингибируют процесс присоединения тРНК, а тетрациклины обратимо блокируют следующую стадию присоединения к рибосомам тРНК. Макролиды, хлорамфеникол, линкозамиды соединяются с 50S-субъединицей. Это обрывает удлинение пептидных цепей. После удаления этих антибиотиков процесс возобновляется, т. е. эффект бактериостатичен. аминогликозиды(гентамицин, угнетая белковый синтез в бактериальной клетке, способен нарушать синтез белковой оболочки вирусов и поэтому может обладать противовирусным действием) макролиды тетрациклины хлорамфеникол(левомицетин), нарушающий синтез белка микробной клетки Антибиотики, ингибирующие синтез нуклеиновых кислот. Нарушение синтеза и функций нуклеиновых кислот достигается тремя способами: 1) ингибирование синтеза предшественников пурин-пиримидиновых оснований (сульфаниламиды, триметоприм) 2) подавление репликации и функций ДНК (хинолоны/фторхинолоны, нитроимидазолы, нитрофураны) 3) ингибирование РНК-полимеразы (рифамицины) Механизмы антибиотикорезистентности возбудителей инфекционных болезней. Пути преодоления устойчивости бактерий к антибиотикам. Антибиотикорезистентность - это устойчивость микробов к антимикробным химиопрепаратам. Бактерии следует считать резистентными, если они не обезвреживаются такими концентрациями препарата, которые реально создаются в макроорганизме. Биохимическую основу резистентности обеспечивают разные механизмы: * энзиматическая инактивация антибиотиков - осуществляется с помощью синтезируемых бактериями ферментов, разрушающих активную часть антибиотиков. Одним из таких широко известных ферментов является бета-лактамаза, обеспечивающая устойчивость микроорганизмов к бета-лактамным антибиотикам за счет прямого расщепления бета-лактамного кольца этих препаратов. Другие ферменты способны не расщеплять, а модифицировать активную часть молекулы антибиотиков, как это имеет место при энзиматической инактивации аминогликозидов и левомицетина; * изменение проницаемости клеточной стенки для антибиотика или подавление его транспорта в бактериальные клетки. Этот механизм лежит в основе устойчивости к тетрациклину, * изменение структуры компонентов микробной клетки, например изменение структуры бактериальных рибосом, сопровождается повышением устойчивости к аминогликозидам и макролидам, а изменение структуры РНК-синтетаз — к рифампицину. У бактерий одного и того же вида могут реализовываться несколько механизмов резистентности. В то же время развитие того или другого типа резистентности определяется не только свойствами бактерий, но и химической структурой антибиотика. Для борьбы с лекарственной устойчивостью, т. е. для преодоления резистентности микроорганизмов к химиопрепаратам, существует несколько путей: * соблюдение принципов рациональной химиотерапии; * создание новых химиотерапевтических средств, отличающихся механизмом антимикробного действия (например созданная в последнее время группа химиопрепаратов — фторхинолоны) и мишенями; * постоянная ротация (замена) используемых в данном лечебном учреждении или на определенной территории химиопрепаратов (антибиотиков); * комбинированное применение бета-лактамных антибиотиков со-вместно с ингибиторами бета-лактамаз (клавулановая кислота, сульбактам, тазобактам). Методы определения чувствительности бактерий к антибиотикам. 1. Метод дисков: Исследуемую бактериальную культуру засевают газоном на питательный агар или среду АГВ в чашке Петри. На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 °С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чув-ствительности к антибиотикам. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин). Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность микроорганизмов методом серийных разведений. 2. Метод дорожки: В чашке Петри стерильным скальпелем вырезают и удаляют дорожку агара шириной 1 см. Затем в пробирку с растопленным агаром вносят определенную концентрацию антибиотика. Содержимое пробирки перемешивают и выливают в дорожку. После застывания агара перпендикулярно к дорожке засевают петлей культуры нескольких исследуемых микроорганизмов. Посевы помещают в термостат. Чувствительные к антибиотику микроорганизмы начинают расти на некотором расстоянии от дорожки. 3.Метод серийных разведений в жидкой среде: Данным методом определяют минимальную концентрацию антибиотика, ингибирующую рост исследуемой культуры бактерий. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащей 106—107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий под влиянием содержащейся в ней минимальной ингибирующей концентрации (МИК) антибиотика. Оценку результатов определения чувствительности микроорганизмов к антибиотикам проводят по специальной готовой таблице, которая содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов, а также значения МИК антибиотиков для устойчивых и чувствительных штаммов. Типы взаимодействия вируса с чувствительной клеткой. Фазы репродукции вирусов. Различают три типа взаимодействия вируса с клеткой: Продуктивный тип— завершается образованием нового поколения вирионов и гибелью (лизисом) зараженных клеток (цитолитическая форма). Некоторые вирусы выходят из клеток, не разрушая их (нецитолитическая форма). Абортивный тип— не завершается образованием новых вирионов, поскольку инфекционный процесс в клетке прерывается на одном из этапов. Интегративный тип, или вирогения — характеризуется встраиванием (интеграцией) вирусной ДНК в виде провируса в хромосому клетки и их совместным сосуществованием (совместная репликация). Репродукция вирусов осуществляется в несколько стадий, последовательно сменяющих друг друга: адсорбция вируса на клетке; проникновение вируса в клетку; «раздевание» вируса; биосинтез вирусных компонентов в клетке; формирование вирусов; выход вирусов из клетки. Адсорбция. Взаимодействие вируса с клеткой начинается с процесса адсорбции, т. е. прикрепления вирусов к поверхности клетки. Это высокоспецифический процесс. Вирус адсорбируется на определенных участках клеточной мембраны — так называемых рецепторах. Клеточные рецепторы могут иметь разную химическую природу, представляя собой белки, углеводные компоненты белков и липидов, липиды. Число специфических рецепторов на поверхности одной клетки колеблется от 104 до 105. Проникновение в клетку. Существует два способа проникновения вирусов животных в клетку: виропексис и слияние вирусной оболочки с клеточной мембраной. При виропексисе после адсорбции вирусов происходят инвагинация (впячивание) участка клеточной мембраны и образование внутриклеточной вакуоли, которая содержит вирусную частицу. Вакуоль с вирусом может транспортироваться в любом направлении в разные участки цитоплазмы или ядро клетки. Процесс слияния осуществляется одним из поверхностных вирусных белков капсидной или суперкапсидной оболочки. «Раздевание». Процесс «раздевания» заключается в удалении защитных вирусных оболочек и освобождении внутреннего компонента вируса, способного вызвать инфекционный процесс. «Раздевание» вирусов происходит постепенно, в несколько этапов, в определенных участках цитоплазмы или ядра клетки, для чего клетка использует набор специальных ферментов. В случае проникновения вируса путем слияния вирусной оболочки с клеточной мембраной процесс проникновения вируса в клетку сочетается с первым этапом его «раздевания». Конечными продуктами «раздевания» являются сердцевина, нуклеокапсид или нуклеиновая кислота вируса. Биосинтез компонентов вируса. Проникшая в клетку вирусная нуклеиновая кислота несет генетическую информацию, которая успешно конкурирует с генетической информацией клетки. Она дезорганизует работу клеточных систем, подавляет собственный метаболизм клетки и заставляет ее синтезировать новые вирусные белки и нуклеиновые кислоты, идущие на построение вирусного потомства. Реализация генетической информации вируса осуществляется в соответствии с процессами транскрипции, трансляции и репликации. Формирование (сборка) вирусов. Синтезированные вирусные нуклеиновые кислоты и белки обладают способностью специфически «узнавать» друг друга и при достаточной их концентрации самопроизвольно соединяются в результате гидрофобных, солевых и водородных связей. Существуют следующие общие принципы сборки вирусов, имеющих разную структуру: 1. Формирование вирусов является многоступенчатым процессом с образованием промежуточных форм; 2. Сборка просто устроенных вирусов заключается во взаимодействии молекул вирусных нуклеиновых кислот с капсидными белками и образовании нуклеокапсидов (например, вирусы полиомиелита). У сложно устроенных вирусов сначала формируются нуклеокапсиды, с которыми взаимодействуют белки суперкапсидных оболочек (например, вирусы гриппа); 3. Формирование вирусов происходит не во внутриклеточной жидкости, а на ядерных или цитоплазматических мембранах клетки; 4. Сложно организованные вирусы в процессе формирования включают в свой состав компоненты клетки-хозяина (липиды, углеводы). Выход вирусов из клетки. Различают два основных типа выхода вирусного потомства из клетки. Первый тип — взрывной — характеризуется одновременным выходом большого количества вирусов. При этом клетка быстро погибает. Такой способ выхода характерен для вирусов, не имеющих суперкапсидной оболочки. Второй тип — почкование. Он присущ вирусам, имеющим суперкапсидную оболочку. На заключительном этапе сборки нуклеокапсиды сложно устроенных вирусов фиксируются на клеточной плазматической мембране, модифицированной вирусными белками, и постепенно выпячивают ее. В результате выпячивания образуется «почка», содержащая нуклеокапсид. Затем «почка» отделяется от клетки. Таким образом, внешняя оболочка этих вирусов формируется в процессе их выхода из клетки. При таком механизме клетка может продолжительное время продуцировать вирус, сохраняя в той или иной мере свои основные функции. Методы культивирования и индикации вирусов. Методы культивирования вирусов в организме лабораторных животных; в развивающихся куриных эмбрионах; в культурах клеток. Культивирование вирусов в организме лабораторных животных чувствительность животных обезьяны, кролики, морские свинки, хомячки, белые крысы и мыши способ заражения зависит от тропизма вируса к определенным тканям: нейротропные, респираторные, дерматотропные вирусы и т.д. Накожное, внутрикожное, внутримышечное, внутрибрюшинное и внутримозговое заражение. Культивирование вирусов в организме лабораторных животных если при первичном заражении животные не заболевают → «пассажи» индикация: развитие типичных признаков заболевания, патоморфологические изменения органов и тканей, положительная реакция гемагглютинации (РГА) Культивирование вирусов в куриных эмбрионах эмбрионы от 8 до 14 дней размножение – в разных частях зародыша (особенности тропизма вируса) промышленное культивирование 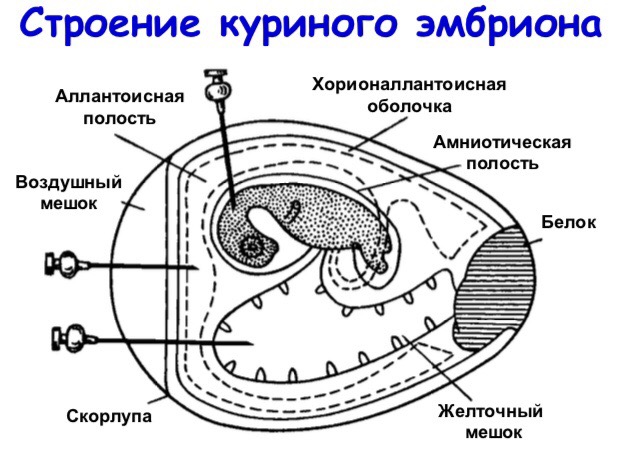 Способы заражения куриного эмбриона Заражение на хорионаллантоисную оболочку (вирусы оспы, простого герпеса). На оболочке – беловатые непрозрачные пятна разной формы (бляшки). Заражение в аллантоисную полость: вирус размножается в эндодермальных клетках, переходит в аллантоисную жидкость. Заражение в желточный мешок. Используют эмбрионы 5–10-дневного возраста. Индикация: на основании специфических поражений оболочек и тела эмбриона (бляшки,кровоизлияния); в РГА. Культивирование вирусов в культуре ткани Классификация клеточных культур В зависимости от техники приготовления: однослойные – клетки, способные прикрепляться и размножаться на поверхности лабораторной посуды в виде монослоя суспензионные – клетки размножаются во всем объеме питательной среды при постоянном ее перемешивании органные – цельные кусочки органов и тканей, сохраняющие исходную структуру вне организма По числу жизнеспособных генераций: первичные, способные размножаться только в 1-2 пассажах; перевиваемые, или стабильные, способные размножаться неопределенно в неограниченном числе пассажей; полуперевиваемые, или диплоидные, имеющие ограниченную продолжительность жизни (40-50 пассажей). Индикация вирусов в культуре клеток Цитопатическое действие (ЦПД) – видимые под микроскопом морфологические изменения клеток: слияние клеток с образованием синцития (вирус кори); сморщивание и деструкция клеток (энтеровирусы); агрегация клеток (аденовирусы); зоны лизиса в монослое (ЦМВ). Вирусные включения – скопление вирусных частиц в клетках, выявляемые под микроскопом при специальном окрашивании. Вирусы герпеса, аденовирусы, гриппа, бешенства, оспы и др. |
