микробиология. Общая вирусология. Механизмы противовирусной защиты. Микробиология натуральная оспа.
 Скачать 2.52 Mb. Скачать 2.52 Mb.
|
|
Профилактика оспы натуральной Профилактика натуральной оспы основана на предотвращении заноса этого заболевания из-за рубежа и вакцинации населения. Мероприятия по предупреждению заноса инфекции проводят в соответствии с международными правилами, которые предусматривают телеграфное извещение Всемирной организации здравоохранения в случаях оспы на ранее свободных от нее территориях, медицинский осмотр и предъявление международных свидетельств о прививках и др. Основное мероприятие в борьбе с натуральной оспой — специфическая профилактика. Для вакцинации применяют сухую оспенную вакцину.  4.Практическое использование системы антиген-антитело в вирусологии: а) для диагностики (реакции нейтрализации: реакция задержки гемагглютинации, реакция задержки ЦПД; иммуноферментный анализ, иммуноблотинг и др.); При введении антигена в организме образуются антитела. Антитела комплементарны антигену, вызвавшему их синтез, и способны с ним связываться. Связывание антигенов с антителами состоит из двух фаз. Первая фаза - специфическая, при которой происходит быстрое связывание антигенной детерминанты с активным центром Fab-фрагмента антител. Следует отметить, что связывание обусловлено ван-дер-ваальсовыми силами, водородными и гидрофобными взаимодействиями. Прочность связи определяется степенью пространственного соответствия активного центра антитела и эпитопа антигена. После специфической фазы наступает более медленная - неспецифическая, которая проявляется видимым физическим явлением (например, образованием хлопьев при агглютинации и др.). Серологические методы исследования (от лат. Serum — сыворотка и logos — учение) с помощью реакции антиген-антитело. Реакции нейтрализации (РН) основаны на способности AT связывать различные возбудители или их метаболиты, лишая тем самым их возможности реализовать свои биологические свойства (иными словами, AT нейтрализуют возбудителей). На практике РН применяют для выявления вирусов и различных токсинов. В определённой степени к ним же относят реакции торможения вирусиндуцированной гемагглютинации и иммобилизации. Реакции нейтрализации вирусов: в сыворотке крови переболевших лиц циркулируют AT, нейтрализующие вирусы. Их наличие выявляют смешиванием культуры возбудителя с сывороткой с последующим введением лабораторному животному или заражением культуры клеток. На эффективность нейтрализации указывает выживание животного либо отсутствие гибели клеток в культурах. Реакция задержки (торможения) гемагглютинации (РЗГА, РТГА) широко применяется в практике как для выявления и определения титра антител в сыворотке крови больных и вакцинированных животные, так и для идентификации выделенных вирусов по известной сыворотке. Ставить эту серологическую реакцию можно только с теми вирусами, которые обладают гемагглютинирующими свойствами. А  гглютинация эритроцитов при вирусных инфекциях обнаруживается в результате прямого взаимодействия вируса с поверхностью эритроцитов (реакция гемагглютинации - РГА). РГА наступает непосредственно в смеси гемагглютинирующего вируса с эритроцитами. РГА может быть нейтрализована, если перед взаимодействием с эритроцитами к гемагглютинирующему вирусу добавить специфическую иммунную сыворотку (реакция торможения, задержка гемагглютинации - РТГА, РЗГА). гглютинация эритроцитов при вирусных инфекциях обнаруживается в результате прямого взаимодействия вируса с поверхностью эритроцитов (реакция гемагглютинации - РГА). РГА наступает непосредственно в смеси гемагглютинирующего вируса с эритроцитами. РГА может быть нейтрализована, если перед взаимодействием с эритроцитами к гемагглютинирующему вирусу добавить специфическую иммунную сыворотку (реакция торможения, задержка гемагглютинации - РТГА, РЗГА).РГА и РТГА впервые были предложены для обнаружения вируса гриппа и титрования противогриппозных антител. Вскоре появились сообщения о гемагглютинирующей активности вирусов осповакцины, ложной чумы кур, паротита, оспы, пневмонии мышей, кори, арбо-, адено- и парагриппозных, а также кишечных вирусов. Миксовирусы агглютинируют эритроциты многих видов животных и птиц, вирусы оспы и вакцины — эритроциты петухов, арбовирусы и вирус кори — эритроциты обезьян и гусей, большинство неполиомиелитных кишечных вирусов — эритроциты человека. Реакция гемагглютинации визуально видна в виде хлопьев красного цвета («зонтик») – положительная реакция. При этом осадок эритроцитов – это отрицательная реакция. Реакция торможения гемагглютинации визуализируется в виде осадка эритроцитов («пуговка») – положительная реакция. При этом хлопья агглютинации – это отрицательная реакция. Реакция задержки ЦПД. ЦПД (цитопатическое действие) - любые изменения клеток в культуре клеток под влиянием размножающегося в них вируса. Морфологические изменения в клетке можно обнаружить микроскопированием при малом увеличении (объектив х 8-10, окуляр х 7-10) слоя клеток в пробирке. При этом сравнивают зараженные культуры клеток с контрольными. Любые наблюдаемые отличия можно считать проявлением ЦПД. ЦПД в культуре клеток способно вызывать большинство вирусов, поэтому данный метод индикации вирусов в культуре клеток широко применяется. Интенсивность ЦПД выражается тем, какая часть клеточного монослоя изменена вирусом, и оценивается в крестах или баллах: - изменению подвергся весь монослой ++++ - изменению подверглось 3/4 монослоя +++ - изменению подверглось 1/2 монослоя ++ - изменению подверглось 1/4 монослоя + Основной причиной ЦПД является нарушение метаболизма клетки. Прекращается синтез РНК клетки-хозяина, что ведёт к подавлению синтеза белков, приводит к нарушению структуры клеточных мембран, лизосом, митохондрий. Освобождаются и активируются клеточные ферменты (лизосомальные), которые вызывают деструкцию клеточных компонентов, т.е. развитие ЦПД. При резкой дегенерации клеточный монослой гибнет К проявлению ЦПД вирусов относится образование внутриклеточных включений. Они образуются, если вирус не вызывает гибели клеток, или на стадиях до наступления гибели. Образование включений может быть единственным проявлением реакции клетки на внедрение вируса. по типу ЦПД можно судить о семействе или роде, к которым относится исследуемый вирус: - энтеровирусы (вирусы полиомиелита, Коксаки, ЕСНО) вызывают однородную мелкозернистую деструкцию клеток; - аденовирусы превращают клеточный слой в скопления мелких, округлых клеток, расположенных в виде гроздьев винограда; - парагриппозные вирусы, респираторно-синцитиальный, вирусы кори и паротита образуют симпласты. Для идентификации выделенного вируса по нейтрализации ЦПД культуральную жидкость смешивают с равным объёмом диагностической иммунной сыворотки (разведение сыворотки 1:5 или 1:10). После 1-2-часового контакта при комнатной температуре этой смесью (по 0,2 мл) заражают 4 пробирки с культурой клеток, из которой предварительно была удалена питательная среда; после добавления смеси в пробирки вносят по 0,8 мл свежей среды. Опыт сопровождается несколькими контролями: 1 – контроль незаражённой культуры; 2 – контроль дозы вируса – клеточные культуры заражают той же дозой вируса, что и в опыте; 3 – контроль культуры, заражённой смесью культуральной жидкости с нормально сывороткой. Опыт учитывают через 5-7 дней и более, просматривая пробирки под малым увеличением микроскопа. В первом контроле ЦПД должно отсутствовать, во втором и третьем – обязательное проявление ЦПД. Отсутствие цитопатического эффекта в опытных пробирках указывает, что в данной пробе произошла нейтрализация вируса иммунной сывороткой, сыворотка соответствует типу выделенного вируса.  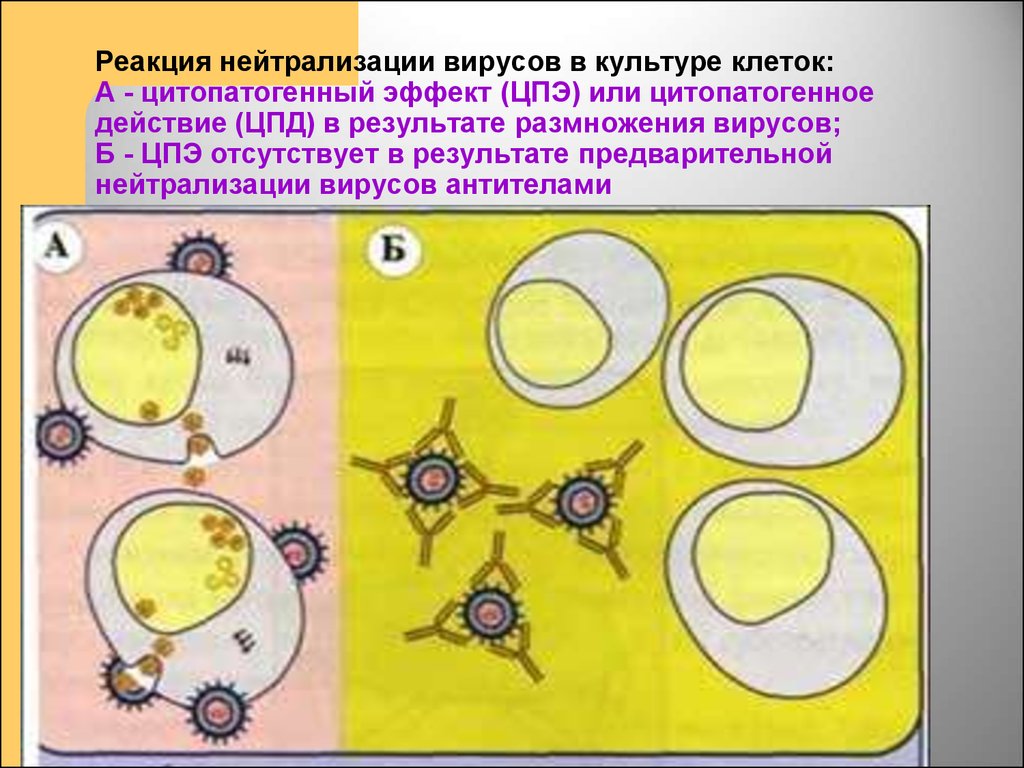 Иммуноблоттинг (син. вестернблоттинг) - высокочувствительный метод выявления белков, основанный на сочетании электрофореза и ИФА или РИА. 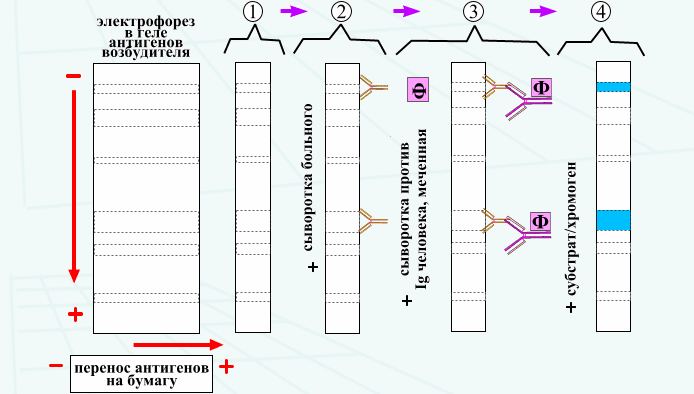  Антигены возбудителя разделяют с помощью электрофореза в полиакриламидном геле, затем переносят их (блоттинг - от англ, blot, пятно) из геля на активированную бумагу (1) или нитроцеллюлозную мембрану и проявляют с помощью ИФА. Фирмы выпускают такие полоски с "блотами" антигенов*. На эти полоски наносят сыворотку больного (2). Затем, после инкубации, отмывают от несвязавшихся антител больного и наносят сыворотку против иммуноглобулинов человека, меченную ферментом (3). Образовавшийся на полоске комплекс [антиген + антитело больного + антитело против Ig человека] выявляют добавлением хромогенного субстрата (4), изменяющего окраску под действием фермента. Давно известные вещи Реакции с использованием метки: Эти методы высокочувствительны. В качестве метки антигенов или антител применяют красители, радиоактивные изотопы, ферменты и др. РИФ – реакция иммунофлюоресценции Реакция иммунофлуоресценции основана на световой индикации комплекса антиген-антитело Иммуноферментный анализ. Современное лабораторное исследование, в ходе которого ведется поиск специфических антител в крови либо антигенов к конкретным заболеваниям с целью выявления не только этиологии, но и стадии болезни. Результаты ИФА могут выдаваться качественно и количественно. В настоящее время ИФА применяется в следующих ситуациях: 1) поиск специфических антител к любому инфекционному заболеванию; 2) поиск антигенов каких-либо заболеваний (инфекционных, венерологических); 3) исследование гормонального статуса пациента; 4) обследование на онкомаркеры; 5) обследование на предмет наличия аутоиммунных заболеваний. 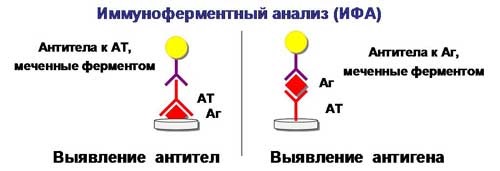 На рисунке твердофазный ИФА – известные АГ (слева) адсорбировн а на лунке планшета, (справа) на лунках планшета известные АТ Постановка ИФА (общий механизм): Основу иммуноферментного анализа составляет иммунная реакция антигена и антитела с образованием иммунного комплекса: антиген-антитело, в результате которого происходит изменение ферментативной активности специфических меток на поверхности антител. Компоненты реакции: 1. АГ(АТ) известное – на лунке планшета. 2. АТ (АГ) исследуемое. 3. АТ с ферментом, специфичное комплексу АТ(АГ)-АГ(АТ) 4.хромогенный субстрат, взаимодействующий с фермент 5. стоп раствор Основные этапы проведения ИФА 1. На поверхности лунок планшета находится очищенный антиген определенного возбудителя. В них добавляется биологический материал пациента происходит специфическая реакция между этим антигеном и искомым антителом (иммуноглобулином). Образуется комплекс. 2. Добавляется конъюгант – АТ с ферментом. Конъюгант специфичен к комплексу АТ- АГ первого этапа. Фермент активизируется. 3. Добавляется субстрат и активный фермент взаимодействует с ним, изменяя бесцветный цвет раствора. 4. Добавляется стоп раствор для прекращения взаимодействия фермент-субстрат. 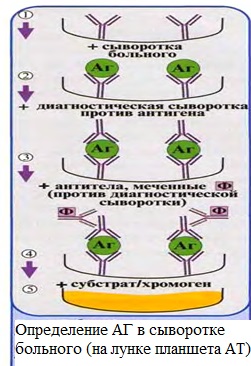 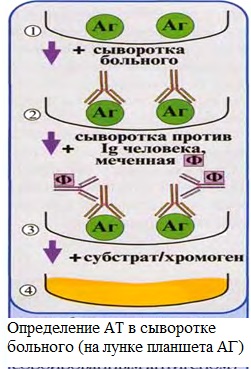 Учет. Положительный результат- изменение цвета, на рисунке – желтый цвет. Иммунохроматографический анализ Метод иммунохроматографического анализа (ИХА, экспресс-тесты) – качественный скрининговый предварительный метод, позволяющий быстро, в течение нескольких минут, провести анализ в любых условиях, в т.ч. «полевых». Компоненты (нанесены на тест-полоску): 1. Конъюгат с меткой коллоидного золота – специфичен к определяемому АГ. 2. АТ тестовой линии – специфичны к комплексу АТ-АГ 3. АТ контрольной линии – специфичны к конъюгату. Постановка ИХА: 1.Нанесение образца на обозначенный стартовый участок полоски. 2. Получение результата в виде появления окрашенных полос на месте тестовой и контрольной линии. 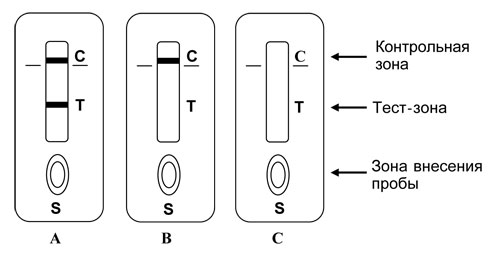 Учет Положительный – при окрашивании тестовой линии. Отрицательный - при отсутствии окрашивания тестовой линии. Недостоверный – при отсутствии окрашивания контрольной линии. Общий механизм ИХА: 1. Образец вносится на стартовое поле (подушку образца) и связывается с конъюгатом (специфичное тело с цветной меткой), которые находятся на подушке конъюгата. В результате образуется окрашенный комплекс. 2. Образовавшийся окрашенный иммунный комплекс движется под действием капиллярных сил вдоль нитроцеллюлозной мембраны и взаимодействует с АТ тестовой линии. В результате появляется одна окрашенная розово-красная полоса. 3. Не связавшиеся на тестируемой полосе АТ (конъюгат )движется дальше и достигает контрольной линии, связывается с АТ контрольной линии. В результате появляется вторая окрашенная полоса. Если анализ проведен правильно, Контрольная линия должна проявляться всегда, независимо от присутствия исследуемого антигена (антитела) в образце биологической жидкости. Требования к сыворотке • Сыворотка должна быть совершенно прозрачная без примеси клеток • Получают на 2 неделе болезни обычно, когда уже есть в наличии антитела. • Кровь берут в количестве 3-5 мл натощак или через 6 ч. после еды. • Для получения сыворотки кровь оставляют на 1 час при комнатной температуре или центрифугируют. Отсасывают сыворотку очень осторожно, чтобы не захватить форменные элементы. • Иммунные сыворотки получают из крови людей или животных (чаще кроликов и лошадей), иммунизированных по определённой схеме соответствующим антигеном (вакциной). Готовят сыворотки обычно на производстве. б) для специфической профилактики и терапии (вакцины и сыворотки при вирусных инфекциях). Специфическая профилактика вирусных болезней строится в основном на тех же принципах, что и профилактика других инфекционных болезней, и включает применение различных типов вакцин. Вакцины – это биологические препараты, приготовленные из возбудителей инфекционных болезней или продуктов их жизнедеятельности, которые содержат в своем составе специфический антиген в количестве, достаточном для обеспечения иммунитета у привитых животных. Как известно, вирусы для макроорганизма представляют собой чрезвычайные раздражители, т.е. антигены. Антигенность их обусловлена белками, входящими в состав оболочек. У вирусов различают два типа антигенов: S — внутренний, Vi — внешний. I. Диагностические препараты Противооспенная сыворотка – содержит антитела к вирусу натуральной оспы, используется для идентификации вируса в реакциях нейтрализации. Оспенныйдиагностикум – содержит антигены вируса натуральной оспы, используется в серологическом методе диагностики. II. Лечебно-профилактические препараты Сухая оспенная вакцина – содержит очищенный, высущенный живой вирус вакцины. Применяется для профилактики натуральной оспы. С 1982 года обязательная вакцинация не проводится. Противооспенный донорский иммуноглобулин – содержит антитела, полученные из крови донора, взятой через 3-6 недель после ревакцинации оспенной вакциной. Иммуноглобулин вводят лицам, находящимся в контакте с больными натуральной оспой, а также применяют для лечения и профилактики поствакцинальных осложнений.  ВИРУС+КЛЕТКА ВИРУС+КЛЕТКА ЦИТОПАТИЧЕСКОЕ ДЕЙСТВИЕ (ЦПД) 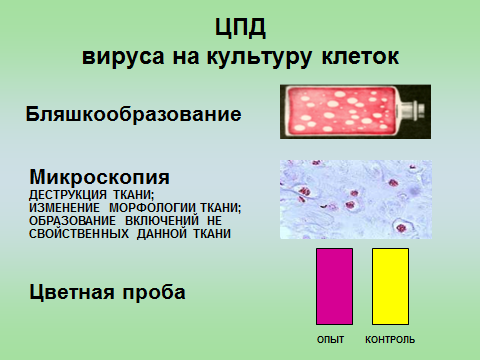   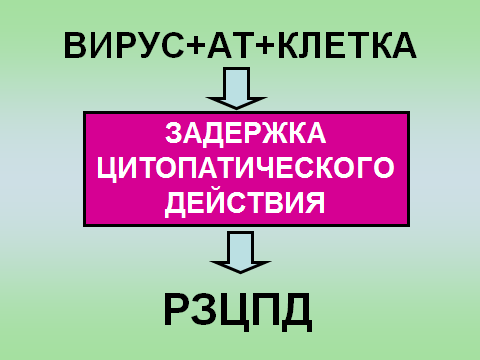 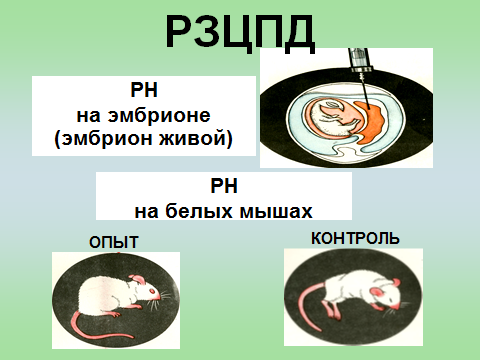   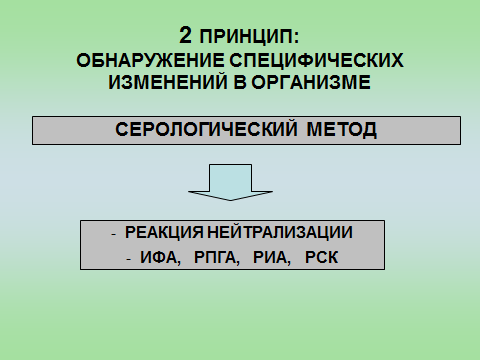 «МИКРОБИОЛОГИЯ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ (ОРВИ) И АРБОВИРУСНЫХ ИНФЕКЦИЙ» 1. Грипп. Этиология, эпидемиология, патогенез, лабораторная диагностика, специфическая профилактика и терапия. ВИРУС ГРИППА Семейство – Ortomyxoviridae; РНК; Размер – 80х120 нм; Сферическая форма; Спиральный тип симметрии; Наружная липопротеидная оболочка с шипами гликопротеидной природы Грипп – острое антропонозное инфекционное заболевания с воздушно-капельным механизмом передачи, вызываемое РНК-овым вирусом гриппа, характеризующееся кратковременной лихорадкой, интоксикацией и поражением респираторного тракта. Этиология: РНК-овый вирус гриппа (семейство ортомиксовирусов), по антигенной структуре – 3 типа: а) вирус гриппа А – имеет 13 антигенных подтипов по геммаглютинину (Н1-Н13) и 10 – по нейраминидазе (N1-N10), у человека встречаются 3 Н-подтипа (Н1, Н2, Н3) и 2 N-подтипа (N1, N2), дающие разнообразные комбинации, обладает высокой изменчивостью б) вирус гриппа В – обладает меньшей вирулентностью и большей стабильностью г) вирус гриппа С – не имеет нейраминидазы, антигенно стабилен Эпидемиология: источник – больной человек (хотя в качестве источника могут выступать и животные), выделяющий вирус в окружающую среду при кашле и чихании (особенно заразны больные в первые 7 дней); механизм передачи – воздушно-капельный; эпидемии гриппа А возникают каждые 1-3 года, пандемии возникают через каждые 10-30 лет, для них характерна сезонность (ноябрь-март) и взрывной характер Патогенез: внедрение вируса в эпителиоциты верхних дыхательных путей --> дистрофические изменения и некроз клеток, активация местного воспаления --> вирусемия --> воздействие вирусных токсинов на ЦНС, ССС, поражение сосудов МЦР с развитием геморрагий, иммунносупрессивное действие с последующей активацией бактериальной аутофлоры дыхательных путей. |
