Экзамен, который я обязательно сдам). Определение биологии как науки. Связь биологии с другими науками. Значение биологии для медицины. Фундаментальные свойства живого
 Скачать 1.73 Mb. Скачать 1.73 Mb.
|
|
56. Цитогенетический метод. Кариотип человека. Характеристика методов дифференциального окрашивания хромосом. Тест полового хроматина и его применение в медицине. Цитогенетический метод. Цитогенетический метод состоит в исследовании под микроскопом хромосомного набора клеток больного. Как известно, хромосомы находятся в клетке в спирализованном состоянии и их невозможно увидеть. Для того же, чтобы визуализировать хромосомы клетку стимулируют и вводят ее в митоз. В профазе митоза, а также в профазе и метафазе мейоза хромосомы деспирализуются и визуализируются. В ходе визуализации оценивают количество хромосом, составляют идиограмму, в которой все хромосомы записывают в определенном порядке согласно Денверской классификации. На основании идиограммы можно говорить о наличии хромосомной абберации или изменении числа хромосом, а соответственно о наличии генетического заболевания. Каждый организм характеризуется определенным набором хромосом, который называется кариотипом. Кариотип человека состоит из 46 хромосом – 22 пары аутосом и две половые хромосомы. У женщины это две X хромосомы (кариотип: 46, ХХ), а у мужчин одна Х хромосома, а другая – Y (кариотип: 46, ХY). В каждой хромосоме находятся гены, ответственные за наследственность. Исследование кариотипа проводится с помощью цитогенетических и молекулярно-цитогенетических методов. Кариотипирование – цитогенетический метод - позволяющий выявить отклонения в структуре и числе хромосом, которые могут стать причиной бесплодия, другой наследственной болезни и рождения больного ребенка. 57. Молекулярно-генетические методы. Основные этапы. Молекулярно-генетическая диагностика генных болезней. Поиск изменений последовательностей нуклеиновых кислот и белков на молекулярном уровне является одним из основных направлений молекулярной генетики. Выявление мутационных изменений ДНК при наследственных заболеваниях и полном отсутствии знания о патогенезе заболевания происходит с помощью молекулярно-генетических методов следующим образом: на первом этапе осуществляется сканирование генома для поиска каких-либо отклонений или соответствующих маркеров. Это проделывается на базе анализа сегрегации болезни в семьях больных, а также поиска аллелей, потенциально связанных с заболеванием, среди больших групп неродственных больных. Далее, выделяются некоторые гены-кандидаты, в которых с высокой долей вероятности могут наблюдаться мутации, связанные с исследуемым заболеванием. Однако, при наличии предположений или некоторых доказательств относительно механизмов, лежащих в основе патогенеза заболевания, первый этап молекулярно-генетических исследований, как правило, опускается. Наиболее известными молекулярно-генетическими методами для поиска генов, потенциально связанных с конкретной болезнью, являются методы анализа сцепления и аллельной ассоциации. Оба метода преследуют цель картирования генов, аномалии которых приводят к болезни, и основаны на анализе полиморфных генетических маркеров для молекулярного сканирования генома. Эти два метода позволяют проводить молекулярно-генетические исследования в условиях отсутствия знаний о процессах, лежащих в основе патогенеза болезни. Исследование с помощью анализа сцепления требует большого числа индивидуумов из семей с соответствующими больными, в противном случае, полученные данные не будут статистически достоверными. При анализе сцепления исследуются полиморфные маркеры с известной локализацией на хромосоме (расположенные в определенных локусах), которые могут наследоваться вместе с болезнью. Если наблюдается совместное наследование (сцепление) болезни и определенных полиморфных маркеров, можно говорить о картировании генов болезни. Картирование представляет собой процесс ассоциации болезни с определенным хромосомным локусом в геноме человека. При аллельных ассоциациях изучается совместное наследование аллелей и заболевания в репрезентативных выборках неродственных больных. Если частота определенных комбинаций аллелей у больных превышает значение в контрольной группе, можно с определенной долей вероятности утверждать то, что в хромосомном (геномном) участке этого аллеля расположен ген, связанный с исследуемой болезнью. Анализ аллельных ассоциаций может указать на генетические факторы патогенеза или предрасположенности к заболеванию. Существует множество методических подходов к определению генов болезни на базе данных анализа сцепления или аллельных ассоциаций. Среди них распространенным методом для определения генов, связанных с заболеванием, является выбор наиболее вероятных генов-кандидатов, локализованных в картированном участке, с последующим определением последовательности ДНК этих генов. Такой подход к исследованию оказался эффективным при идентификации генов болезни Альцгеймера, но, например, при шизофрении, аффективных расстройствах и аутизме, этот метод по большей части не дает воспроизводимых результатов. Следует отметить, что классические молекулярно-генетические методы были преимущественно разработаны для системы «один ген – одна болезнь». Это позволяет некоторым исследователям оспаривать результаты многих анализов сцепления и аллельных ассоциаций мультифакторных психических болезней (шизофрения, аутизм и др.). В связи с этим, наиболее подходящим для подобных исследований следует рассматривать анализ всего генома, при котором используются от нескольких сотен до нескольких тысяч полиморфных генетических маркеров. Существует достаточно большое количество молекулярно-генетических методов, которые имеют широкий спектр применения. Однако многие из них являются либо модификацией, либо комбинацией нескольких основных методов. Среди последних следует выделить полимеразную цепную реакцию (ПЦР) и секвенирование (определение последовательности полимерных макромолекул). Многие учёные используют в своей работе ПЦР как современный молекулярно-генетический метод. Этот метод позволяет определять небольшие фрагменты последовательностей ДНК. Он также относительно несложен в исполнении и не требует значительных затрат как при адаптации к имеющимся лабораторным условиям, так и в ходе его дальнейшего использования. Классический вариант ПЦР представляет собой искусственную экспоненциальную репликацию или амплификацию небольших фрагментов ДНК, в среднем от 200 до 1000 пн. Для использования ПЦР необходимо знать определенную часть исследуемой последовательности ДНК, поскольку для инициации реакции применяются синтетические олигонуклеотиды (как правило, размером около 20 пн) или праймеры. ПЦР для амплификации одного фрагмента ДНК требует использования не менее 2-х праймеров: один – идентичный прямой 5’ последовательности, второй – идентичный обратной 5’ последовательности. Геномная ДНК смешивается с праймерами и ферментом температуроустойчивой ДНК полимеразы и единичными нуклеотидами (А, Г, Ц и Т), которые являются основой для синтеза новых коротких последовательностей. Смесь нагревается для того, чтобы образовались однонитевые последовательности ДНК (процесс денатурации). Затем, при снижении температуры праймеры связываются с образованными последовательностями, и начинается полимеризация ДНК от 3’ конца на базе единичных нуклеотидов, находящихся в смеси. Данный искусственный процесс не слишком отличается от репликации молекул ДНК в клетке за исключением того, что он происходит с короткими последовательностями. Процесс повторяется много раз, результатом чего является экспоненциальное увеличение концентрации исследуемого фрагмента ДНК по отношению к остальным последовательностям геномной ДНК. Классическая ПЦР может быть использована для получения фрагментов ДНК, которые далее можно исследовать с помощью секвенирования, а также оценить их размеры с помощью метода электрофореза. Последний основан на разделении (в зависимости от размера последовательностей) макромолекул, помещенных в гель, который находится в электрическом поле. Помимо этого, имеются также возможности для количественного определения содержания последовательностей нуклеиновых кислот в реальном времени (ПЦР в реальном времени) или по сравнению с другими последовательностями. При некоторых методах необходимо использовать предварительную обработку ДНК с последующей амплификацией для выявления изменения последовательности в исследуемом фрагменте. ПЦР может быть также использована для исследования молекул РНК. Секвенирование позволяет определить нуклеотидную последовательность ДНК. В связи с этим данный метод активно применяется для выявления генных мутаций при моногенных заболеваниях. Наиболее используемый вариант секвенирования известен также как метод Сэнджера. Как правило, перед секвенированием проводят ПЦР с целью увеличения концентрации ДНК фрагмента, последовательность которого необходимо определить. Далее, к однонитевой (денатурированной) молекуле ДНК присоединяются прямой и обратный праймеры, и с помощью ДНК полимеразы проводят синтез «новой» молекулы ДНК на базе дидезоксинуклеозидтрифосфатов и немодифицированных единичных нуклеотидов. В классическом протоколе секвенирования с помощью этого метода предлагается проводить 4 реакции, в каждой из которых реакционная смесь содержит три немодифицированных нуклеотида и один дидезоксинуклеозидтрифосфат. Поскольку полимеризация ДНК будет каждый раз заканчиваться на дидезоксинуклеозидтрифосфате, то в каждой смеси будут находиться фрагменты разных размеров, соответствующие исследуемой последовательности, оборванной на нуклеотиде, замещённом дидезоксинуклеозидтрифосфатом. Затем результаты 4-х реакций анализируются с помощью электрофореза; складывая их, восстанавливается исходная последовательность ДНК. В настоящее время, благодаря созданию высокоразрешающих систем детекции, для секвенирования используются другие способы проведения реакции и анализа конечных результатов. Однако принцип метода остается прежним. В связи с тем, что при многих наследственных заболеваниях патогенные мутации (в основном, рекуррентные) уже известны, отпадает необходимость использования метода секвенирования для их определения. В данном случае наиболее рационально применение рестрикционного анализа с последующей ПЦР. При этом методе используется способность некоторых ферментов (эндонуклеаз рестрикции или рестриктаз) «разрезать» фрагменты ДНК в зависимости от их последовательности в специфических сайтах. Этот процесс также называется рестрикцией. Для проведения данного анализа ДНК необходимо знать изменение последовательности, чтобы подобрать соответствующую рестриктазу. На первой стадии этого метода проводится рестрикция ДНК, а затем ПЦР фрагмента ДНК, в котором предположительно расположена мутация. Результаты ПЦР также анализируются с помощью электрофореза. В основном, используются такие рестриктазы, которые при условии наличия мутации взаимодействуют с ДНК, образуя два фрагмента различных размеров. Возможен также вариант, когда рестриктазы взаимодействуют с неизмененной последовательностью ДНК, тогда как при мутации рестрикции не происходит. 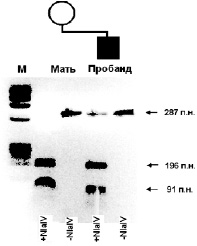 Взаимодействие ДНК с рестриктазой NlaIV (+NlaIV) показывает наличие мутации у ребенка – дополнительная полоса, соответствующая апмлифицированному участку, необработанному рестриктазой (–NlaIV). У матери в данном случае мутации не обнаружено (М – маркер молекулярного веса для определения размера последовательности ДНК). В ряде случаев возникает необходимость сравнительного анализа содержания фрагментов ДНК. С помощью подобных методов, в основном, исследуют полиморфные последовательности, которые с высокой вероятностью будут отличаться в зависимости от родительского происхождения. Они используются для определения родительского происхождения и диагностики однородительской дисомии, потери/приобретения последовательностей ДНК, а также Х-инактивации при условии предварительной обработки веществами, чувствительными к метилцитозину. Наиболее востребованным для этой цели методом является количественная ПЦР. Данная модификация использует мечение одного из праймеров, благодаря чему амплифицированный участок также становится меченым. Затем, с помощью различных систем детекции можно провести сравнительный количественный анализ ДНК фрагментов одного или нескольких аллелей. 58. Основные этапы и методы медико-генетического консультирования. Профилактика наследственных болезней. Главные цели медико-генетического консультирования заключаются в установлении роли наследственной компоненты в этиологии данного заболевания и прогнозировании риска иметь больных потомков. В распоряжении врачей имеется весь арсенал перечисленных методов генетики человека. Пример с лечением фенилкетонурии диетой, из которой исключен фенилаланин, указывает на то, что лица, страдающие многими наследственными болезнями, в настоящее время не могут считаться обреченными. Большие надежды возлагаются на методы генной инженерии, которая в принципе может позволить заменять патологические аллели нормальными и, возможно, вообще постепенно освободит человечество от многих недугов. Лишь немногие наследственные заболевания (например, хорея Гентингтона) проявляются в зрелом возрасте. Большинство форм наследственной патологии обнаруживается уже при рождении ребенка. Поэтому в настоящее время наибольшее внимание уделяется мерам по предотвращению рождения детей с наследственной патологией. Среди методов, позволяющих диагностировать заболевание до рождения ребенка, ведущее место занимает амниоцентез – получение амниотической жидкости и клеток плода с помощью простейшей, не травмирующей плод хирургической операции (см. рис. в конце темы). Этим методом диагностируют не только хромосомные болезни, но и некоторые заболевания, в основе которых лежат генные мутации. Медико-генетическое консультирование призвано избавить человечество от страданий, связанных с наследственными заболеваниями. На это нацелена и генотерапия, возможности которой резко расширились с возникновением генной инженерии. Вместе с тем еще в 1883 г. ФрэнсисГальтон выдвинул идею о необходимости улучшения человеческого рода генетическими методами. Им же предложен термин «евгеника», означающий учение о наследственном здоровье человека и путях улучшения его наследственных свойств. Необходимо подчеркнуть, что с точки зрения генетики человека ни одна биологическая раса, национальность, группа людей, несмотря на определенные различия между ними, не имеют каких-либо преимуществ друг перед другом. Поэтому генетика отвергает евгенические вмешательства в наследственность человека с целью улучшения его природы. Рекомендации, даваемые в медико-генетических консультациях в отношении заключения брака или прогноза генетической полноценности потомства, направлены на то, чтобы они учитывались консультируемыми лицами, которые добровольно принимают соответствующее решение. Методы, предлагавшиеся старыми евгениками, были сугубо селекционными: ограничения на межрасовые браки, иммиграционные барьеры, даже стерилизации генетически неполноценных людей. Других методов, кроме селекционных, генетика тогда не знала. На практике методы евгеники послужили основанием для создания концентрационных лагерей в фашистской Германии, где подвергались массовому уничтожению представители неарийских рас. Естественно, что подобная теория и практика несовместимы с гуманистической моралью общества, в центре внимания которого находится человек. Включает три основных этапа. Как правило, за консультацией обращаются семьи, где уже имеется ребенок с наследственной патологией, или семьи, в которых имеются больные родственники. На первом этапе консультирования производится уточнение диагноза, что является необходимой предпосылкой любого консультирования. Уточнение диагнозав медико-генетической консультации проводят с помощью генетического анализа. Для этой цели используют генеалогический, цитогенетический, биохимический и другие требуемые методы исследований, которым подвергаются пробанд и его родственники. Точный клинический и генетический диагноз заболевания позволяет установить степень генетического риска и выбор эффективных методов пренатальной диагностики и профилактического лечения. На втором этапе консультирования делают прогноз потомства. Генетический риск может быть определен либо путем теоретических расчетов, основанных на генетических закономерностях, либо с помощью эмпирических данных. Сущность генетического прогноза заключается в определении вероятности появления наследственной патологии в семье. Наиболее эффективным является проспективное консультирование, когда риск рождения больного ребенка определяют до наступления беременности или в ранние ее сроки. Такие консультации чаще проводят в случае кровного родства супругов, при отягощенной наследственности по линии мужа или жены, при воздействии вредных средовых факторов на супругов незадолго до наступления беременности. Ретроспективное консультирование проводят после рождения больного ребенка относительно здоровья будущих детей. На третьем этапе консультирования врач-генетик в доступной форме объясняет семье степень генетического риска рождения наследственно аномального потомства, сущность пренатальной диагностики и помогает принять правильное решение в отношении деторождения. Однако окончательное решение этого вопроса остается за родителями. Широкое использование медико-генетического консультирования, разработка способов пренатальной диагностики наследственных заболеваний позволяют существенно уменьшить вероятность появления потомства с наследственной патологией в отдельных семьях. 59. Характеристика методов пренатальной диагностики. Пренатальная диагностика— дородовая диагностика, с целью обнаружения патологии на стадии внутриутробного развития. Позволяет обнаружить более 90 % плодов ссиндромом Дауна(трисомия21); трисомии 18 (известной каксиндром Эдвардса) около 97 %, более 40 % нарушений развития сердца и др. В случае наличия у плода болезни родители при помощи врача-консультанта тщательно взвешивают возможности современной медицины и свои собственные в планереабилитацииребенка. В результатесемьяпринимает решение о судьбе данного ребенка и решает вопрос о продолжении вынашивания или опрерывании беременности. К пренатальной диагностике относится и определение отцовства на ранних сроках беременности, а также определение пола ребенка. Методы пренатальной диагностики Анализ родословной родителей Генетический анализ для родителей Инвазивные (разрушающие) методы пренатальной диагностики Биопсия хориона Плацентоцентез(поздняя биопсия хориона) Амниоцентез Кордоцентез Неинвазивные (неразрушающие) методы пренатальной диагностики Ультразвуковойскрининг плода, оболочек и плаценты Сортинг фетальных клеток Показаниями для применения биохимических методов диагностики у новорожденных являются такие симптомы, как судороги, кома, рвота, гипотония, желтуха, специфический запах мочи и пота, ацидоз, возбужденное кислотно-щелочное равновесие, прекращение роста. У детей биохимические методы используются во всех случаях подозрения на наследственные болезни обмена веществ (задержка физического и умственного развития, потеря приобретенных функций, специфическая для наследственной болезни клиническая картина). +Скрининг - это обследование контингентов с целью разделения их на группы с высокой и низкой вероятностью заболевания. Наследственные болезни обмена веществ, включаемые в скрининговые программы, отбираются по следующим критериям: 1. Заболевания, вызывающие выраженное снижения трудо-и жизнеспособности без своевременного выявления и лечения; 2. Заболевания, весьма распространены в популяции (частота не менее 1:50000-200000) младенцев. 3. Заболевания, которые поддаются лечению с достижением принципиального успеха для больного и для которых разработаны эффективные методы профилактики. 4. Заболевания, для исследования которых разработан адекватный тест. |
