Экзамен, который я обязательно сдам). Определение биологии как науки. Связь биологии с другими науками. Значение биологии для медицины. Фундаментальные свойства живого
 Скачать 1.73 Mb. Скачать 1.73 Mb.
|
|
51. Репарация генетического материала. Фотореактивация. Эксцизионная рекомбинационная, SOS-репарация. Мутации, связанные с нарушением репарации и их роль в патологии человека. Важное значение для ограничения неблагоприятных последствий генных мутаций имеют естественные антимутационные барьеры. Одним из них является парность хромосом в диплоидных наборах хромосом эукариот, которая препятствует проявлению рецессивных мутаций у гетерозиготных особей. Главным антимутационным барьером рассматривается выработавшая в процессе эволюции способность к репарации наследственного материала. Её сущность - в устранении из наследственного материала клетки изменённого участка. Различают 3 системы репарации генетического материала: эксцизионная репарация (репарация путём «вырезания»), фоторепарация и пострепликативная репарация. Механизм эксцизионной репарации заключается в ферментативном разрушении изменённого участка молекулы ДНК с последующим восстановлением на этом отрезке нормальной последовательности нуклеотидов. Такой механизм включает следующие этапы: а) разрыв спирали ДНК у места повреждения при участии эндонуклеаз; б) удаление поврежденного участка с запасом в обе стороны с помощью эндонуклеаз; в) синтез при участии ДНК-полимеразы на месте дефекта нормального участка ДНК; г) «сшивание» последнего с образовававшимися концами спирали ДНК при помощи фермента ДНК-лигазы (восстановление непрерывности ДНК). Например, под действием УФ-лучей у человека нарушается комплементарность пар нуклеотидов в двойной спирали ДНК (появляются пары Т-Т, Ц-Ц и т.п.). Они устраняются вышеописанным способом. Однако у различных индивидуумов наблюдаются генетические различия в активности репаративных ферментов и надёжности функционирования механизма ферментативного разрушения изменённого участка молекулы ДНК в целом. У ряда людей наблюдается изменение ДНК и, как следствие, возникновение заболевания «пигментная ксеродерма». В клетках эукариот обнаружены два вида репарации «путём вырезания»: 1) более продолжительная репарация (длительность процесса - от 1 до 24 часов), восстанавливающая большой фрагмент ДНК (около 100 нуклеотидов); 2) быстродействующая репарация (продолжается от 5 минут до 2 часов), восстанавливающая 3-4 нуклеотида. Пострепликативная(рекомбинационная) репарация «включается» тогда, когда эксцизионная репарация «не справляется» с устранением всех повреждений, возникших в ДНК до её репликации. При репликации во второй спирали ДНК возникают бреши - однонитевые пробелы, соответствующие изменённым нуклеотидам первой спирали. Бреши заполняются участками цепи с нормальной последовательностью нуклеотидов уже в ходе пострешгикативной репарации при участии ДНК-полимеразы. Фоторепарация заключается в расщеплении ферментом (дезоксирибо-пиримидинфотолиазой), активируемым видимым светом, циклобутановых димеров, возникающих в ДНК под действием ультрафиолетового излучения. Механизмам репарации свойственны нарушения и «сбои», которые приводят к повышению чистоты мутаций. Известны специфические мутации, блокирующие механизмы репарации и вызывающие наследственные заболевания (пигментная ксеродерма и др.). Биологическое значение репарации ДНК заключается в резком снижении частоты мутаций, большинство которых оказываются летальными и полулетальными или же снижающими жизнеспособность организмов, вызывающими аномалии и обусловливающими тератогенез. Благодаря репарации ДНК повышается устойчивость генотипа организма к повреждающим агентам (мутагенам). ФОТОРЕАКТИВАЦИЯ - уменьшение повреждающего действия УФ-излучения на живые клетки при последующем воздействии на них ярким видимым светом. Возникла в процессе эволюции как защитное приспособление от губительного действия УФ-компонента солнечного излучения и является одной из важнейших форм репарации живых организмов от повреждений их генетического аппарата. SOS – репарация ДНК – это последняя возможность для поврежденной ДНК клетки, которая подошла к репликации, имея повреждения, не устраненные с помощью всех выше перечисленных механизмов репарации. В таком случае клетка может погибнуть, т. к. репликация «застопорится» на первом неустраненном повреждении. Вместе с тем клетка имеет предназначенный для таких целей крайне рискованный механизм SOS – репарация ДНК, впервые обнаруженный М. Радманом в 1974 году. В ходе этого механизма индуцируется синтез белков, присоединяющихся к ДНК-полимеразному комплексу и «загрубляющих» его работу таким образом, что подпорченный комплекс становится способным строить дочернюю нить ДНК напротив дефектных звеньев матричной нити, и при этом в дочерней нити появляется много ошибок (мутаций). В результате SOS – репарации клетка спасается от гибели на этом этапе, и теперь может произойти клеточное деление. ДНК клетки удвоится, хотя и с ошибками и с высоким риском угрозы для последующей жизни клетки. Основные механизмы развития наследственной патологии связаны с: 1) мутациями, в результате которых возникает, а) выпадение нормальной наследственной информации, б) увеличение объема нормальной наследственной информации, в) замена нормальной наследственной информации на патологическую; 2) нарушением репарации поврежденной ДНК; 3) стойкими изменениями регуляции генной активности. 52. Цитоплазматическая наследственность. Митохондриальный тип наследования у человека. Некоторые признаки (окраска плодов, цветков и листьев, высокая активность клеточного дыхания и др.) могут наследоваться без участия ядерного аппарата. Такое явление возможно благодаря тому, что некоторые клеточные структуры имеют свою автономную кольцевую молекулу ДНК и способны делиться сравнительно автономно от клетки. В эукариотических клетках нехромосомная ДНК содержится в хлоропластах и митохондриях. Молекулы ДНК этих органелл несут информацию о собственных белках, а также об иРНК и тРНК, участвующих в их синтезе. Передача генетической информации через цитоплазму получила название цитоплазматической (внеядерной, нехромосомной) наследственности. Поскольку наследственная информация передается по материнской линии через цитоплазму яйцеклетки, ее называют такжематеринской наследственностью. Непосредственное влияние материнского организма на развитие зародыша часто приводит к большему сходству потомства с матерью, поскольку условия эмбрионального развития организма полностью зависят от матери. +Митохондриальные заболеванияобусловлены генетическими, структурными, биохимическими дефектами митохондрий, приводящими к нарушениям структуры, функций митохондрий, тканевого дыхания. Они передаются только по женской линии к детям обоих полов, так как сперматозоиды передают зиготе половину ядерного генома, а яйцеклетка поставляет и вторую половину генома, и митохондрии. 53. Человек как специфический объект генетического анализа. Методы изучения наследственности человека. Менделирующие признаки человека. Изучение генетики человека связаны с большими трудностями: сложный кариотип – много хромосом и групп сцепления; позднее половое созревание и редкая смена поколений; малое количество потомков; невозможность экспериментирования; невозможность создания одинаковых условий жизни. Несмотря на перечисленные трудности, генетика человека изучена лучше многих других благодаря потребностям медицины и разнообразным современным методам исследования. 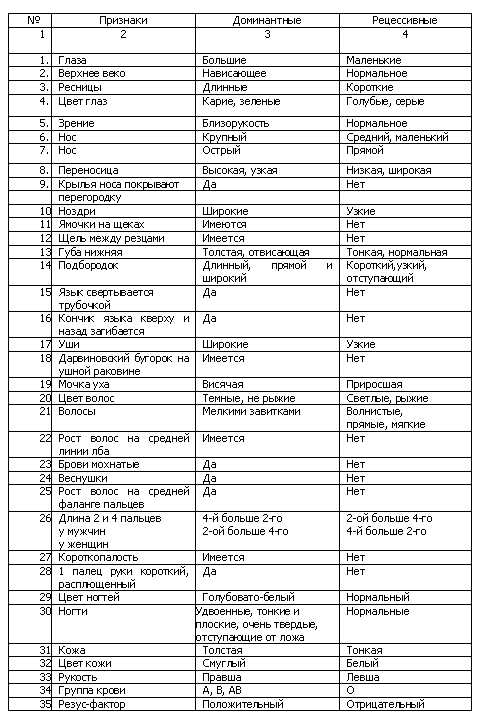 54. Генеалогический метод. Цели, задачи, этапы исследования. Близнецовый метод изучения наследственности человека. Генеалогический метод заключается в анализе родословных и позволяет определить тип наследования (доминантный рецессивный, аутосомный или сцепленный с полом) признака, а также его моногенность или полигенность. На основе полученных сведений прогнозируют вероятность проявления изучаемого признака в потомстве, что имеет большое значение для предупреждения наследственных заболеваний. Генеалогический анализ является самым распространенным, наиболее простым и одновременно высоко информативным методом, доступным каждому, кто интересуется своей родословной и историей своей семьи. Близнецовый метод. Этот метод состоит в изучении близнецов как монозиготных, так и дизиготных. Он позволяет определить не только наследственную природу того или иного признака, но и оценить качественно и даже количественно влияние на тот или иной признак (например, на появление заболевания)наследственности и внешней среды. Так, если у монозиготных близнецов конкордантность по заболеванию резко превышает конкордантность по тому же заболеванию у дизиготных близнецов, то стоит сделать вывод о значительной роли наследственности в развитии данной патологии. Объясняется такой вывод очень легко. Монозиготные близнецы имеют абсолютно одинаковый геном - значит все их различия обусловлены исключительно влиянием среды (биосоциальной среды!). Дизиготные близнецы имеют и генетические отличия, но и среда на них также влияет по-разному. Отсюда, если конкордантность (признак проявляется у обоих близнецов) у монозиготных близнецов выше, чем у дизиготных, то роль наследственности более значительна, чем роль среды. А значит, такое заболевание можно считать наследственным. 55. Биохимические методы, применяемые для диагностики наследственных заболеваний. Скрининг программы. Методы биохимической диагностики наследственных болезней направлены на описание биохимического фенотипа организма. Выбор биохимического метода может быть различным – от определения первичного биохимического продукта (полипептида) до исследования конечных продуктов метаболизма (в крови, моче, поте и других биологических жидкостях). Лабораторная диагностика наследственных болезней проводится по определенному плану и поэтапно. Стратегия лабораторной диагностики основана на данных клинического обследования больного (клинический критерий) и выборе биохимической тактики. На основе поэтапного обследования постепенно исключаются определенные классы болезней. В зависимости от класса выявляемых болезней лабораторная биохимическая диагностика наследственных болезней часто носит дифференцированный характер. Она может включать следующие пути и методы. Массовый скрининг (просеивающие программы) – выявление наследственных болезней преимущественно наследственных дефектов метаболизма) путем массового обследования определенных детских контингентов, главным образом, новорожденных, независимо от пола, возраста и состояния здоровья. Целью массового скрининга является выявление наследственных заболеваний в досимптоматической стадии, до развития клинической картины заболевания. При организации массового скрининга новорожденных необходимо строго соблюдать определенные требования, каждое из которых имеет важное значение в процессе его проведения. При этом необходимо руководствоваться международными требованиями Всемирной организации здравоохранения (ВОЗ): Обследование проводится на заболевание ребенка, которое развивается постепенно и в манифестной фазе делает его инвалидом; при этом имеются проверенные методы предупреждения формирования патологического фенотипа. Тип наследования болезни и ее патогенез должны быть четко установлены, а для семьи – доступна медико-генетическая консультация. Методы скрининга, подтверждающая диагностика и превентивного лечения должны быть доступны для практического здравоохранения. Ложноположительные результаты методов скрининга должны быть редкими, ложноотрицательные – исключены. Стоимость программ массового скрининга не должна превышать расходов на содержание и лечение детей, ставших инвалидами из-за данного заболевания. Права семьи и самого ребенка, у которого, по данным скрининга, обнаружено наследственное (врожденно) заболевание, должны быть защищены (полная информация родителей о скрининг-программе, право на отказ от включения их новорожденного в число обследуемых, конфиденциальность при подтверждении диагноза, сохранение врачебной тайны). Скрининг новорожденных позволяет рано, еще на доклинической стадии, выявить наследственное заболевание и рано начать лечение, предупредить тяжелые поражения центральной нервной системы и другие тяжелые инвалидизирующие расстройства. Наибольшее распространение в медицинской практике получили скринирующие программы на следующие наследственные заболевания: фенилкетонурию, врожденный гипотиреоз, муковисцидоз, галактоземию, адреногенитальный синдром. В России обязательными являются массовый скрининг новорожденных на 3 заболевания: фенилкетонурию, врожденный гипотиреоз и муковисцидоз. Массовый скрининг на фенилкетонурию (ФКУ). Забор образцов крови на фильтровальную бумагу проводится у новорожденного на 4 – 5 день жизни. Образцы взятой крови отправляются в медико-генетические консультации или медико-генетические центры, где осуществляется определение концентрации фенилаланина в крови, взятой на фильтровальную бумагу. Основным биохимическим маркером ФКУ, выявляемым при использовании любых методов, является увеличение концентрации фенилаланина в крови более 120 мкмоль/л (более 2 мг%). В программах массового скрининга на ФКУ и другие дефекты обмена используются, главным образом три метода: 1) микробиологический тест Гатри - основан на принципе молекулярного антагонизма, когда микробный рост наблюдается только вокруг дисков, содержащих избыточное количество фенилаланина; 2) хроматография на бумаге или другом носителе (селикагель и др.); 3) флюорометрический метод (более чувствительный), основанный на образовании флюоресцирующего комплекса фенилаланина с лейцилаланином. В России для применения этого метода используются аппараты типа Флюороскан, Дельфия, Victor. В настоящее время перечисленные методы начинает заменять тендемная масс-спектрометрия. Это наиболее чувствительный и дающий меньше всего ложноположительных результатов метод выявления ФКУ в первые 24 часа жизни новорожденного. Массовый скрининг на врожденный гипотиреоз. Во взятой на фильтровальную бумагу (карту Гатри) крови новорожденного, определяется содержание тиреотропного гормона (ТТГ). Содержание ТТГ в крови здоровых новорожденных – менее 20 мкЕд/мл. При повышении данного уровня проводится повторное обследование ребенка через 3 – 4 недели. При содержании ТТГ свыше 50 мкЕд/мл определяют содержание ТТГ, тироксина (Т4) и трийодтиронина (Т3) в плазме крови. Ранняя диагностика и заместительная терапия L-тироксином позволяет полностью предупредить отставание ребенка в нервно-психическом развитии. Массовый скрининг на муковисцидоз. На первом этапе проводится тест на содержание иммунореактивного трипсина в капле крови, взятой на фильтровальную бумагу (карту Гатри). Пороговая концентрация иммунореактивного трепсина составляет 750 нг/мл. При превышении порового уровня проводится повторное обследование ребенка через 4-6 недель. При положительном результате повторного исследования проводится проба на содержание хлора и натрия в поте. Пороговый уровень хлора и натрия в поте составляет при 60 ммоль/л. В настоящее время для обследования новорожденных был разработан аппарат Nanoduct, объединяющий систему для стимуляции потоотделения путем электрофореза 0,1% раствора пилокарпина и анализатор проводимости пота. При данном обследовании положительными считаются результаты выше 80 ммоль/л, показатели 60-80 ммоль/л являются пограничными, менее 60 ммоль/л - отрицательными. Для полного подтверждения диагноза муковисцидоза рекомендуется провести молекулярно-генетическую идентификацию мутантного гена дельта-F-508. Селективный скрининг – предусматривает обследование определенных детских коллективов с отклонениями в состоянии здоровья для выявления наследственной патологии. Например, обследований всех детей с отклонениями в нервно-психическом развитии для диагностики наследственных дефектов обмена веществ. Цель селективного скрининга – выявить необычные метаболиты или избыток их накопления и/или выделения (биологическая жидкость) для диагностики наследственного заболевания обмена веществ. Чаще для этих целей используют качественные, полуколичественные и количественные методы исследования мочи или крови. Качественные методы а) Анализ крови. Важное значение имеет визуальная оценка взятой в пробирку крови ребенка. Кровь цвета молока (хилезная кровь может свидетельствовать о накоплении в организме и тканевой жидкости хиломикронов и пре-β-липопротеидов, что определяет направление дальнейших диагностических поисков на пути исследования состояния липидного обмена. б) Анализ мочи. Для предварительной диагностики наследственных болезней рекомендуется обращать внимание на простую визуальную оценку цвета и запаха мочи. Так, при алкаптонурии моча при стоянии или добавлении щелочи приобретает черно-коричневый цвет, при порфирии моча имеет красный или коричневый цвет, при наследственном дефекте транспорта триптофана – голубой, а при липидурии моча молочно-белого цвета. Мышиный запах мочи определяется при фенилкетонурии, запах кленового сиропа – при одноименном заболевании (болезнь с запахом мочи кленового сиропа), сернистый запах мочи – при цистинурии, запах «кипящей капусты» или прогорклого масла – при тирозинемии 1 типа. Наряду с клинической характеристикой состояния цвета и запаха мочи, большую роль в диагностике наследственной патологии играют результаты качественных лабораторных исследований, с помощью которых можно выявить ряд веществ (метаболитов), характерных, как правило, для целой группы заболеваний. Среди них используются скрининг-тесты: Экспресс-тесты (капельные и цветные реакции мочи) с хлористым железом (FeCl3) для ориентировачной диагностики наследственных болезней обмена аминокислот. При добавлении к моче хлористого железа моча окрашивается в темно-зеленый цвет (при фенилкетонурии) или в цвет хаки (при болезни кленового сиропа). Тест Милона: при добавлении к моче, высушенной на фильтровальной бумаге , 1 капли реактива Милона, образуется красно-оранжевая окраска (положительный тест). Тест положителен при тириозинозе, болезни Вильсона, галактоземии, цистинозе. Тест на кетоновые тела (ацетоацетат) – появление красной окраски свидетельствует о положительной реакции – может использоваься для диагностики острых нарушений обмена органических кислот, болезни кленового сиропа, митохондриальных болезней, гликогенозе I, III и IV типа. Тест Бери (с толуидиновым синим) положителен при некоторых типах мукополисахаридозов, с помощью этого теста определяют повышенную экскрецию гликозаминогликанов. Предложены и другие мочевые экспресс тесты для ранней диагностики наследственных болезней обмена веществ. К полуколичественным методам диагностики наследственных болезней относятся: бумажная хроматография (качественный метод) и жидкостная хроматография (количественный метод). Используется для выявления нарушений аминокислот, органических кислот, нарушения цикла мочевины, митохондриальных болезней. Этот метод предполагает одновременное исследование аминокислот крови. Среди количественных методов можно выделить: определение экскреции органических кислот с мочой с помощью метода газовой и масс-спектрометрии – проводят при подпзрении на наследственные нарушения аминокислот, органических кислот, обмена жирных кислот, митохондриальные болезни; определение ацилкарнитина и ацилглицина – выполняется при подозрении на дефицит карнитина, дефекты метаболизма органических кислот; тонкослойная хроматография – чувствительный и специфический метод скрининга, направленный на выявление нарушений обмена гликозаминогликанов, олигосахаридов, аминокислот; методы исследования тканевых культур (нативных и культивированных)- направлены на определение активности ферментов (флюорометрическим методом); биохимические методы – применяются также для диагностики гетерозиготного носительства (болезнь Вильсона_коновалова, недостаточность глюкозо-6-фосфатдегидрогеназы и др.) Современная диагностика наследственных болезней у детей базируется не только на методах массового и селективного скрининга, но и связана с внедрением новых высокоразрешающих молекулярных и аналитических технологий, в частности, с внедрением капиллярного электрофореза, гель-электрофореза белков и нуклеиновых кислот, блоттинг-белков, жидкостной хроматографии с использованием хроматографов среднего и низкого давления, тандемной хроматографии с масс-спектрометрией и др. Верифицирующая (подтверждающая) биохимическая диагностика имеет целью подтвердить или опровергнуть диагноз у лиц с клиническими симптомами болезней или у лиц с подозрением на наследственные болезни, выявленные при массовом или селективном скрининге. Для диагностики могут использоваться различные биологические материалы (кровь, сыворотка крови, плазма, моча, пот, спинномозговая жидкость), культура клеток (фибробласты, лимфоциты, гепатоциты). Для верификации наследственной патологии применяются соответствующие методы и лабораторная аппаратура. Среди количественных лабораторных методов диагностики наследственных болезней в медико-генетической практике нашли широкое применение следующие методы подтверждающей диагностики: аналитической биохимической диагностики, цитогенетической диагностики (для выявления хромосомных болезней), молекулярно-генетической, молекулярно-цитогенетической диагностики и исследование кариотипа тканевых культур (культура фибробластов и др.). Так, в диагностике умственной отсталости, связанной с нарушением обмена веществ, могут использоваться определенные качественные мочевые экспресс-тесты на выявление отдельных метаболитов, обусловленных дефектами аминокислот (с использованием методов селективного с5крининга), а также комплексы исследований для верификации классов наследственных болезней обмена веществ, которые осуществляются в специализированных медико-генетических центрах и лабораториях. Разработки новых высоких технологий исследования ДНК и РНК, аналитической биохимии, иммунологии, энзимологии, на основе которых были разработаны новые или более совершенные методы диагностики наследственных болезней, расширили диагностические возможности клинической генетики и медико-генетической практики. Созданы целые программы диагностики наиболее распространенных моногенных наследственных заболеваний, определены показания для целенаправленного обследования больного. |
