|
домашнее задание. Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре
Во сколько раз увеличится скорость реакции при повышении температуры на 200С, если температурный коэффициент (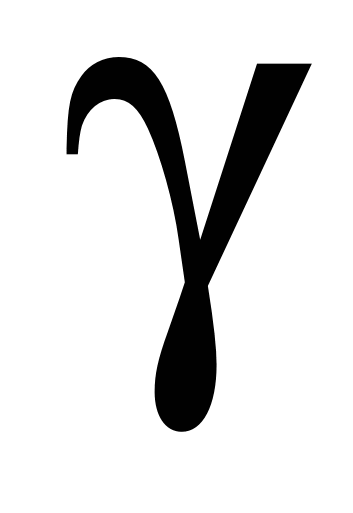 ) равен 3? ) равен 3?
В какую сторону сместится равновесие реакции
N2 (г) + 3H2 (г) 2NH3 (г) Н0Х.Р. 0
при: а) повышении давления;
б) повышении температуры
Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
NaBrO3 + NaBr + H2SO4 Br2 + Na2SO4 + H2O.
Составьте схему гальванического элемента, электродами которого являются Ni и Cu. Концентрация NiCl2 составляет 10-2 моль/л, CuCl2 – 1 моль/л. Вычислите ЭДС элемента и напишите уравнения реакций, протекающих на электродах.
Вычислите выход по току при осаждении Zn из раствора ZnSO4, если электролиз вели при силе тока 3А 10 минут и при этом на катоде выделилось 0,46 г цинка? Напишите химические реакции процессов, происходящих на катоде и аноде.
Подберите протектор, защищающий стальную конструкцию, эксплуатируемую под землей (среда нейтральная). Составьте схему образующихся микрогальванопар и уравнение входного и катодного процессов.
Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 11Na 31Ga 41Nb.
ВАРИАНТ 4.
Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
As2O5 + RbOH ZnCO3 + H2CO3
K2O + HClO4 CuOHIO3 + H2SO4
Fe(NO3)3 + Na2SO4 Mg + H3PO4
Плотность 40 % раствора HNO3 равна 1,25 г/см3. Рассчитайте полярность и нормальность этого раствора.
Возможно ли разложение NO2 по уравнению:
2NO2 = 2NO + O2
Вещество |
Н0298 кДж/моль
|
S0298 Дж/моль К
|
NO2(г)
|
33,5
|
240,32
|
NO(г)
|
90,31
|
210,72
|
O2(г)
|
0
|
205
| |
|
|
 Скачать 387 Kb.
Скачать 387 Kb.