Основы биологической химии предисловие
 Скачать 7.85 Mb. Скачать 7.85 Mb.
|
27%. Концентрации главных катионов и анионов в межклеточной жидкости и плазме крови почти не отличаются. Основным катионом во вне клеточной среде является ион Na+ (свыше 90% от общей концентрации всех катионов), а из анионов - CI¯, и НСО3¯ (соответственно около 70 и 18%). Внутри клетки преобладают катионы К+ (75%) и анионы РО3¯(50%). В табл.18 приведены основные элементы, встречающиеся в организме человека, и указаны их содержание и биологическая роль.
2 л. в сутки); к этому добавляется 0,3-0,4 л метаболической воды, образующейся при тканевом дыхании. При продолжительности жизни 70 лет человек потребляет около 25 т воды.
5-7%) Содержание воды в плазме крови остаётся практически постоянным на протяжении всей жизни (Глава 14. ВОДНО-СОЛЕВОЙ И МИНЕРАЛЬНЫЙ ОБМЕН 1-3% (входит в состав спинномозговой, внутриглазной, синовиальной - в полости суставов -жидкостей и т.д.) Остальная вода - внеклеточная (межклеточный метрике
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В клетках различных органов человека содержание воды неодинаково (табл.17), что определяется значением Н2О для функции той или иной ткани. В большинстве тканей воды 65-70%, а в крови и почках её более 80% (% от массы ткани). Низкое содержание H2O в жировой ткани объясняется неспособностью жира удержать воду (см. табл 17).
Таблица 17 Содержание воды в различных органах и тканях взрослого человека (% от массы ткани)
| Ткань или орган | Вода | Ткань или орган | Вода |
| Жировая ткань | 10,0 | Мышца | 75,6 |
| Костная ткань | 22,0 | Селезенка | 75,8 |
| Печень | 68,3 | Легкие | 79,0 |
| Кожа | 72,0 | Ceoaue | 79,2 |
| Кишечник | 74,5 | Почки | 82,7 |
| Мозг | 74,8 | Кровь | 83,0 |
Роль и функции воды в процессе жизнедеятельности
Вода в жизни организмов играет важнейшую роль. Так выяснено, что полная утрата жиров и понижение наполовину содержания белков в организме в результате голодания не столь опасны, как потеря воды. При отсутствии питья человек погибает через несколько суток в результате дегидратации тканей, когда общее количество воды в организме уменьшается на 10 -12%.
В силу особенностей физико-химических свойств вода имеет следующие биологические функции:
1. Вода - растворитель и стабилизатор растворенных биологических молекул и ионов. В силу своей полярности молекулы воды способны объединяться в структурные агрегаты за счёт возникновения водородных связей. Образуются ассоциаты, состоящие, как минимум из пяти молекул воды (рис.41). Так как при движении молекул воды водородные связи быстро рвутся, ассоциаты могут разрушаться. Поэтому между отдельными молекулами воды и ассоциатами существует равновесие.
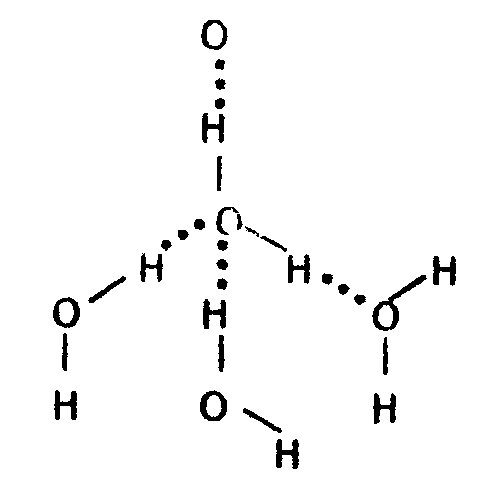
Рис.41. Схема образования ассоциатов из молекул воды
Высокая полярность молекул воды объясняет её высокую диэлектрическую проницаемость по сравнению с другими веществами. Для Н2О она равна 80, а, например, для такого хорошего растворителя как этанол - 24. Это значит, что силы сцепления в веществе, помещённом в воду, ослабляются в 3,5 раза больше, чем в этаноле. Поэтому вода - прекрасный растворитель. Вещества в водном растворе имеют водную или гидратную оболочку, которая образуется в результате взаимодействия дипольных молекул Н2О с заряженными группами макромолекул или ионов. Чем больше гидратная оболочка, тем лучше растворимо вещество. Все неорганические и органические соединения, диссоциирующие на ионы, все биологические мономеры (аминокислоты, нуклеотиды, моносахариды, глицерин), все биополимеры (белки, нуклеиновые кислоты, полисахариды), имеющие полярные группы, растворимы в воде. Так, в простейшей бактериальной клетке на одну молекулу нуклеиновой кислоты приходится около миллиона, на одну белковую молекулу - примерно десять тысяч молекул воды. Молекулы, содержащие неполярные цепи или отдельные группы, плохо растворимы или нерастворимы в Н2О (высшие жирные кислоты, жиры, стероиды и др.).
2. Вода - регулятор теплового баланса организма (сохранение, распределение и отдача тепла). Образованием ассоциатов объясняются аномально высокие температуры кипения, плавления и высокая теплоёмкость воды. Если бы молекулы воды не объединялись в ассоциаты, то, согласно положению кислорода в периодической системе, t кипения его гидрида была бы равна -80°С, a t затвердевания -100°С, т.е. нормальное состояние воды в условиях Земли было бы газообразным жизнь была бы невозможна.
Теплоемкость Н2О более чем в два раза превышает теплоемкость любого биологического вещества. Поэтому Н2О может долго сохранять тепло при изменении температуры окружающей среды и переносить его на расстояния, что важно для поддержания температуры организма.
3. Транспортная функция. Низкая вязкость, подвижность, уникальная стюсобность растворять большое число неорганических и органических соединений обусловливают транспортную функцию Н2О. Она же служит для выведения из организма продуктов распада. Транспорт веществ осуществляется как в больших масштабах - по кровеносной и лимфатической системе, так и в малых масштабах - через клеточные и внутриклеточные мембраны. Большое поверхностное натяжение воды обеспечивает капиллярные явления, т.е. поднятие воды с растворёнными в ней веществами от корня растения по тонким каналам к побегам и, наоборот, от листьев к нижним частям растений (транслирация).
4. Вода выполняет механическую (гидратациоиную) функцию, т.е. способствует сохранению внутриклеточного давления и формы клеток (туpгop).
5. Структурная функция воды. Например, взаимодействие белков с водой обеспечивает их комформацию с преимущественным расположением гидрофильных групп на поверхности белковой глобулы, а гидрофобных - внутри. Ещё большее значение имеет вода для структурной организации биологических мембран и их основы - двойного липидного слоя, в котором гидрофильные поверхности каждого монослоя взаимодействуют с водой, отграничивая от неё гидрофобное пространство внутри мембраны, между монослоями. Вместе с другими соединениями она участвует в качестве основного компонента в формировании единой внутриклеточной структуры. Будучи составной частью субклеточных структур, она может регулировать их функциональную активность: например, от степени набухания митохондрий зависит активность протекания в них окислительного фссфорилирования, от насыщения водой рибосом - поддержание их структур и способности осуществлять синтез белка.
6. Синтетическая функция. Вода - непосредственный участник многих химических реакций. При этом она может играть как анаболическую роль (реакции гидратации и дегидратации, окисления и другие реакции синтеза), так и катаболическую (реакции гидролиза).
7. Электронодонорная или энергетическая функция воды. Например, вода - источник электронов при трансформации энергии в хлоропластах.
14.2. Регуляция водно-солевого обмена
Организм человека выделяет в сутки 2,6 л Н2О за счёт испарения через кожу, с мочой, калом, выдыхаемым воздухом. Между тремя основными бассейнами Н2О в организме существует непрерывный интенсивный обмен. Например, перемещение жидкости (путём диффузии) через стенки капилляров в теле человека составляет около 1500 л в 1 мин. В растительных организмах обмен воды идёт интенсивнее, чем в организмах животных и человека. Например, в течение вегетационного периода одно растение кукурузы или подсолнечника испаряет до 200 кг Н2О. Вода непрерывно доставляется к тканям и отводится от них, проникает в клетки и обратно из них через поры клеточных мембран диаметром 3-4 Å. Время полуобмена воды вклетках ряда тканей составляет 30-90 с, т.е. гораздо больше, чем для органических молекул или ионов.
Основными параметрами жидкой среды организма являются осмотическое давление (Р), рН и объём внеклеточной жидкости. Осмотическое давление и рН внеклеточной жидкости и плазмы крови одинаковы, они также одинаковы для различных органов. С другой стороны, рН может быть различным внутри клеток различных типов и даже в различных субклеточных структурах, что объясняется особенностями метаболизма в различных органах и органоидах. Однако значение рН, характерное для данного типа клеток, постоянно; снижение или повышение его приводит к нарушению функций клеток.
Поддержание постоянства внутриклеточной среды обеспечивается постоянством осмотического давления, рН и объёма внеклеточной жидкости. В свою очередь, постоянство параметров внеклеточной жидкости определяется действием почек и системы гормонов, регулирующих их функцию.
Регуляция осмотического давления и объёма внеклеточной жидкости
Осмотическое давление внеклеточной жидкости зависит от соли NaCl, которая в этой жидкости в наибольшей концентрации. Поэтому основной механизм регуляции осмотического давления связан с изменением скорости выделения почками либо Н2О, либо NaCl, вследствие чего меняется концентрация. NaCl в жидкостях тканей, а значит и осмотическое давление. Регуляция объёма внеклеточной жидкости осуществляется за счёт одновременного изменения скорости выделения и Н2Ои NaCl. Катионы Na+ вызывают накопление воды в клетках и тканях, а катионы К+ и Са+2 оказывают противоположное действие. Выделение воды и NaCl почками регулируется антидиуретическими гормонами - вазопрессином и альдостероном.
Вазопрессин, образуемый задней долей гипофиза в ответ на повышение осмотического давления внеклеточной жидкости, увеличивает скорость обратного всасывания воды из первичной мочи в почечных канальцах. Тем самым уменьшается диурез, моча становится более концентрированной. Вазопрессин, сохраняя необходимый объём жидкости в организме, не влияет на количество NaCl. Осмотическое давление внеклеточной жидкости при этом уменьшается и устраняется стимул, который вызвал выделение вазопрессина.
Альдостерон, вырабатываемый в коре надпочечников при снижении концентрации NaCl в крови, увеличивает скорость реабсорбции ионов Na+ (NaCl) в канальцах нефронов почек. В результате действия альдостерона NaCl задерживается в организме и устраняется стимул, вызвавший секрецию альдостерона. Избыточная секреция альдостерона и соответственно повышение концентрации NaCl приводит к повышению осмотического давления внеклеточной жидкости. В ответ на это усиливается секреция вазопрессина, который задерживает в организме воду. В результате накапливаются и NaCl, и Н2О: объём внеклеточной жидкости увеличивается при сохранении нормального осмотического давления. При увеличении объема внеклеточной жидкости повышается кровяное давление, эту форму гипертонии называют почечной.
Значительное уменьшение объёма внеклеточной жидкости может стать причиной нарушения кровоснабжения тканей. При этом нарушаются функции всех органов, прежде всего головного мозга: возникает состояние шока.
Альдостерон и вазопрессин регулируют водно-солевой обмен на уровне органа - почек. Однако само соотношение в организме этих гормонов регулируется центральной нервной системой (см. главу 16).
Регуляция рН
Регуляция рН обеспечивается избирательным выделением кислот или щелочей с мочой; рН мочи поэтому может изменяться в пределах 4,6-8,0.
Значение рН внеклеточной жидкости в норме равно 7,36-7,44. Пределы отклонения рН от нормы, совместимые с жизнью, до .7,0 при ацидозе, и до 7,8 при алкалозе.
Постоянство рН поддерживается буферными системами внеклеточной жидкости, изменением лёгочной вентиляции и скоростью выделения кислот через почки. Главным буфером внеклеточной жидкости служит система:
(НСОз)¯ + Н+ ↔ Н2СО3 ↔ H2O + СО2.
Значение рН определяется отношением [НСО3¯] / [CO2]. При рН 7,4 оно равно 20:1; уменьшение этого отношения приводит к снижению рН (ацидоз), увеличение - к повышению (алкалоз). Значение отношения [НСО3¯] / [CO2] зависит от изменения как [НСО3¯], так и [CO2] . Концентрация СО2 зависит от скорости удаления его через лёгкие, поэтому при нарушениях дыхательной функции могут возникать дыхательный ацидоз или алкалоз. Концентрация ионов (НСОз)¯ меняется главным образом в результате метаболических нарушений, например, уменьшается при повышении концентрации кетонов (метаболический ацидоз).
Почки участвуют в регуляции кислотно-щелочного равновесия, изменяя выделение ионов водорода Н+. Они выделяются либо в составе недиссоциированных кислот, либо в составе NH4+. Кроме того клетки почек могут поставлять в кровь дополнительные количества иона (НСОз)¯, образующегося в результате- окисления метаболитов:
метаболиты + О2 → СО2
СО2 + Н2О ↔» H2CO3 ↔ (HCO3)¯ +Н+.
Ионы Н+ выводятся из клеток в канальцы нефрона и выделяются с мочой, а ионы (НС03)¯ из почечных клеток в форме NaHCO3 переходят в кровь, понижая её кислотность (компенсация ацидоза).
Гормоны непосредственно не участвуют в регуляции рН внеклеточной жидкости, однако при ряде заболеваний эндокринной системы возникают нарушения кислотно-щелочного равновесия, например, ацидоз при диабете.
14.3. Минеральный обмен
Минеральные вещества
Минеральные (неорганические) вещества находятся в клетках в виде ионов. В клетках и внеклеточных жидкостях организма человека основными катионами являются Na+, К+, Са2+, Mg2+ , среди анионов преобладают РО3¯, CI¯, SJ42- , HCO3¯. Суммарный положительный заряд катионов равен суммарному отрицательному анионов, хотя и допускаются некоторые колебания в ту или иную сторону. Для достижения электронейтральности организму не хватает неорганических анионов. Это компенсируется анионами органических кислот и кислых белков. Вне клетки для этого требуется
| Элемент | Критические ткани с преимущественный накоплением элемента | Биологическая роль | Общее содержание элемента | |
| в цельной крови, г/100 мл | мас. доля в сухом веществе | |||
| 1 | 2 | 3 | 4 | 5 |
| Бор 5В | Щитовидная железа, костный мозг | Участвует в углеводном обмене, усиливает действие инсулина, уменьшает действие витаминов В2 и В12, а также кишечной амилазы и протеина, тормозит окисление адреналина | 1·10-6 4·10-5 | n·10-4 n·10-5 |
| Фтор 9Р | Костная ткань, зубы | Участвует в формировании скелета, повышает устойчивость зубов к кариесу, стимулирует кроветворение и иммунитет | 1·10-5 4,5·10-5 | n·10-3 n·10-5 |
| Алюминий 13А1 | Печень, головной мозг, кости | Способствует развитию и регенерации эпителиальной, соединительной и костной ткани; активирует ферменты; влияет на активность пищеварительных желез; препятствует лро-никновению ионов металла внутрь протоплазмы | 1·10-6 4·10-5 | n·10-4 n·10-5 |
| Кремний 14Si | Соединительная ткань, поджелудочная железа, почки, мозжечок, волосы | Влияет на функции поджелудочной железы и на эластичность кожи, ускоряет процесс образования рубцов | 1,6·10-2 | n·10-2 n·10-4 |
| Ванадий 23 V | Мало изучены (кровь?) | Участвуют в окислительно-восстановительных процессах, оказывает влияние на процессы дыхания и кроветворения | - | n·10-4 n·10-5 |
| Хром 24 Cr | Волосы, ногти | Входит в активный центр фермента трипсина; активирует окислительные процессы | 35·10-6 1,2·10-5 | n·10-4 n·10-6 |
| 1 | 2 | 3 | 4 | 5 |
| Марганец 25Мn | Кости, печень, щитовидная железа, гипофиз | Участвует в формировании скелета в иммунных реакциях, в кроветворении и тканевом дыхании; влияет на активность многих витаминов, ферментов и гормонов | до 2,5·10-5 | n·10-4 n·10-5 |
| Железо 26 Fe | Эритроциты, селезенка, печень | Входит в состав гемоглобина, участвует в кроветворении, дыхании и окислительно-восгановительных реакциях; недостаток Fe приводит к анемии | 4·10-3 | n·10-1 n·10-2 |
| Кобальт 27 Со | Печень, кровь, селезенка, щитовидная железа, костная ткань, яичники, гипофиз | Участвует в синтезе ряда ферментов (глициндипептидазы, холинэстеразы, ацилазы), гормона щитовидной железы, витамина В12, гемоглобина и др.; стимулирует кроветворение, деятельность щитовидной железы, регулирует углеводный обмен | 3,9 ·10-7 1,48·10-6 (плазма) | n·10-5 n·10-6 |
| Никель 28Ni | Поджелудочная железа печень, гипофиз, кожа, роговица глаза | Активирует фермент ангидразу, влияет на окислительные процессы и углеводный обмен; входит в состав инсулина | - | n·10-5 n·10-2 |
| Медь 29 Си | Печень, кости, головной мозг | Входит в состав многих тканевых белков и ферментов (лактазы, тирозиназы, оксидазы и др.); повышает активность некоторых гормонов; участвует в кроветворении, ферментном окислении, тканевом дыхании, иммунных процессах, пигментации | 6,9 ·10-5 1,17·10-4 | n·10-3 n·10-4 |
| Цинк 30 Zn | Печень, предстательная же леза, сетчатка | Входит в состав ряда тканевых белков и ферментов, активирует гормоны гипофиза, поджелудочной железы и половые; участвует в кроветворении и деятельности желез внутренней секреции, содействует удалению из организма СО2: при дефиците Zn - отставание роста, выпадение волос, угнетение половых функций | 5 ·10-4 1,275·10-4 | n·10-2 n·10-3 |
| 1 | 2 | 3 | 4 | 5 |
| Мышьяк 33Аs | Печень, селезенка, почка, эритроциты | Связан с гемоглобином эритроцитов, в дозах до 0,5 мг улучшает кроветворение, усвоение азота и фосфора, ограничивает распад белков; в значительных дозах ядовит | 8 ·10-4 | n·10-4 n·10-6 |
| Селен 34Se | Печень, почки, селезенка, сердце, роговые образования, кровь | Вступает во взаимодействие с белками крови - альбумином, гемоглобином и глобулинами, а также с инсулином; повышает активность кофермента Q (убихинона); снижает адреналиновую гипергликемию; в повышенных дозах ядовит | - | n·10-5 n·10-7 |
| Бром 35Br | Головной мозг, щитовидная железа, гипофиз, яичники, почки | Участвует в регуляции деятельности нервной системы, коры надпочечников и половых желез; угнетает деятельность щитовидной железы | 2 ·10-4 1,5·10-2 | n·10-3 n·10-4 |
| Стронций 38Sr | Костная ткань | Участвует в образовании костной ткани, усиливает активность фермента фосфатазы | - | n·10-3 n·10-3 |
| Молибден 42Мо | Печень, почки, надпочечники, белое вещество мозга, пигментная оболочка глаза | Входит в состав тканевых белков и некоторых ферментов (ксантин-оксидазы, альдегид-оксидазы и др.); ускоряет рост, избыток Мо приводит к молибденовой подагре | - | n·10-4 n·10-6 |
| Кадмий 48Cd | Печень, почки | Входит в состав инсулина и некоторых ферментов, активирует аргиназу и амилазу, но тормозит действие редуктазы; влияет на работу печени | Следы | n·10-3 |
| Олово 48 Sn | Костная ткань, печень, легкие | Обязательная составная часть костей (0,08%); печени (0,006%) и легких (0,045%), биологические функции олова не вполне ясны | 1 ·10-5 5·10-5 | n·10-3 n·10-5 |
| 1 | 2 | 3 | 4 | 5 |
| Йод 53I | Щитовидная железа, надпочечники | Входит в состав гормона щитовидной железы - тироксина, активизирует функцию щитовидной железы; влияет на синтез ряда белков и жиров; интенсифицирует окислительно-восстановительные процессы; недостаток йода вызывает гипотериоз и эндемический зоб, избыток - гипертиреоз и базедову болезнь | 2,4·10-6 3,2·10-6 | n·10-3 n·10-5 |
| Свинец 82 Рb | Трубчатые кости, печень | Обязательная составная часть трубчатых костей (1,83 мг %) и печени (1,30 мг %); избыток свинца приводит к поражению центральной нервной системы и желудочно-кишечного тракта, к нарушению синтеза гемоглобина | 5·10-4 1,2·10-5 | n·10-3 n·10-5 |
Для всех живых организмов характерна разница (градиент) концентраций основных неорганических ионов между внутриклеточной и внеклеточной жидкостями, которые разделены клеточной мембраной. Мембрана обладает избирательной проницаемостью по отношению к отдельным ионам и вообще непроницаема для крупных макромолекул, таких как, например, белки.
Функции минеральных веществ
Неорганические ионы, или минеральные вещества, выполняют в организме следующие функции:
1. Биоэлектрическая функция. Эта функция связана с возникновением разности потенциалов на клеточных мембранах. Градиент концентрации ионов по обе стороны мембраны создаёт в разных клетках потенциал порядка 60-80 мВ. Внутренняя сторона клеточной мембраны относительно наружной заряжена отрицательно. Электрический потенциал мембраны тем выше, чем больше содержание белка и его ионизация (отрицательный заряд) внутри клетки и концентрация катионов вне клетки (диффузия ионов Na+ и К+ через мембрану внутрь клетки затруднена). Данная функция неорганических ионов используется для регуляции функций особенно возбудимых клеток (нервных, мышечных) и для проведения нервных импульсов.
2. Осмотическая функция используется для регуляции осмотического давления. Живая клетка подчиняется закону изоосмополярности: во всех средах организма, между которыми есть свободный обмен водой, устанавливается одинаковое осмотическое давление. Если число ионов в какой-то среде возрастает, то вслед за ними устремляется вода, пока не установится новое равновесие и новый уровень осмотического давления.
3. Структурная функция обусловлена комплексообразующими свойствами металлов. Ионы металлов взаимодействуют с анионными группами белков, нуклеиновых кислот и других макромолекул и тем самым обеспечивают наряду с другими факторами поддержание определённых конформаций этих молекул. Поскольку биологическая активность биополимеров зависит от их конформаций, то нормальное осуществление белками их функций, беспрепятственная реализация информации, заложенной в нуклеиновых кислотах, образование надмолекулярных комплексов, формирование субклеточных структур и другие процессы немыслимы без участия катионов и анионов.
4. Регуляторная функция заключается в том, что ионы металлов являются активаторами ферментов и тем самым регулируют скорость химических превращений в клетке. Это прямое регуляторное действие катионов. Косвенное заключается в том, что ионы металлов часто необходимы для действия другого регулятора, например, гормона. Приведём несколько примеров. Формирование активной формы инсулина невозможно без ионов цинка. Третичная структура РНК в огромной степени определяется ионной силой раствора, а такие катионы, как Сr2+, Ni2+, Fe2+, Zn2+,Mn2+ и другие, непосредственно участвуют в формировании спиральной структуры нуклеиновых кислот. Концентрация ионов Мg2+ влияет на формирование такой надмолекулярной структуры, как рибосомы.
5. Транспортная функция проявляется в участии некоторых металлов (в составе металлопротеидов) в переносе электронов или простых молекул. Например, катионы железа и меди входят в состав цитохромов, являющихся переносчиками электронов в дыхательной цепи, а железо в составе гемоглобина связывает кислород и участвует в его переносе.
6. Энергетическая функция связана с использованием фосфат-анионов в образовании АТФ и АДФ (АТФ - основной носитель энергии в живых организмах).
7. Механическая функция. Например, катион Са+2 и фосфат-анион входят в состав гидроксилапатита и фосфата кальция костей и определяют их механическую прочность.
8. Синтетическая функция. Многие неорганические ионы используются в синтезах сложных молекул. Например, ионы йода I¯ участвуют в синтезе йодтиронинов в клетках щитовидной железы; анион (SО4)2- - в синтезе эфиросерных соединений (при обезвреживании в организме вредных органических спиртов и кислот). Важное значение в механизме защиты от токсического действия пероксида имеет селен. Он образует селеноцистеин - аналог цистеина, в котором вместо атомов серы атомы селена. Селеноцистеин является составной частью фермента глутатион-пероксидазы, катализирующей восстановление пероксида водорода глутатионом (трипептид - γ-глутамил-цистеинилглицин)
Важно отметить, что в известных пределах возможна взаимозаменяемость некоторых ионов. При недостатке какого-то иона металла он может заменяться ионом другого металла, близким по физико-химическим свойствам и ионному радиусу. Например, ион натрия замещается ионом лития; ион кальция - ионом стронция; ион молибдена - ионом ванадия; ион железа - ионом кобальта; иногда ионы магния - ионами марганца.
Благодаря тому, что минеральные вещества активируют действие ферментов, они влияют на все стороны обмена веществ. Рассмотрим, в чём выражается зависимость обмена нуклеиновых кислот, белков, углеводов и липидов от наличия тех или иных неорганических ионов.
Минеральные вещества и обмен нуклеиновых кислот
Как уже было сказано выше, катионы металлов принимают непосредственное участие в поддержании вторичной и третичной структур ДНК и РНК. В частности, это катионы Fe2+, Mn2+, Cu2+, Zn2+, Co2+,Ni2+. Предполагают, что стабилизация структур нуклеиновых кислот достигается благодаря возникновению межмолекулярных сшивок через ионы металлов. Аналогично этому ионы металлов принимают участие в построении нуклеопротеидов, связывая молекулы белков и нуклеиновых кислот.
Большинство ферментов обмена нуклеиновых кислот являются металлозависимыми. Особенно велика роль Мg2+ , он активирует действие более 10 ферментов нуклеинового обмена. Ионы Са2+ и Ва2+ увеличивают, a Zn2+ уменьшает активность рибонуклеазы. Распад ДНК под действием дезоксирибонуклеазы усиливается в присутствии Мn2+, Са2+, Fe2+ и Со2+. Ионы Мn2+ активируют фосфодизстеразы, ионы Мо6+ усиливают, а ионы меди тормозят действие ксантиноксидазы.
Интересна роль бора в обмене нуклеиновых кислот. При его отсутствии сильно тормозится биосинтез нуклеиновых кислот и усиливается их распад вследствие повышения активности рибонуклеазы. Полагают, что влияние бора связано с его участием в окислительном фосфорилировании и синтезе нуклеозидтрисросфатов - исходных веществ для биосинтеза нуклеиновых кислот.
Минеральные вещества и обмен белков
Распад и синтез белков зависят от ряда неорганических ионов. Ионы Mn2+, Fe2+, Со2+, Zn2+, Ni2+ повышают активность пептидгидролаз и аргиназы, т.е. способствуют деструкции белков. Биосинтез белков идёт при участии ионов Мg2+ и Мn2+. Ион магния необходим для протекания реакции активации аминокислот и поддержания целостности рибосом.
Ион Мn2+ обеспечивает осуществление аминоацилтрансферазной реакции при сборке полипептидной цепи. В процессах обмена аминокислот важную роль играют ионы Со2+, Мg2+, Мn2+, Fe2+ и др.
Минеральные вещества и обмен углеводов и липидов
В процессе обмена углеводов огромное значение имеют ионы Мg2+: они активируют большинство ферментов гликолиза. В ряде случаев они могут быть заменены ионами марганца. Одна из основных реакций гликолиза - окисление З-фосфоглицеральдегида - протекает при участии Zn2+ . Ионы Са2+ имеют огромное значение для поддержания структуры фермента амилазы, необходимого при переваривании углеводов.
Образование углеводов в процессе фотосинтеза невозможно без участия ионов Mg2+, Mn2+, Fe2+, Сu2+, In3+, Со2+, В3+.
Распад липидов активируется ионами Са2+, так как эти ионы усиливают действие ферментов: липазы, фосфолипаз, липопротеинлипаз. Процессы - β-окисления ацил-КоА идут активнее в присутствии ионов Сu2 + и Fe2+, а при синтезе ацетил-КоА, фосфохолина и холинфосфатидов необходим Мg2+.
Заключительный этап распада углеводов и липидов - Цикл Кребса осуществляется при участии Мn2+, который активирует почти все ферменты цикла Кребса. Аналогично в некоторых случаях могут действовать Mg2+,Co2+ и Zn2+.
14.4. Регуляция минерального обмена
Многие минеральные вещества, поступая в живой организм, образуют там специфические соединения и в таком виде задерживаются и накапливаются в организме. Причём концентрирование элементов в живой природе видоспецифично и наследственно. Так, например, свыше 150 растительных видов накапливают литий, плауны - АI, водоросли - йод (в виде производных тирозина), обыкновенный мухомор - селен (в виде Se - цистеина) и т.д. Макроэлементы Са и Р у высших животных и человека образуют фосфат кальция - основу костной ткани. Сера в большом количестве входит в состав органических соединений (HS - группы аминокислот, пептидов и белков, SO3H группы в гетерополисахаридах). Фосфор также накапливается в виде органических соединений (фосфорные эфиры, фосфопротеиды и др.). Мg, К, Na существуют в организме в ионной форме, нейтрализуясь анионами СI, фосфата, гидрокарбоната. Мg и Fe содержатся в составе хлорофилла и гемоглобина. Микроэлементы, как правило, вступают во взаимодействие с белками и нуклеиновыми кислотами. Минеральные вещества, безполезные для организма, чаще всего не усваиваются. Например, кремнекислоты, содержащиеся в кормовой зелёной массе, совершенно не усваиваются животными.
Обмен ряда минеральных веществ протекает очень энергично. Это особенно ярко проявляется, когда элемент выводится из организма в составе какого-либо нормального продукта жизнедеятельности. Например, у млекопитающих большие количества Са и Р выводятся в процессе лактации. Характерной особенностью обмена минеральных веществ является, с одной стороны, взаимозаменяемость ряда из них (о чём уже говорилось) и антагонизм действия - с другой. Так, в ферментативных процессах, там где К+, NH4+ или Rb+ - активаторы, Na+, Li+ или Cs+ - ингибиторы. В таких же отношениях находятся Мg2+ и Са2+, Мn2+ и Zn2+ и т.д.
Минеральные вещества относятся к незаменимым пищевым факторам. Хотя и возможна относительная взаимозаменяемость некоторых минеральных веществ, но невозможность их взаимопревращений в организме является причиной незаменимости этих веществ. Суточная потребность взрослого человека в отдельных минеральных веществах сильно колеблется: от нескольких граммов (макроэлементы) до нескольких миллиграммов или микрограммов (микро- и ультрамикроэлементы) (табл. 19).
Таблица 19. Средняя потребность взрослого человека в главных минеральных веществах
| Минеральные вещества | Суточная потребность | Минеральные вещества | Суточная потребность |
| Вода | ≈2л | NaCI | ≈10 г |
| Кальций | 0,8-1 г | Фосфор | 1- 1,5 г |
| Калий | 2,5-5г | Магний | 0,3-0,5 г |
| Железо | 15 мг | Цинк | 10 -15 мг |
| Марганец | 5-10 мг | Медь | 2 мг |
| Молибден | 0,5 мг | Селен | 0,5 мг |
| Иод | 0,1-0,2 мг | | |
Регуляция минерального обмена осуществляется центральной нервной системой по принципу «плюс-минус» межгормональных взаимоотношений (см. главу 16). Обмен главных минеральных веществ (воды, ионов натрия, калия, хлора, гидрокарбонат-ионов, фосфат-ионов и др.) регулируется главным образом действием гормонов надпочечников, а именно минералокортикоидов.
