Основы биологической химии предисловие
 Скачать 7.85 Mb. Скачать 7.85 Mb.
|
|
Глава 6. Ферменты Как известно, важнейшим свойством любого живого организма является обмен веществ, ключевую роль в процессах которого играют ферменты или энзимы, которые по образному выражению И.П. Павлова, есть истинные двигатели всех жизненных процессов. Ферменты - это катализаторы белковой природы, вырабатываемые живой клеткой и ускоряющие протекание химических реакций внутри самой клетки и, будучи извлеченными из нее, вызывают те же реакции вне организма. Ферменты обеспечивают осуществление таких важнейших процессов жизнедеятельности, как реализация наследственной информации, биоэнергетика, синтез и распад биомолекул. Этим объясняется особое внимание, уделяемое исследованию ферментов. Учение о ферментах (энзимология) традиционно занимает ведущее место в биохимии, а сами ферменты являются наиболее изученным типом белков. Многие свойства, характерные для всех белков, вначале были изучены на ферментах. Изучение ферментов имеет огромное значение для любой фундаментальной и прикладной области биологии, а также для многих отраслей химической, пищевой и фармацевтической промышленности, занятых приготовлением катализаторов, антибиотиков, витаминов и других биоактивных веществ. 6.2. Химическая природа и структура ферментов Подобно другим белкам ферменты имеют большую молекулярную массу - от десятков тысяч до нескольких миллионов дальтон и четыре уровня структурной организации: первичный, вторичный, третичный и четвертичный. Большинство ферментов обладают четвертичной структурой. По своему строению ферменты, как и все белки, делят на простые (ферменты-протеины) и сложные (ферменты-протеиды, или холоферменты). Холоферменты состоят из белковой части - апофермента и небелковой - кофактора. Различают две группы кофакторов: ионы; металлов и коферменты, представляющие собой низкомолекулярные органические вещества. Небелковый компонент - кофактор в сложных ферментах, как правило, составляет незначительную часть от всего фермента. Следует отметить, что апофермент и кофактор порознь мало активны или вообще неактивны, только их комплекс - холофермент проявляет каталитические свойства. Примерами простых ферментов являются пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и другие. Большинство природных ферментов - сложные белки. В трехмерной структуре и простых, и сложных ферментов с функциональной точки зрения различают ряд участков, среди которых главными являются активный центр и аллостерический (регуляторный) центр. Активный центр - участок, с которым связывается субстрат (вещество, превращающееся под действием фермента). Обычно активный центр фермента образуют 12-16 остатков аминокислот, в состав активного центра холофермента входит также кофактор. В активном центре различают контактный участок, связывающий субстрат, и каталитический участок, где происходит превращение субстрата после его связывания. Однако это деление условно, так как связывание субстрата в контактном участке влияет на специфичность и скорость превращения его в каталитическом участке. У простых ферментов роль функциональных групп контактного и каталитического центра выполняют только боковые радикалы аминокислот. У сложных ферментов главную роль в этих процессах выполняют кофакторы. Они могут быть или прочно связаны с активным центром фермента, или могут легко отделяться от него при диализе. В первом случае кофакторы часто называют простетической группой, подобно тому, как это принято для небелковой части неферментных белков. Но абсолютной разницы между простетической группой и кофактором нет, так как одни и те же соединения или ионы металлов могут быть и кофактором, и простетической группой в различных ферментах. Кроме активного центра у ферментов имеется регуляторный, или аллостерический центр, который пространственно разделен с активным центром. Аллостерическим (от греческого alios - иной, чужой) он называется потому, что молекулы, связывающиеся с этим центром, по строению (стерически) не похожи на субстрат, но оказывают влияние на связывание и превращение субстрата в активном центре, изменяя его конфигурацию. Молекула фермента может иметь несколько аллостерических центров. 6.3. Кофакторы ферментов Ионы металлов как кофакторы ферментов Примерно треть всех известных ферментов является металлозависимыми. Роль металлов в этих ферментах различна. Металлоферменты делятся на следующие группы и подгруппы: 1. Ферменты, где ионы металлов выполняют роль активаторов (эти ферменты катализируют и без металла, но их активность снижается). 2. Ферменты, где ионы металлов выполняют роль кофактора (без ионов металлов эти ферменты неактивны): 2.1) диссоциирующие металлоферменты - (ион металла легко диссоциирует от апофермента); 2.2) недиссоциирующие металлоферменты - металлопротеиды: В роли кофактора могут выступать ионы различных металлов, чаще всего это ионы Mg2+, Мп2+ ,Zn2+, Fe2+, Сu2+, Са2+, Со2+, Мо6+ , K+. Существует несколько вариантов участия ионов металла в работе фермента. В большинстве случаев ноны металлов вступают в непрочную связь с апоферментом, способствуя формированию каталитически активной третичной и четвертичной структуры апофермента. Стабилизация возможна за счет образования солевых мостиков между ионом металла и карбококсильными группами кислых аминокислот при формировании третичной структуры или между субъединицами при образовании четвертичной структуры. К числу таких ионов относятся Mg2+, Мn2+ , Zn2+, Са2+ и другие. Например, ионы кальция стабилизируют третичную и четвертичнyю структуры α-амилазы, а ионы цинка - алкогольдегидрогеназы; макромолекулы этих ферментов в результате становятся устойчивыми по отношению к пептигидролазам желудочно-кишечного тракта. В составе металлопротеидов содержатся, как правило, металлы с переменной валентностью (железо, медь, кобальт, молибден). Наиболее многочисленны металлопродеиды класса оксидоредуктаз (катализ реакций окисления - восстановления). Ионы металлов в этих ферментах сами участвуют в транспорте электронов, то есть выполняют функцию каталитического участка. Классическим примером ферментов этого типа служат цитохромы (см. главу 9). Наконец, многие ионы металлов (Mg2+, Мn2+ , Zn2+ и другие) активно участвуют в ферментативном катализе, связывая либо субстрат и фермент, либо кофермент с апоферментом. Примером первого случая может служить образование тройного фермент - металл - субстратного комплекса при действии аргиназы, петигидролаз, карбоксилаз и других ферментов. Примером второго рода является присоединение флавинового кофермента к апоферменту с помощью ионов железа, молибдена, меди и цинка. Коферменты Многие коферменты являются производными витаминов и витаминоподобных веществ, табл.7 (см. главу 7). Поэтому недостаточное поступление витаминов с пищей сразу сказывается на синтезе коферментов, и, как следствие, нарушаются функции соответствующих ферментов и обмен веществ в целом. Таблица 7. Важнейшие коферменты и витамины, входящие в их состав
Существует менее многочисленная группа коферментов, называемых невитаминными. Этопроизводные нуклеотидов, моносахаридов, металлопорфиринов и некоторых пептидов. Реакция образования холофермента Обратима: кофермент + апофермент <=> холофермент. В условиях живой клетки это равновесие иногда сильно смещено влево, и кофермент присоединяется к апоферменту вместе с субстратом в момент реакции. Другой крайний случай - стабильные холоферменты, содержащие прочно связанный кофермент, который в данном случае можно назвать простетической группой. Такие ферменты являются сложными белками. Необходимое и самое важное условие образования холофермента состоит в том, что структура кофермента должна быть комплементарна центру связывания апофермента. 6.4. Механизм действия ферментов Механизм действия ферментов-протеидов и ферментов-протеинов однотипен и заключается в том, что ферменты ускоряют биохимическую реакцию за счет понижения ее энергии активации (рис 15). По современным представлениям в ходе ферментативной реакции выделяют ряд этапов: 1) диффузия молекулы субстрата к ферменту и стерическое связывание его с активным центром фермента; 2) преобразование первичного промежуточного комплекса в один или более активированный фермент; 3) отделение конечных продуктов реакции от фермента и диффузия их в окружающую среду. 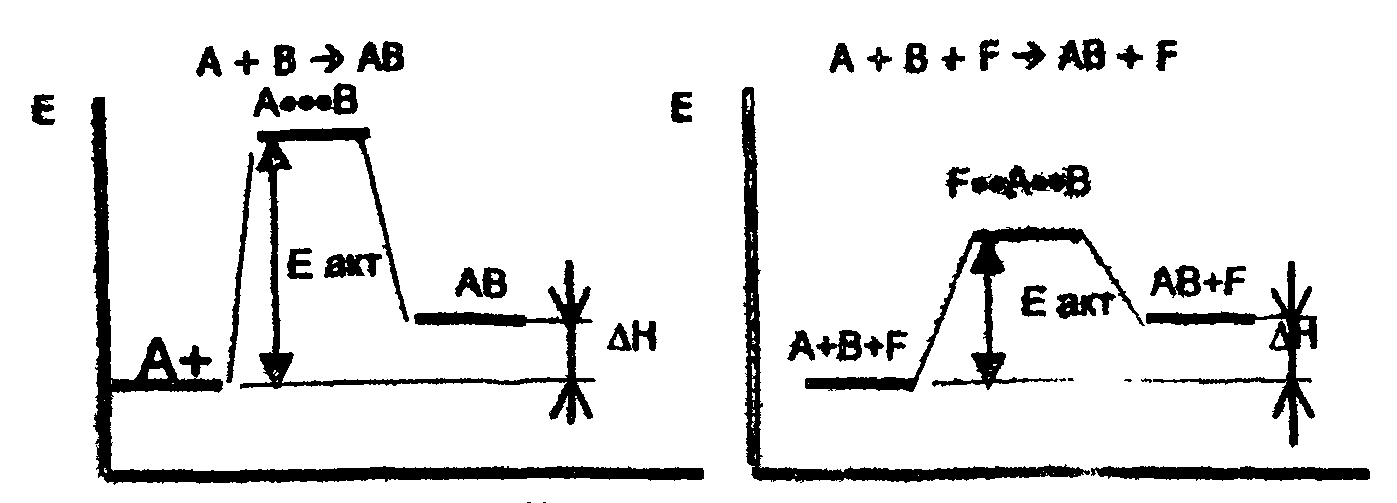
Рис.15. Схемы реакций анаболизма (синтеза сложных молекул из более простых): а - реакция без участия фермента; б - реакция с участием фермента С - энергия; А···В - промежуточный комплекс; F···А···В - активированный фермет-субстратный комплекс; ΔН - тепловой эффект реакции, не зависит от участия катализатора Как видно из представленных схем, введение в химическую систему фермента способствует значительному понижению энергии активации реакции и тем самым обусловливает возрастание скорости реакции. Для реакции катаболизма (расщепление сложных молекул на простые компоненты): АВ → А + В можно составить следующие схемы: a)AB + F → ABF; б) ABF→ А + BF; (а+б+в): АВ + F → ABF → А + В + F. в) BF → В + F; 6.5. Свойства ферментов Ферменты, как и неферментные катализаторы, характеризуются следующими сходными свойствами: 1. Они остаются неизменными после реакции и могут вновь реагировать с новыми молекулами субстрата (хотя активность их может измениться под влиянием условий среды) до тех пор, пока по каким-либо причинам не разрушатся. 2. Они оказывают свое действие в ничтожно малых концентрациях. 3. Они лишь повышают скорость реакции и не оказывают влияния на величину константы равновесия. 4. Они катализируют только энергетически возможные реакции. Однако ферменты, являясь белками, имеют следующий ряд свойств, отличающийся от свойств небиологических катализаторов. 1. Ферменты "работают" в очень мягких условиях (низкая температура – температура тела, нормальное давление, близкое к нейтральному значению рН). Будучи белками, они очень чувствительны к сдвигам рН и к изменениям температуры, т.е. термолабильны. 2. Скорость ферментного катализа гораздо выше, чем небиологического, т.е. ферменты сильнее снижают энергию активации реакции, чем другие катализаторы, Так, например, гидролиз белка до аминокислот под действием неорганических катализаторов (кислот или щелочей) осуществляется при температуре 100° С и выше за несколько десятков часов. Этот же процесс при каталитическом участии ферментов (например, пепсина или трипсина) требует всего десятков минут и идет при температуре 30-40 °С. Другой пример: в организме человека ежесуточно распадается около 0,5 кг глюкозы до СО2 и Н2О; в отсутствии биокатализаторов для этого потребовалось бы примерно 10000 лет. Благодаря каталитическому действию ферментов, в живой природе с большей скоростью происходят реакции, выполнение которых в лабораторных условиях остается пока еще невозможным. 3. Ферменты обладают высокой специфичностью, что позволяет ферментам направлять обмен веществ в определенное русло. 4. В отличие от небиологических катализаторов активность ферментов можно регулировать. Это уникальное свойство ферментов позволяет изменять скорость превращения веществ в организме в зависимости от условий среды, т.е. приспосабливаться к действию различных факторов. 5. Скорость ферментативной реакции в отличие от небиологического катализа прямо пропорциональна концентрации катализатора-фермента. Остановимся на некоторых свойствах ферментов более подробно. 6.6. Специфичность действия ферментов Специфичность – главное и особое качество ферментов, отличающее их от других катализаторов. Сущность этого свойства заключается в том, что каждый фермент катализирует химическое превращение определенных веществ. Структура активного центра фермента комплементарна структуре его субстрата, вследствие чего данный фермент из множества веществ, имеющихся в живой клетке, присоединяет только свой субстрат. Это свойство называется субстратной специфичностью фермента. Например, структура активного центра фермента гистидазы комплементарна структуре аминокислоты гистидина, поэтому возможно образование фермент-субстратного комплекса гистидаза-гистидин; другие вещества, в том числе аминокислоты, не связываются гистидазой. Каждый фермент катализирует лишь одно из возможных химических превращений субстрата. Это свойство называется специфичностью пути превращения. Например, гистидаза и гистидиндекарбоксилаза, обладая одинаковой субстратной специфичностью, катализируют разные превращения гистидина. Субстратная специфичность бывает абсолютной и групповой. Абсолютная специфичность означает, что фермент катализирует превращение только одного субстрата. Например, фумараза катализирует только реакцию фумаровой кислоты с водой: 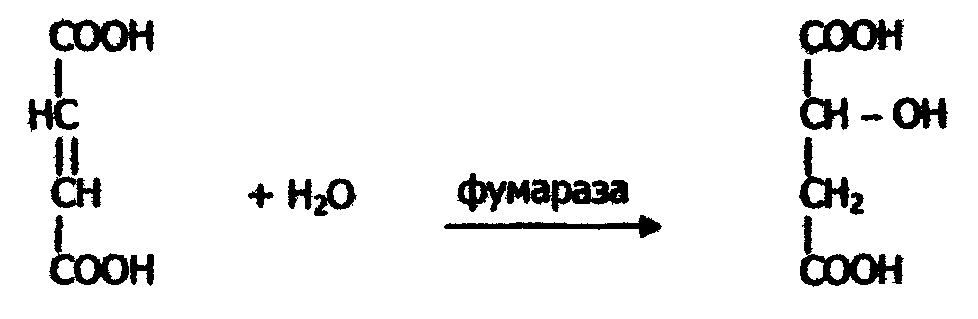
Ферменты с групповой специфичностью катализируют однотипные превращения сходных по строению веществ. Например, липаза ускоряет гидролиз различных жиров на глицерин и жирные кислоты: 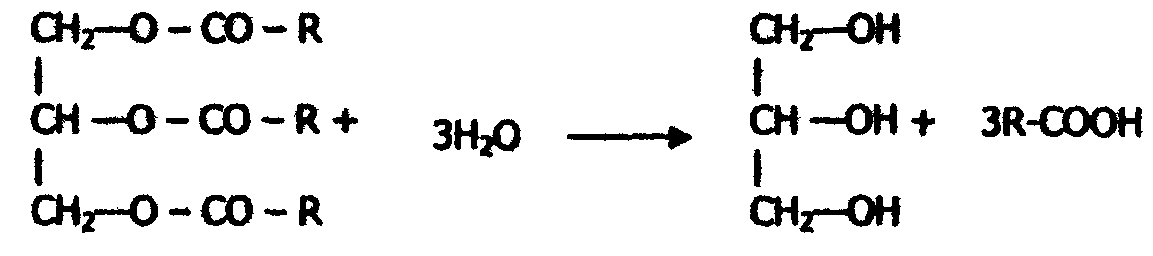
Кроме того, некоторые ферменты являются стереоспецифичными, то есть катализируют превращение только одного из стереоизомеров. Например, малеиновая кислота - цис-изомер фумаровой кислоты, не может быть субстратом фумаразы: 
6.7. Факторы, влияющие на скорость ферментативного катализа Скорость ферментативной реакции определяется количеством вещества, превращающимся в единицу времени, и зависит от температуры, рН среды, концентрации субстрата и фермента. Скорость ферментативной реакции является мерой активности фермента. Активность фермента можно измерить только косвенно: по количеству превращаемого субстрата или получаемого продукта реакции в единицу времени. Влияние температуры на активность ферментов Зависимость каталитической активности от температуры (термолабильность) для большинства ферментов выражается типичной кривой, представленной на рис.16. 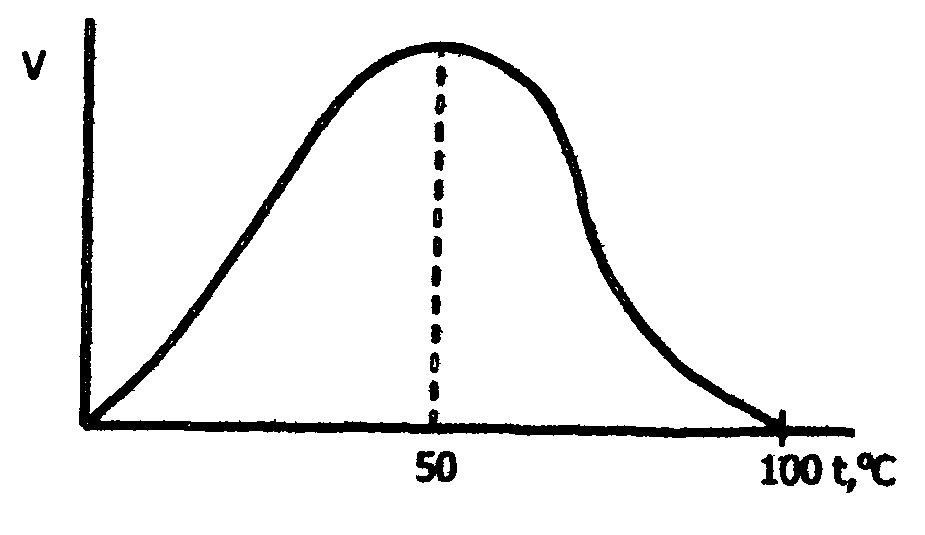 Рис. 16. Зависимость скорости ферментативной реакции от температуры Скорость ферментативных реакций, как и любых других, при повышении температуры на каждые 10 °С увеличивается примерно в 2-4 раза (правило Вант-Гоффа), но это правило справедливо лишь в области температур до 50-60°С. При температуре выше 50°С начинается денатурация фермента, что означает уменьшение его количества и соответственно снижается скорость реакции. При температурах 80-100°С почти все ферменты утрачивают свою активность (исключение составляет только один фермент мышечной ткани - миокиназа, который выдерживает нагревание до 100°С). Оптимальной для действия ферментов животного происхождения является температура 40-50°С, а для растительного - 50-60°С. Однако есть ферменты с более высокими оптимальными температурами, например, у папаина (фермента растительного происхождения, ускоряющего гидролиз белка) он равен 80°С. В то же время у каталазы (фермента, ускоряющего распад перекиси водорода до воды и О2 ) оптимальная температура действия находится между 0 и 10°С, а при более высоких температурах происходит инактивация ферментов. При температурах 0°С и ниже большинство ферментов не разрушается, но их активность стремится к нулю. Свойство термолабильности ферментов имеет важное значение для понимания процессов жизнедеятельности. При снижении температуры некоторые животные впадают в состояние спячки или анабиоза. При этом скорость ферментативных процессов уменьшается, что снижает расход накопленных организмом питательных веществ и замедляет обмен веществ. Искусственное охлаждение организма (гибернация) используется в клинике для проведения хирургических операций. Влияние рН на активность ферментов Зависимость скорости ферментативной реакции от концентрации водородных ионов носит колоколообразный характер (рис. 17). Каждый фермент имеет свой оптимум рН среды, при которой он максимально активен. Большинство ферментов имеет максимальную активность при физиологическом значении рН среды 6,0-8,0, однако некоторые ферменты хорошо работают или в кислой (пепсин), или в щелочной (аргиназа) среде. В табл. 8 приведены оптимумы рН ряда ферментов. Влияние изменения рН среды на молекулу фермента состоит в изменении степени ионизации кислотных и основных групп активного центра фермента, что сказывается на третичной структуре белка и соответственно на формировании активированного фермент-субстратного комплекса. Кроме того, имеет значение состояние ионизации субстрата и кофермента. Таблица 8 Оптимальное значение рН для некоторых ферментов
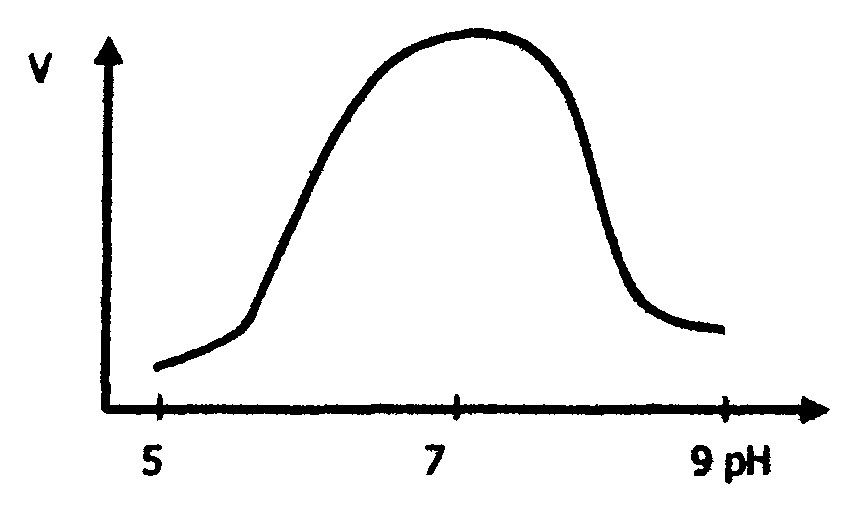 Рис. 17. Зависимость скорости ферментативной реакции от рН среды Значение оптимумов рН для разных ферментов важно для практической медицины. Например, пепсин, гидролизующий белки в желудке, активно работает только в сильнокислой среде (см. табл.8). Поэтому для восстановления нарушенной активности эндогенного пепсина необходимы вещества, повышающие кислотность. Так, препарат пепсина принимают с соляной кислотой, создающей нужный рН. Влияние концентраций субстрата и фермента на скорость ферментативной реакции Зависимость скорости ферментативной реакции от концентрации субстрата носит гиперболический характер (рис. 18). При постоянной концентрации фермента скорость реакции постепенно увеличивается достигая максимума; когда дальнейшее увеличение концентрации субстрата уже не влияет на скорость реакции, в этом случае говорят, что фермент насыщен, а субстрат в избытке. Зависимость скорости реакции от концентрации фермента (рис.18) является прямо пропорциональной; чем больше концентрация фермента, тем выше скорость реакции. 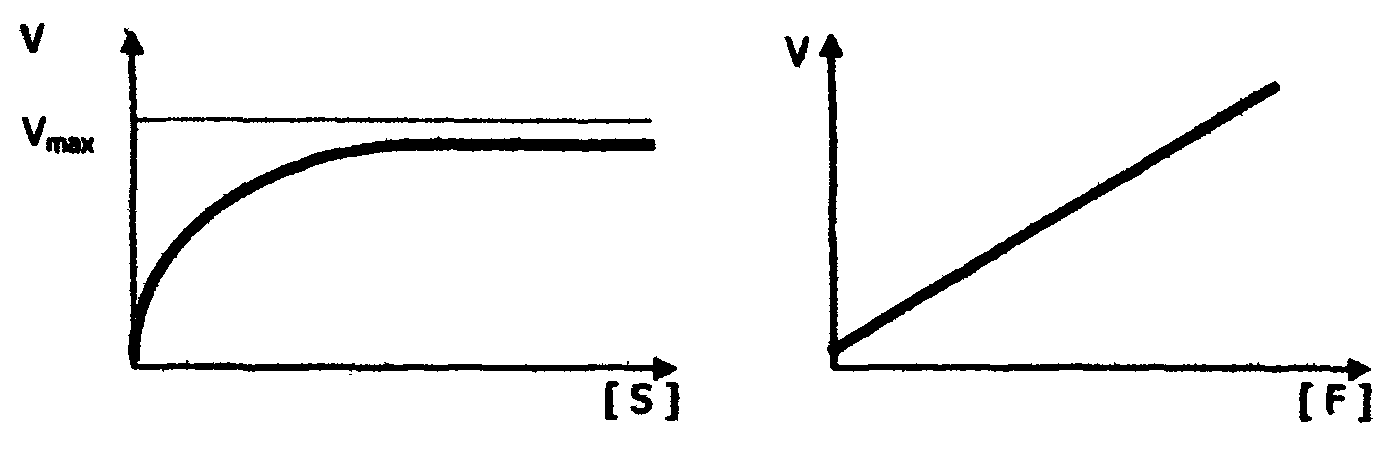
Рис. 18. Зависимость скорости ферментативной реакции от концентрации: а - субстрата; б - фермента Зависимость скорости реакции от времени Как известно, скорость любой химической реакции (активности фермента) уменьшается со временем (рис.19). Уменьшение скорости ферментативной реакции во времени может быть связано с рядом причин: - уменьшение концентрации субстрата; - увеличение скорости обратной реакции; - ингибирование фермента продуктом реакции; -денатурация фермента. 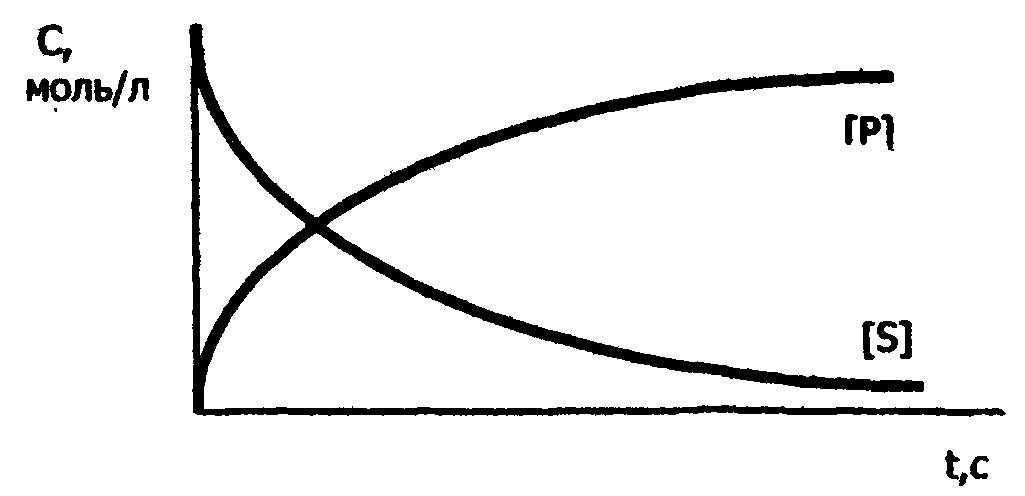 Рис.19. Зависимость скорости ферментативной реакции от времени ([Р] и [S] - концентрации продукта и субстрата) 6.8. Регуляция активности ферментов Регуляция активности ферментов может осуществляться путем взаимодействия с ними различных эндогенных биоактивных соединений или чужеродных веществ (например, лекарств и ядов). Под действием одних регуляторов (активаторов) ферментативная реакция может ускоряться, под действием других (ингибиторов) - замедляться. Активация ферментов В большинстве случаев активирующее действие на фермент оказывают вещества, влияющие на активный центр фермента. К таковым относятся кофакторы ферментов и субстраты. Таким образом, кофакторы являются не только обязательными структурными компонентами ферментов-протеидов, но и их активаторами. Кроме ионов металлов и коферментов активирующее влияние могут оказывать предшественники и активные аналоги коферментов, субстрат в известных пределах концентрации, некоторые органические и неорганические анионы. Так соляная кислота (анион СI¯ ) активирует действие пепсина, желчные кислоты - действие панкреатической липазы. Ингибирование ферментов Ингибиторы - вещества, тормозящие действие ферментов. Различают обратимое и необратимое ингибирование (инактивация). Примерами необратимого ингибирования является действие солей тяжелых металлов, йодацетата, синильной кислоты и др. В случае необратимого ингибирования молекула ингибитора вызывает стойкие, необратимые изменения или модификацию активного центра фермента. Чаще имеет место обратимое ингибирование, которое, в свою очередь, делят на конкурентное и неконкурентное. При конкурентном ингибировании ингибитор, обладая структурным сходством с субстратом, соединяется с ферментом, подменяя собой субстрат, конкурируя с ним. Так как часть фермента расходуется на образование комплекса фермент-ингибитор, то количество фермент-субстратного комплекса снижается, и падает скорость ферментативной реакции. Конкурентные ингибиторы, таким образом, подавляют активность только одного фермента или группы ферментов со сходным активным центром. Механизм конкурентного ингибирования можно выразить следующей схемой: F + S = FS = F + P; F + I = FI, где F - фермент; S - субстрат; I - ингибитор, Р - продукт. Если повышать концентрацию субстрата, то доля комплекса FS увеличивается, а комплекса FI уменьшается. При достаточно высокой концентрации субстрата весь фермент будет в форме комплекса FS, и скорость реакции будет максимальной, несмотря на присутствие ингибитора. В качестве примера конкурентного ингибирования рассмотрим торможение действия фермента холинэстеразы при помощи диизопропилфторфосфата, который является ингибитором также и других эстераз и пептидгидролаз, имеющих серии в активном центре. Холинэстераза - фермент, каталитически ускоряющий гидролиз ацетилхолина на холин и уксусную кислоту: 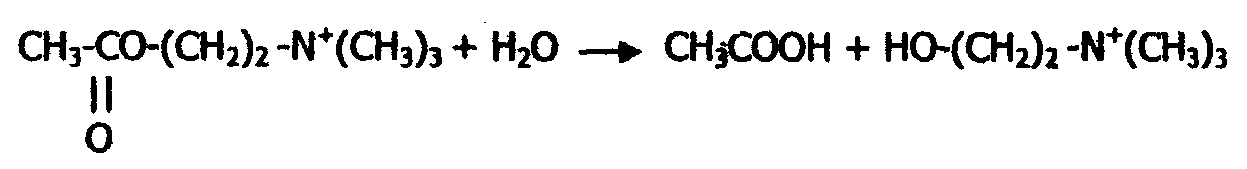
Реакция идет с большой скоростью: одна молекула холинэстеразы разлагает за одну минуту несколько миллионов молекул ацетилхолина. Этот процесс имеет огромное значение для нервной системы, так как ацетилхолин является промежуточным соединением в передаче нервного импульса. Действие холинэстеразы угнетается сильнейшим нервным ядом - диизопропилфторфосфатом, структура которого в некоторой части молекулы подобна структуре ацетилхолина: 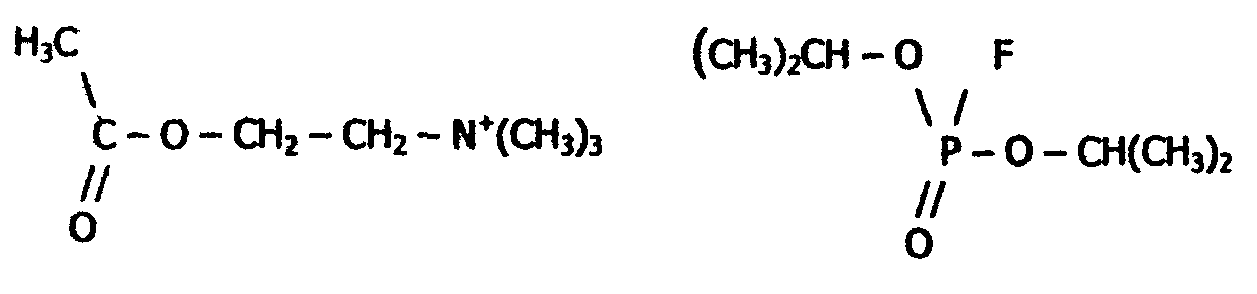
К активному центру холинэстеразы вместо группировки - ацетилхолина легко присоединяется группировка Примером конкурентного ингибирования служит также торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты (сукцината) в фумаровую: 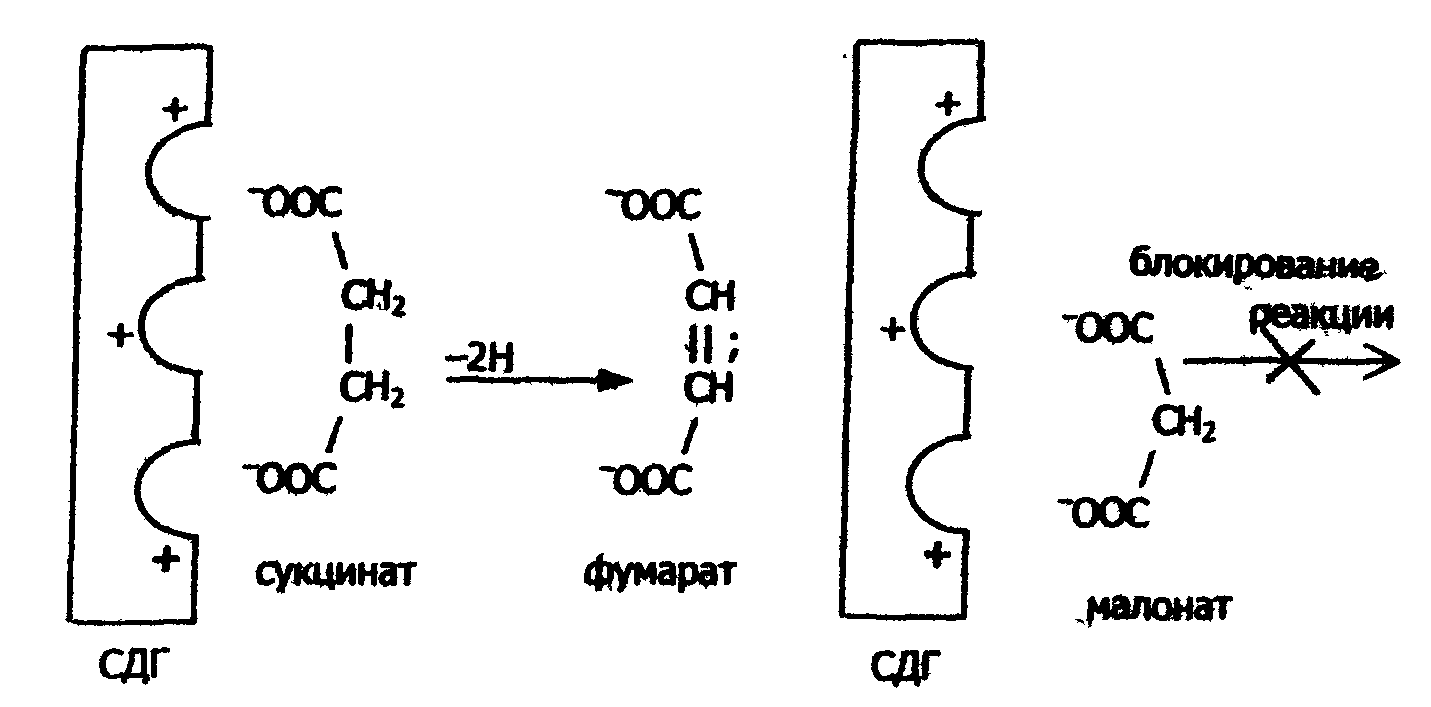 Малонат в результате структурного сходства с субстратом (сукцинат) реагирует с активным центром СДГ с образованием фермент–ингибитор -комплекса, однако при этом перенос водорода от малоната не происходит. Метод конкурентного торможения нашел широкое применение в медицинской практике. Например, для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты. Эти препараты имеют сходство с парааминобензойной кислотой, которую бактериальная клетка использует для синтеза фолиевой кислоты, являющейся составной частью ферментов бактерий. Благодаря этому структурному сходству, сульфаниламид блокирует действие фермента путем вытеснения параминобензойной кислоты из комплекса с ферментом, синтезирующим фолиевую кислоту, что ведет к торможению роста бактерий: 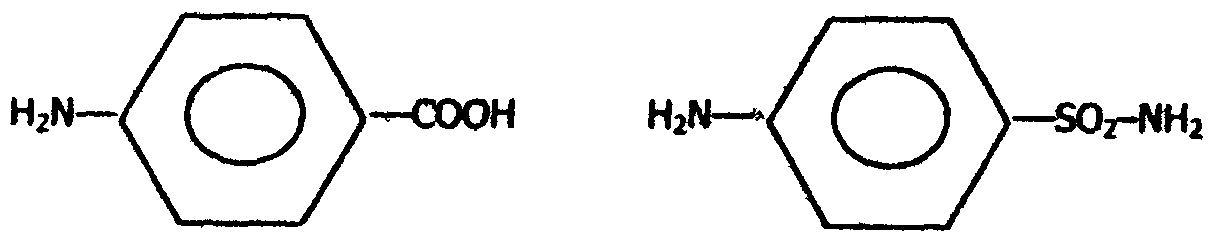
Некоторые аналоги витамина В6 и фолиевой кислоты, например, дезоксипиридоксин и аминоптерин, действуют как конкурентные коферментные ингибиторы (или антивитамины), тормозящие многие биохимические процессы в организме. Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами. При этом ингибитор влияет на каталитическое превращение, но не на связывание субстрата с ферментом. Неконкурентный ингибитор или связывается непосредственно с каталитическим участком активного центра, или, связываясь с ферментом в одном из аллостерических центров, изменяет конформацию активного центра таким образом, что затрагивает структуру каталитического участка. Так как неконкурентный ингибитор не влияет на связывание субстрата, то в отличие от конкурентного ингибирования наблюдается образование тройного комплекса по уравнению F + S +I→ FSI. Однако превращения этого комплекса в продукты реакции не происходит. Примером неконкурентного ингибирования может служить блокирование ферментов ионами тяжелых металлов (Hg , As , Pb, Cd ), которые присоединяются к сульфогидрильным (-SH) группам полипептидной цепи каталитического участка. Торможение солями синильной кислоты, угарным газом основано на том, что анионы СN¯ или молекулы СО прочно соединяются с трехвалентным железом, входящим в каталитический участок геминового фермента - цитохромоксидазы. Блокада этого фермента выключает дыхательную цепь, и клетка погибает. Снять действие неконкурентного ингибитора избытком субстрата (как действие конкурентного) нельзя, а можно лишь веществами, связывающими ингибитор. Эти вещества называют реактиваторами. Ионы тяжелых металлов лишь в небольших концентрациях являются неконкурентными ингибиторами. В больших концентрациях они выступают как инактиваторы (оказывают денатурирующее действие). Неконкурентные ингибиторы применяются как фармакологические средства, отравляющие вещества для борьбы с вредителями сельского хозяйства и в военных целях. Аллостерическая регуляций действия ферментов Многие ферменты с четвертичной структурой могут обратимо связывать по месту аллостерического (регуляторного) центра некоторые вещества, активирующие или ингибирующие фермент. Эти вещества называют аллостерическими эффекторами, в качестве которых могут выступать различные метаболиты, гормоны, ионы металлов, коферменты и очень редко - молекулы субстрата. Аллостерический ингибитор, комплементарно соединяясь с регуляторным центром, меняет его конформацию, что влечет за собой изменение конформации и каталитического участка (активного центра). Аллостерический активатор, напротив, облегчает превращение субстрата в активном центре фермента. В качестве примера аллостерической регуляции рассмотрим обратимое инактивирование фермента аденилатциклазы, катализирующей реакцию синтеза циклоаденозинмонофосфата (цАМФ) из АТФ по схеме: АТФ → цАМФ + Н4Р2О7 Эта реакция играет важную роль в системе регуляции передачи физиологического сигнала из внеклеточной среды внутрь клетки. Аллостерическими эффекторами аденилатциклазы являются некоторые гормоны (адреналин, глюкагон и др.). Аденилатциклаза локализуется в плазматической мембране и состоит из трех субъединиц: рецептора гормона, ГТФ-связывающего белка и каталитической субъединицы. Рецептор, гормона ориентирован центром связывания на наружную поверхность мембраны, а каталитическая субъединица своим активным центром выходит на внутреннюю сторону мембраны (рис.20). 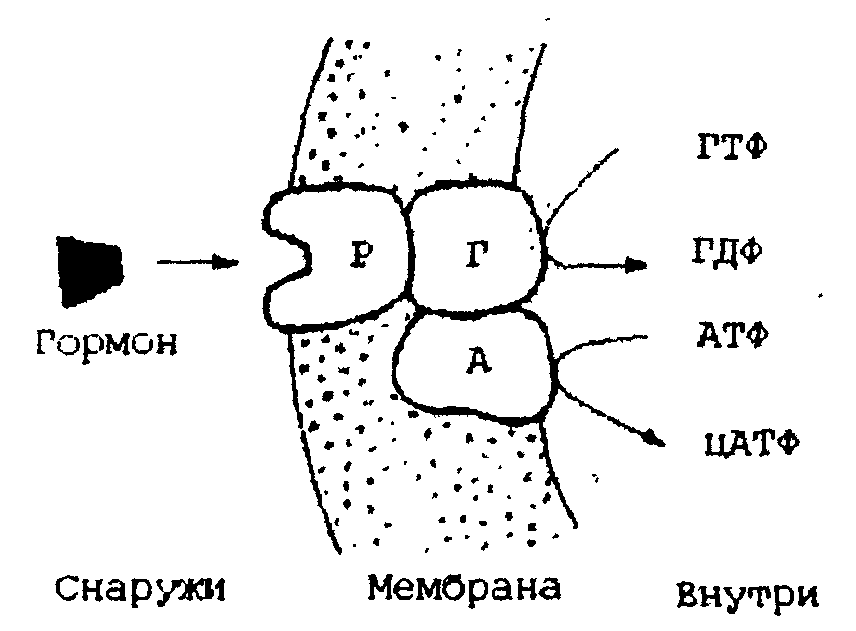 Рис. 20. Регуляция действия аденилатциклазы: Р - рецептор гормона; Г- ГТФ-связывающий белок; А- каталитическая субъединица аденилатциклазы Когда рецептор гормона свободен, ГТФ-связывающий белок, соединен с ГДФ, и в этом состоянии системы аденилатциклаза неактивна. Когда к рецептору присоединяется гормон ГДФ в белке заменяется на ГТФ, и этот новый комплекс «ГТФ-белок» активирует аденилатциклазу - начинается синтез цАМФ, активирующего другие ферменты внутри клетки. Таким образом, гормон - первый и внешний, а цАМФ - второй и внутриклеточный вестник сигнала. Активная аденилатциклаза усиливает, например, распад гликогена (см. главу 10) и подавляет его синтез, вызывает расслабление гладких мышц кровеносных сосудов и т.д. 6.9. Определение активности ферментов В основе всех методов определения активности ферментов лежит положение, согласно которому активность ферментов определяется количеством превращенного субстрата при определенных стандартных условиях: концентрации субстрата, температуре и рН среды. При определении активности фермента следует не забывать о том, что она резко меняется при различных условиях реакции. Различные методы количественного определения активности ферментов основаны на следующих принципах: 1) определяется наименьшее количество ферментного препарата, способного за определенный промежуток времени и при определенных условиях расщепить требуемое количество субстрата; 2) определяется остаток субстрата после воздействия фермента и затем рассчитывается количество субстрата, расщепившегося под действием определенного количества фермента; 3) активность фермента обозначают по времени, в течение которого определенная навеска фермента катализирует превращение определенной доли субстрата в стандартных условиях (начальная концентрация субстрата, температура, рН среды). Согласно правилам, рекомендованным в 1961 году Комиссией по ферментам Международного биохимического союза, за единицу фермента (Е) принимают такое его количество, которое катализирует превращение 1 мкмоль вещества (субстрата) за 1 минуту. Число единиц фермента в тканях определяют по формуле: Часто находят удельную активность фермента: она равна числу единиц фермента в образце, деленному на массу белка (в мг) в этом образце. Например, если в 1 грамме ткани печени содержится 140 единиц лактатдегидрогеназы и 200 мг белка, то удельная активность лактатдегидрогеназы в печени равна 140/200=0,7 (мкмоль/мин)/мг. Если имеется очищенный индивидуальный фермент, то можно измерить его молярную активность: она равна числу единиц фермента в образце, деленному на количество фермента в микромолях. Молярная активность указывает, сколько молекул субстрата превращается одной молекулой фермента за 1 минуту. Для правильного определения активности фермента необходимо проводить его в стандартных условиях, которые устанавливаются для каждого фермента из предварительных кинетических исследований, и точно измерять изменение содержания субстрата или продукта реакции за определенный, отрезок времени. Рекомендуется проводить определение активности фермента при температуре 25°С, оптимуме рН и концентрации субстрата, превышающей концентрацию насыщения. 6.10. Номенклатура и классификация ферментов До 1961 года не существовало единого подхода к образованию названий ферментов. Исторически возникшие (тривиальные) названия ферментов строились либо по названию субстрата с изменением суффикса на -аза (например, уреаза, гистидаза, аргиназа), либо по характеру действия, например, пепсин (от греческого «легкие» - пищеварение) или трипсин (от греческого «трипсис» - разжижаю) и так далее. В 1961 году на V Международном биохимическом конгрессе в Москве были разработаны и утверждены правила рациональной номенклатуры ферментов. Согласно этим правилам название фермента составляют из химического названия субстрата и названия той реакции, которая осуществляется ферментом. Если данная реакция сопровождается переносом группы атомов от одного партнера (субстрата) к другому (акцептору), то в название фермента включают еще и химическое наименование акцептора. Например, пиридоксальфермент, катализирующий реакцию переаминирования между L-аланином и 2-оксоглутаровой кислотой, должен называться L-аланин: оксоглутарат-аминотрансфераза: 
Названия ферментов по рациональной номенклатуре являются точными и содержательными, но очень длинными. Поэтому наряду с рациональными названиями до сих пор используются тривиальные названия ферментов. Классификация ферментов основана на типе катализируемой ферментом реакции. Все ферменты делятся на шесть главных классов, каждый из которых имеет строго определенный номер. Классы разделены на подклассы и далее на подподклассы. Название класса указывает тип химической реакции, катализируемой ферментом. Подкласс уточняет действие фермента, указывая в общих чертах на природу химической группы субстрата, атакуемой ферментом. Подподкласс ещё более конкретизирует действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора. 1. Оксидоредуктазы - ферменты, катализирующие окислительно-восстановительные реакции. Среди оксидоредуктаз различаются дегидрогеназы, катализирующие перенос водорода (протонов и электронов), и оксидазы, катализирующие окисление субстрата кислородом. К этому же классу относятся гемсодержащие ферменты каталаза и пероксидаза. Оксидоредуктазы очень распространенный класс, насчитывающий около 480 ферментов. Большую роль они играют в энергетических процессах. Название ферментов этого класса составляют по схеме: «донор: акцептор – оксидоредуктаза». 2. Трансферазы - ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов от одного субстрата (донора) к другому (акцептору). Сюда относятся аминотрансферазы, ацилтрансферазы, метилтрансферазы, фосфотрансферазы и другие. Трансферазы - примерно столь же обширный класс, как и оксидоредуктазы. Они участвуют в реакциях взаимопревращения различных веществ, синтезе мономеров, обезвреживании природных и чужеродных соединений. Названия ферментов этого класса строят следующим образом: "донор: транспортируемая группа - трансферазы''. 3. Гидролазы - катализируют реакции расщепления внутримолекулярных связей с присоединением воды по месту расщепления: А—В + Н-ОН →А—ОН + Н—В. К гидролазам относятся эстеразы - катализирующие реакции гидролиза и синтеза сложноэфирных связей (липаза, холинэстераза); пептидазы, или пептидгидролазы (пепсин, трипсин, карбоксипептидаза), расщепляющие пептидные связи; гликозидазы, гидролизующие гликозидные связи, и так далее. Класс гидролаз насчитывает около 460 ферментов. Гидролазами являются пищеварительные ферменты, ферменты лизосом и других органоидов клетки, где они способствуют распаду биополимеров на мономеры. Тривиальное название этих ферментов образуется добавлением к названию субстрата окончания - аза. Систематическое название получают по схеме: "субстрат - гидролаза". 4. Лиазы - катализируют разрыв связей С-О, С-С, C-N и обратимые реакции отщепления различных групп от субстратов негидролитическим путем, в результате чего происходит образование двойной связи или присоединяются группы по месту двойной связи. Примеры лиаз - декарбоксилазы (отщепляют СООН - группу от карбоновых кислот); альдолазы (расщепляют связь С-С с образованием альдегида); гидратазы (присоединяют воду по двойной связи); дегидратазы (отщепляют молекулу воды с образованием двойной связи); амидин-лиазы (отщепляют аминогруппу) и другие. Лиазы - менее распространенная группа ферментов (около 230), участвующие в реакциях синтеза и распада промежуточных продуктов обмена. Систематическое название составляется по схеме: "субстрат-лиаза". В тривиальных названиях указываются особенности участвующих в реакции групп атомов - карбоксилаза (присоединение карбоксильной группы), дегидратаза (отщепление молекулы воды). 5. Изомеразы - катализируют различные реакции изомеризации, которые можно разделить на две группы. Первая - реакции внутримолекулярного переноса групп; вторая - внутримолекулярные окислительно-восстановительные реакции. Первый тип реакций катализируют изомеразы, которые называют мутазами и которые являются внутримолекулярными трансферазами. Сюда относят внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы. Например, фосфоглицеромутаза превращает 3-фосфоглицериновую кислоту в 2-фосфоглицериновую кислоту: 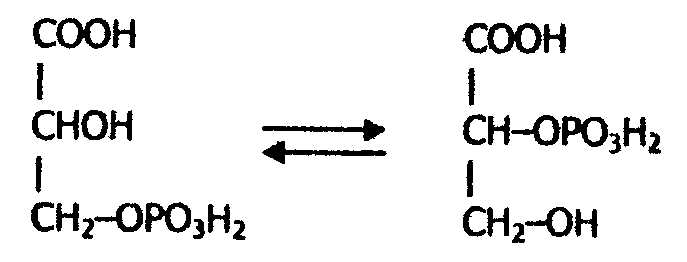 К первому типу относят также рацемазы и эпимеразы, действующие на амино- и оксикислоты; таутомеразы. Второй тип реакции изомеризации катализируют внутримолекулярный перенос кислорода или водорода, обеспечивающие взаимопревращение альдоз и кетоз. Например, триозофосфатизомераза катализирует взаимопревращение диоксиацетонфосфата и глицеральдегидфосфата. 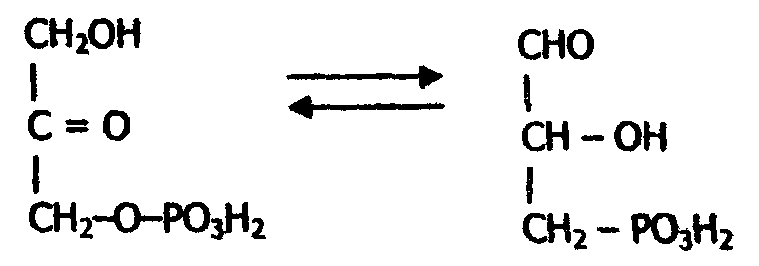 Изомеразы - небольшая группа ферментов (чуть более 80), играющая важную роль в восстановлении биологической активности молекул. Название этих ферментов складывается в зависимости от типа реакции по схеме: "субстрат - изомераза". 6. Лигазы (синтетазы) - катализируют синтез органических веществ из двух исходных молекул с участием какого-либо нуклеозид-трифосфата, при распаде которого освобождается необходимая для синтеза энергия. Ферментов этого класса насчитывается около 80. Систематическое название лигаз образуется по схеме: «Х:У-лигаза», где X и Y -исходные вещества. Например, L-глутамат: аммиак - лигаза (или тривиальное название глутаминсинтетаза). 6.11. Локализация ферментов в организме и клетке Большинство ферментов обнаруживается во всех клетках организмов. В плазме крови также содержатся ферменты, но их концентрация значительно ниже; чем в клетках. Ряд ферментов, необходимых для жизнеобеспечения и деления самих клеток, содержится в клетках всех органов и тканей. Но наряду с такого рода ферментами в клетках различных органов и тканей встречаются специфические ферменты. Например, уроканиназа содержится только в печени, гистидаза - в печени и коже, креатинфосфокиназа - в мышечных клетках, ферменты, синтезирующие стероидные гормоны, вырабатываются только клетками коры надпочечников и так далее. Клетка имеет сложное строение (рис. 21), в клетке любого органа и ткани можно обнаружить клеточную или плазматическую мембрану, ядро, митохондрии, лизосомы, рибосомы, систему канальцев и пузырьков - эндоплазматический ретикулум, пластинчатый комплекс, различные вакуоли, внутриклеточные включения и другие. Главную по массе недифференцированную часть цитоплазмы клетки составляет гиалоплазма, или цитозоль.  Рис. ЭУКАРИОТИЧЕСКИЕ КЛЕТКИ а. Растительные 10-100 мкМ; б. Животные 5-30 мкМ Внутри клетки, ферменты содержатся как в растворимой части цитоплазмы, так и в субклеточных структурах. Принадлежность различных ферментных систем определенным участкам клетки называется компартментализацией. Установлено, что в ядре локализованы РНК - полимеразы, катализирующие образование мРНК; ферменты, участвующие в репликации ДНК, и некоторые другие. В митохондриях находятся ферменты цепи биологического окисления (тканевого дыхания) и окислительного фосфорилирования; ферменты пируватдегидрогеназного комплекса, цикла трикарбоновых кислот и другие. В лизосомах в основном содержатся гидролазы, оптимально действующие при рН =5. В рибосомах обнаружены ферменты белкового синтеза, здесь происходит транслирование мРНК и связывание аминокислот в полипептидныё цепи с образованием молекул белка. В эндоплазматической сети локализованы ферменты синтеза лилидов и ферменты реакций гидроксилирования. Плазматическая мембрана содержит АТФ-азу, транспортирующую ионы Na+ и К+, аденилатциклазу и другие. В цитозоле локализованы ферменты гликолиза, пентозофосфатного цикла, синтеза жирных кислот и мононуклеотидов, активирования аминокислот, ферменты глюконеогенеза. 6.12. Применение ферментов Ферменты находят все более широкое применение в различных отраслях промышленности (хлебопечение, виноделие, сыроварение, пивоварение, кожевенное и меховое производство, кулинария и так далее). В настоящее время развивается новая отрасль - промышленная энзимология, которая использует выделенные из биологических объектов ферменты для получения продуктов питания из целлюлозы, нефти; синтеза ряда аминокислот, лекарственных препаратов; для создания промышленных штаммов микроорганизмов - источников витаминов и незаменимых аминокислот и так далее. Отдельной отраслью промышленной энзимологии является медицинская энзимология, которая развивается по трем главным направлениям. Первое - энзимопатология - исследует ферментативную активность в норме и при патологии. Многие наследственные болезни, как оказалось, являются следствием дефекта какого-либо фермента. Второе направление - энзимодиагностика. Ферменты используют в качестве избирательных реагентов для определения содержания химических веществ в крови, желудочном соке, моче и других физиологических жидкостях. Кроме того, выявляют и определяют количественное содержание самих ферментов прежде всего в сыворотке крови при патологии. Полученные данные используют для диагностики болезней и для контроля эффективности лечения. Установлено, например, что при диабете, злокачественном поражении поджелудочной железы, болезнях печени резко увеличивается уровень липазы, амилазы, трипсина, химотрипсина. При инфаркте миокарда - повышается уровень аминотрансфераз, креатинкиназы и лактатдегидрогеназы и так далее. Изменение содержания ферментов в клетках и за их пределами вследствие болезни называется энзимопатиями, которые бывают наследственные и приобретенные. Третье направление - энзимотерапия - использование ферментов в качестве лекарств. Например, при желудочных заболеваниях, сопровождающихся снижением содержания пепсина в желудочном соке, для улучшения пищеварения применяют пепсин и его производные. Нуклеазы используют при лечении некоторых вирусных заболеваний. Протеолитические ферменты используют очень часто для лечения тромбозов. Аспарагиназу применяют для лечения некоторых форм лейкозов. Она разрушает аспарагин, необходимый для роста лейкозных клеток и содержащийся в плазме крови; в результате лейкозные клетки погибают. Таким образом, очевидно, что развитие медицинской этимологии имеет огромнейшее значение для предупреждения, выявления и лечения различных заболеваний. |
