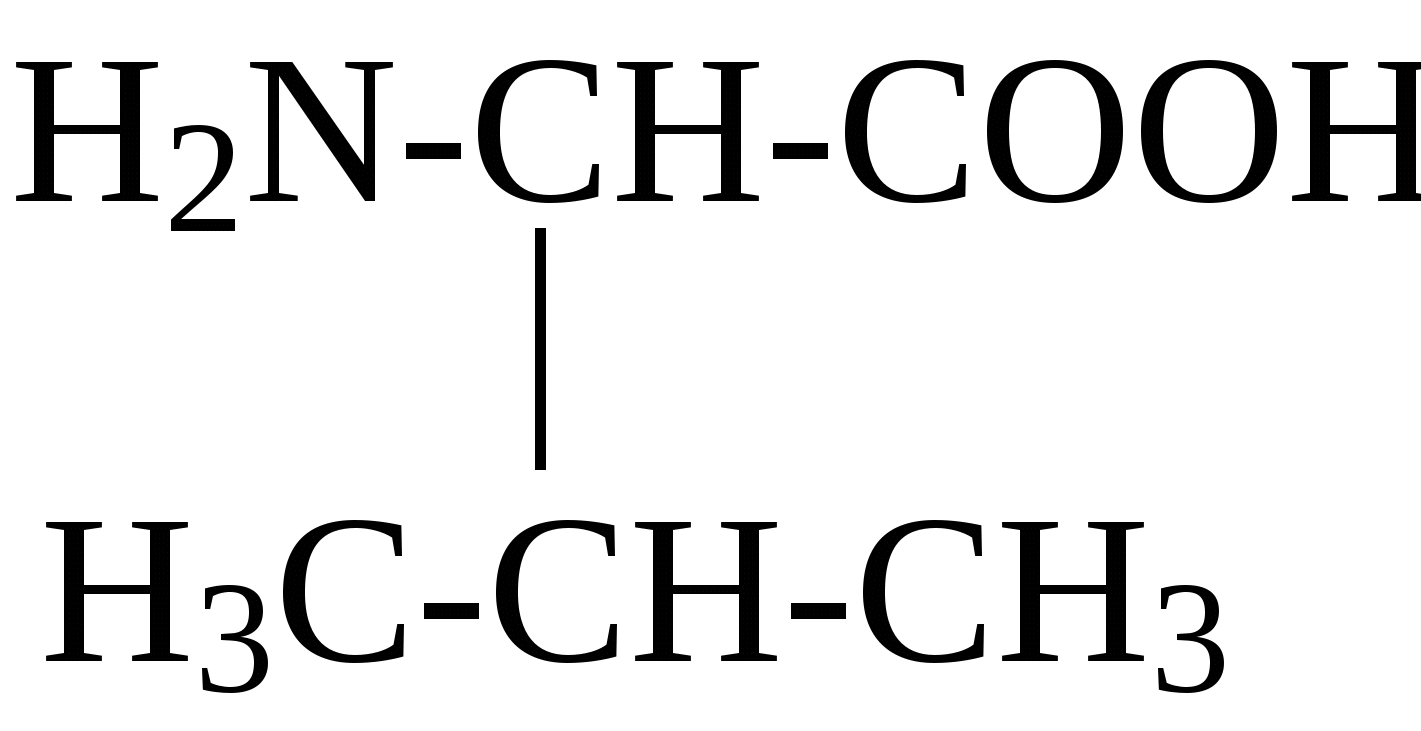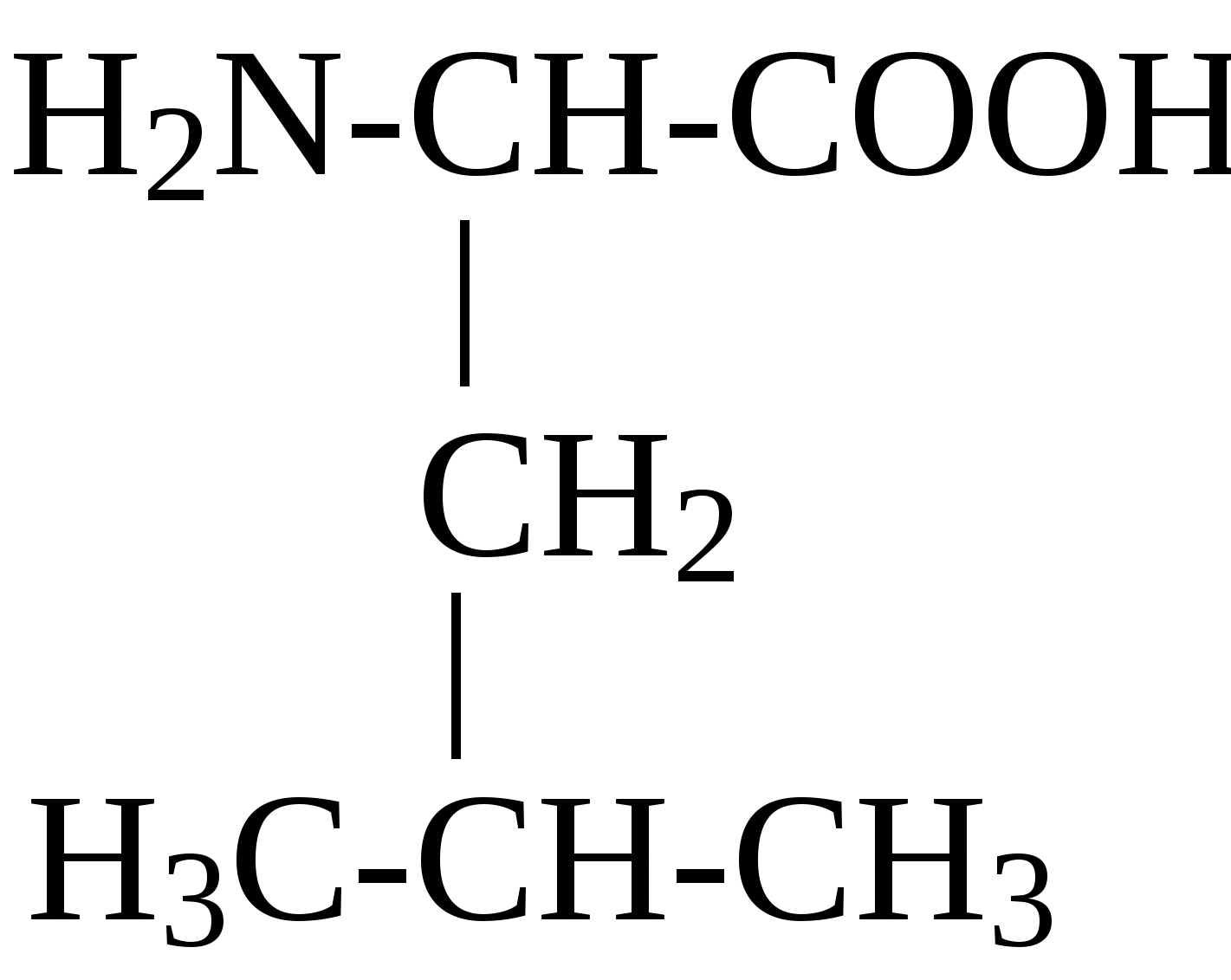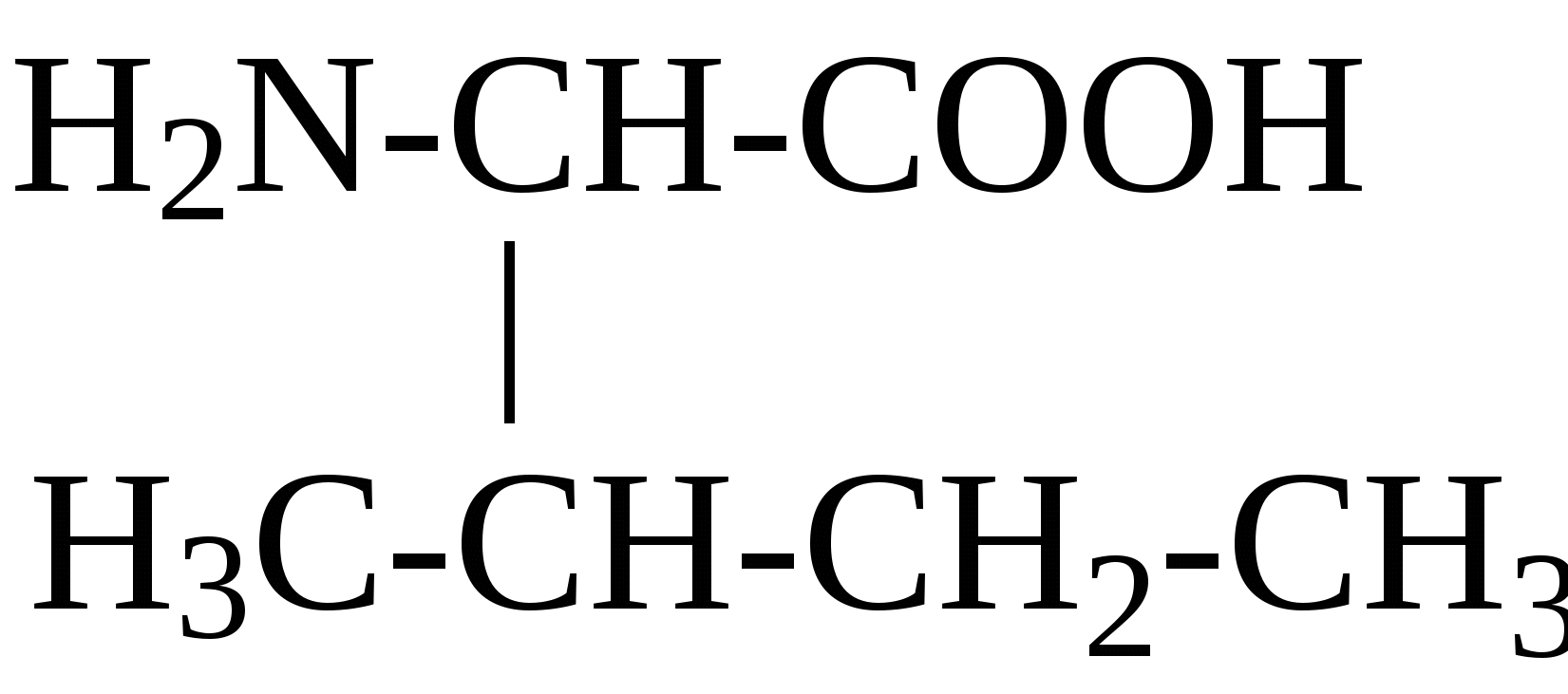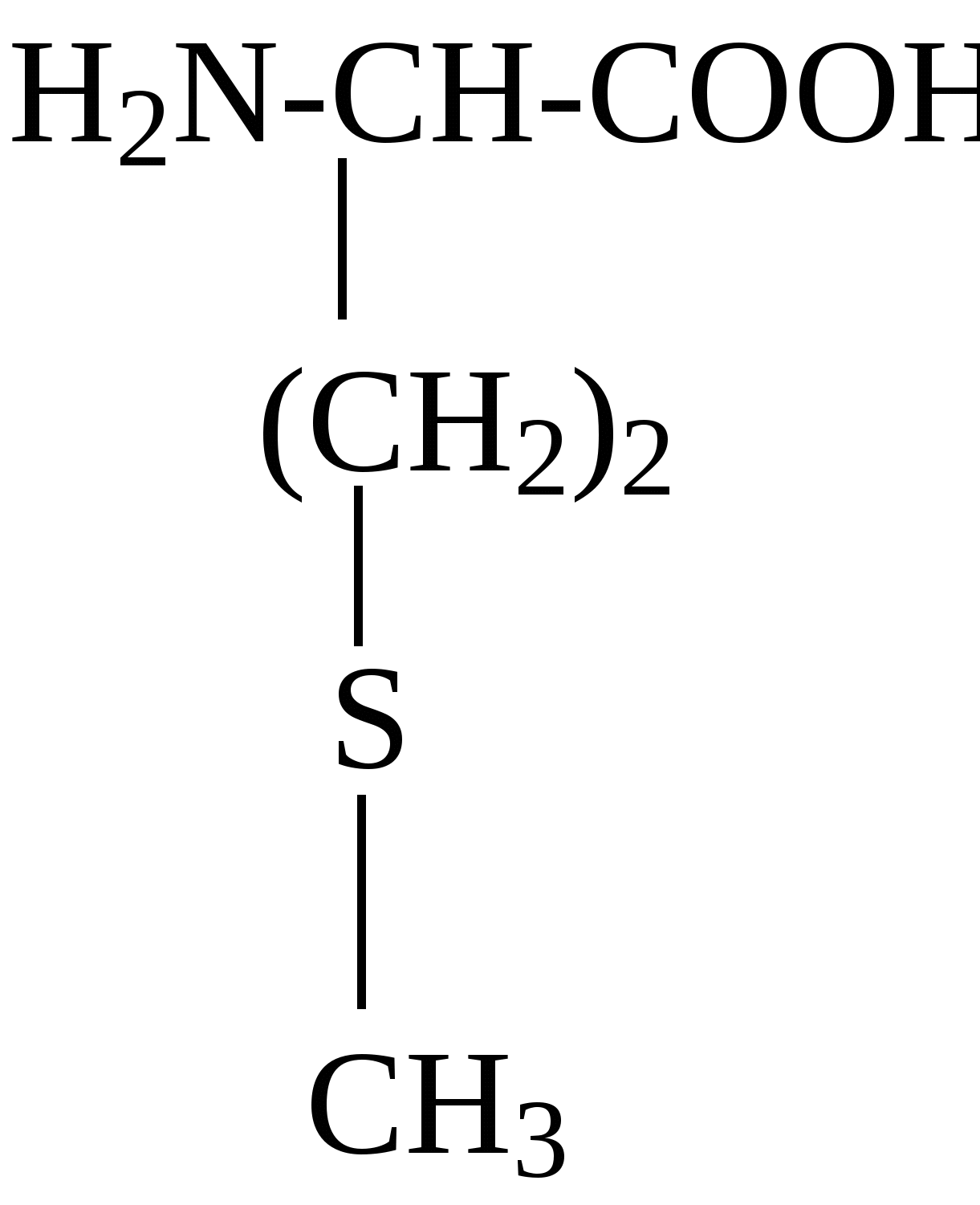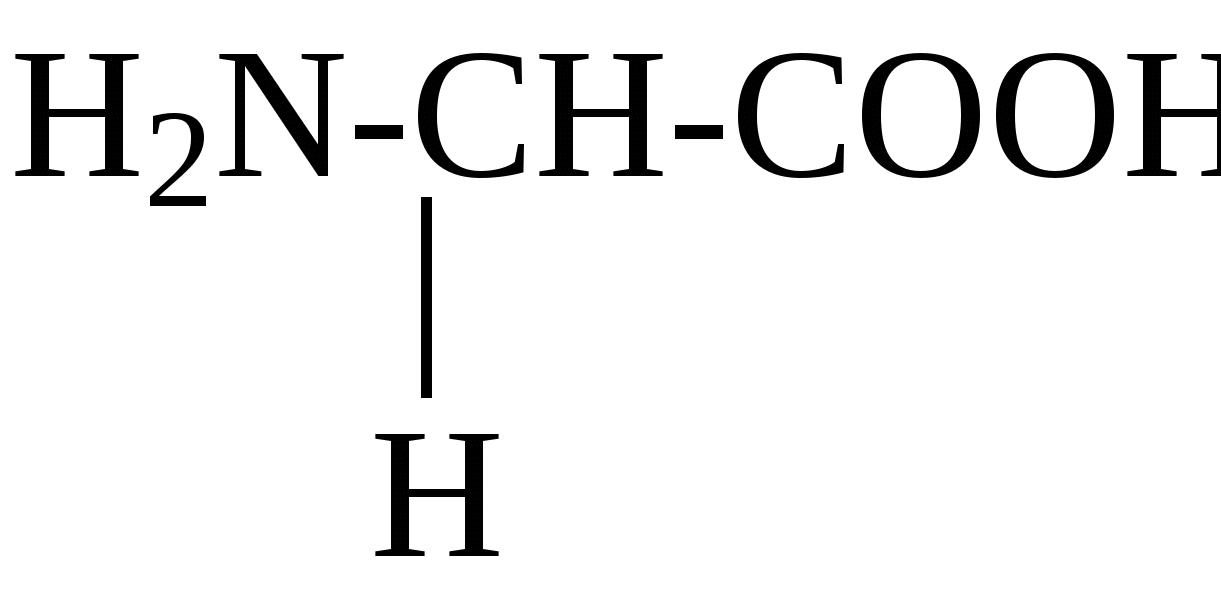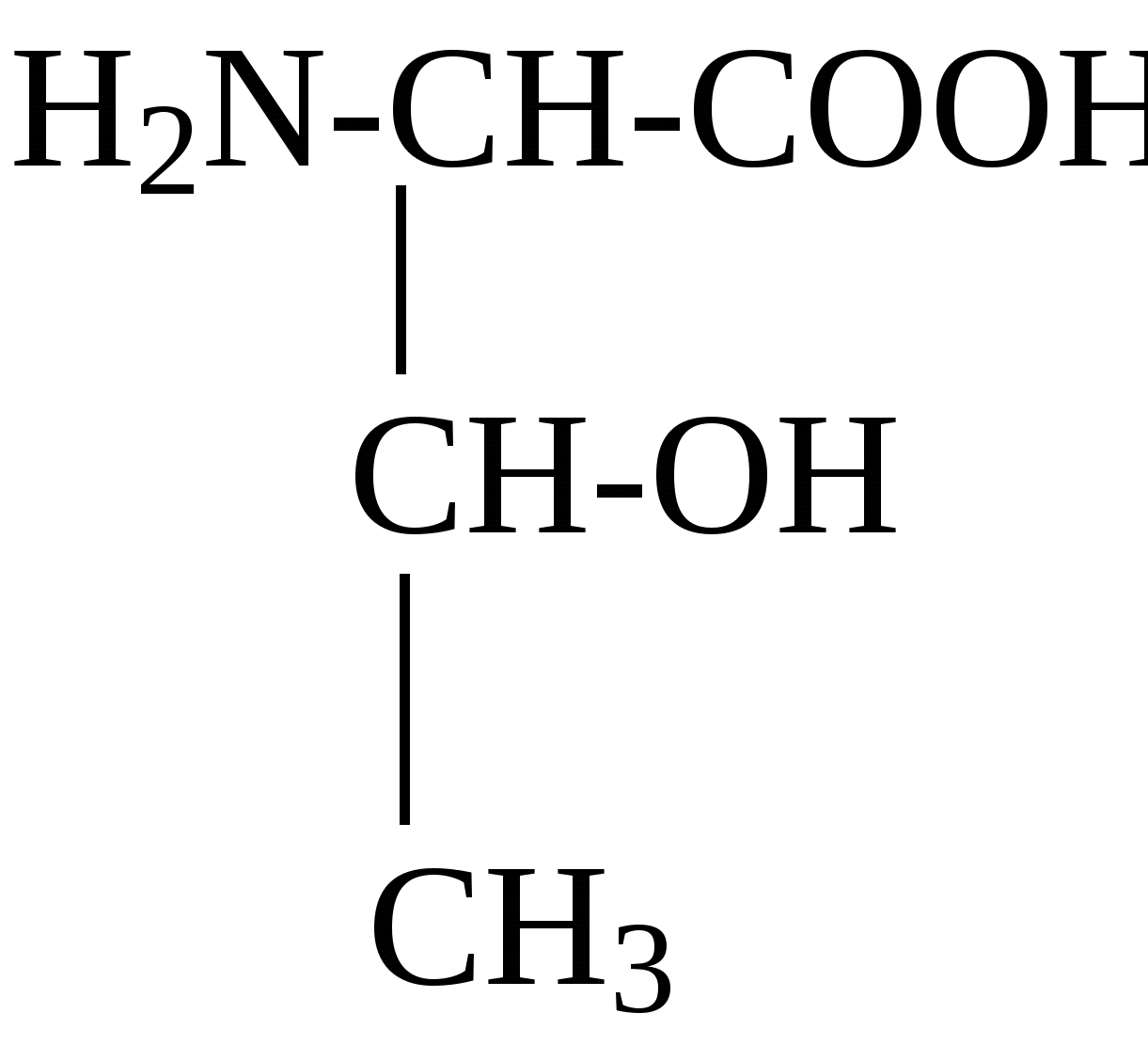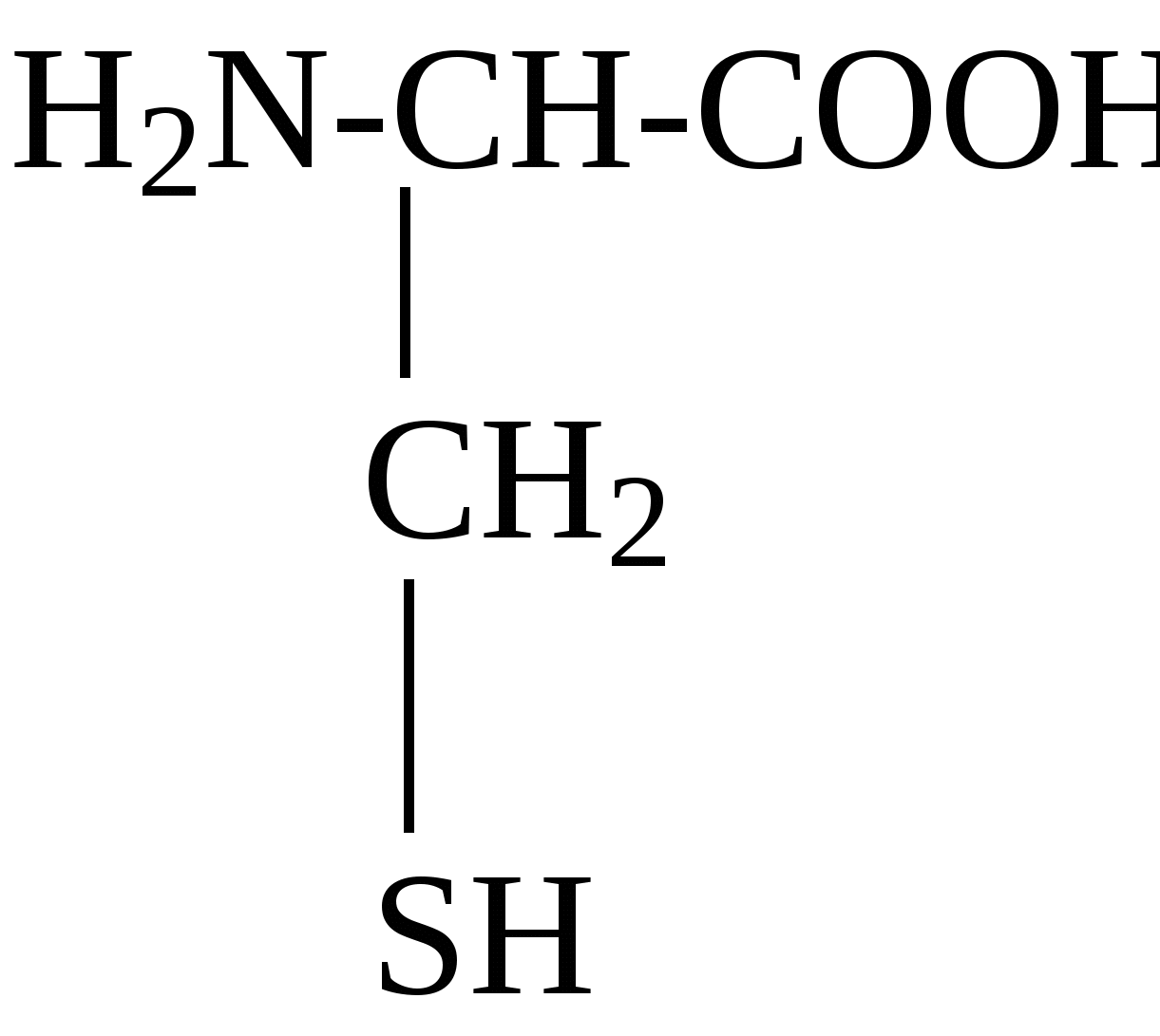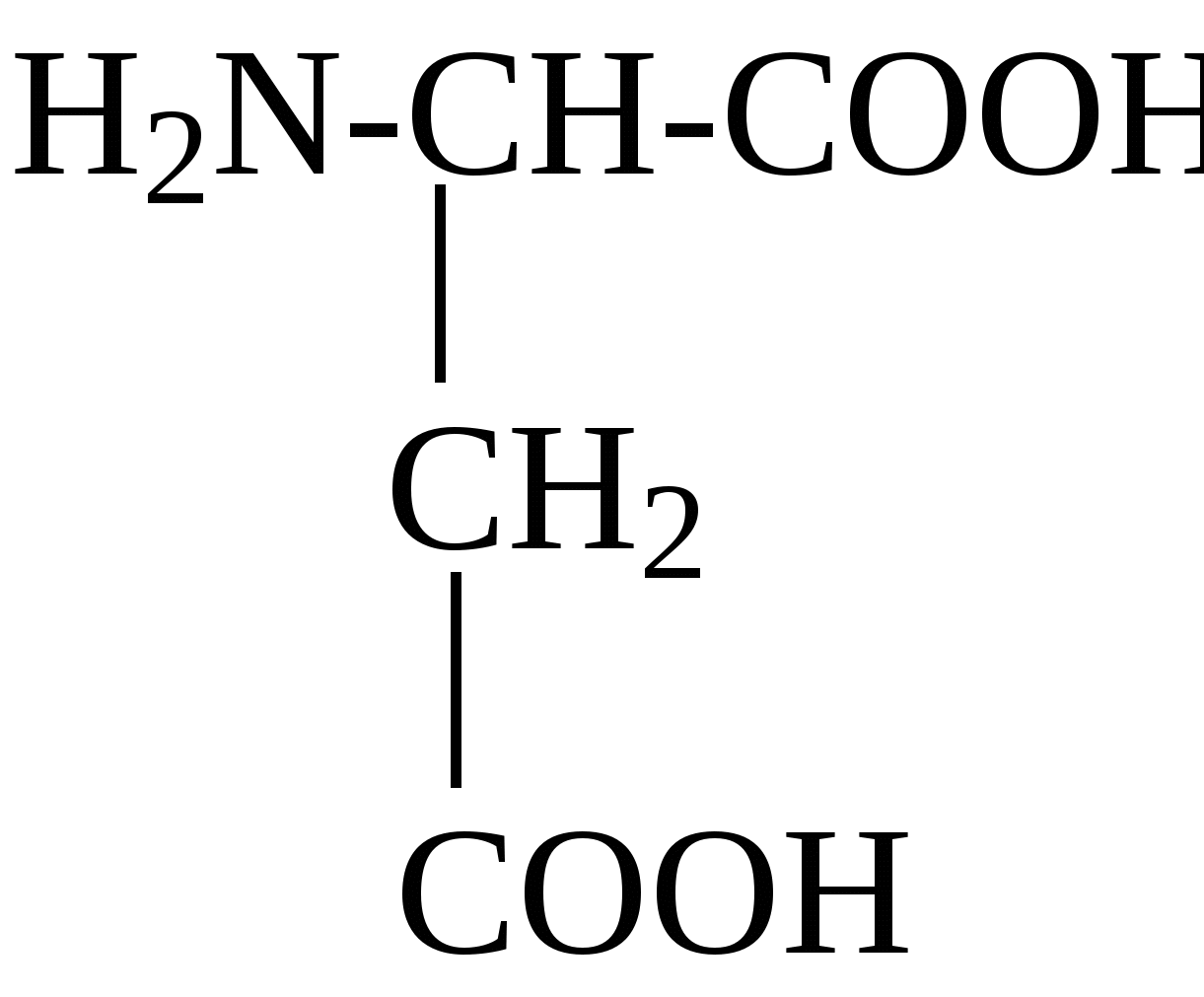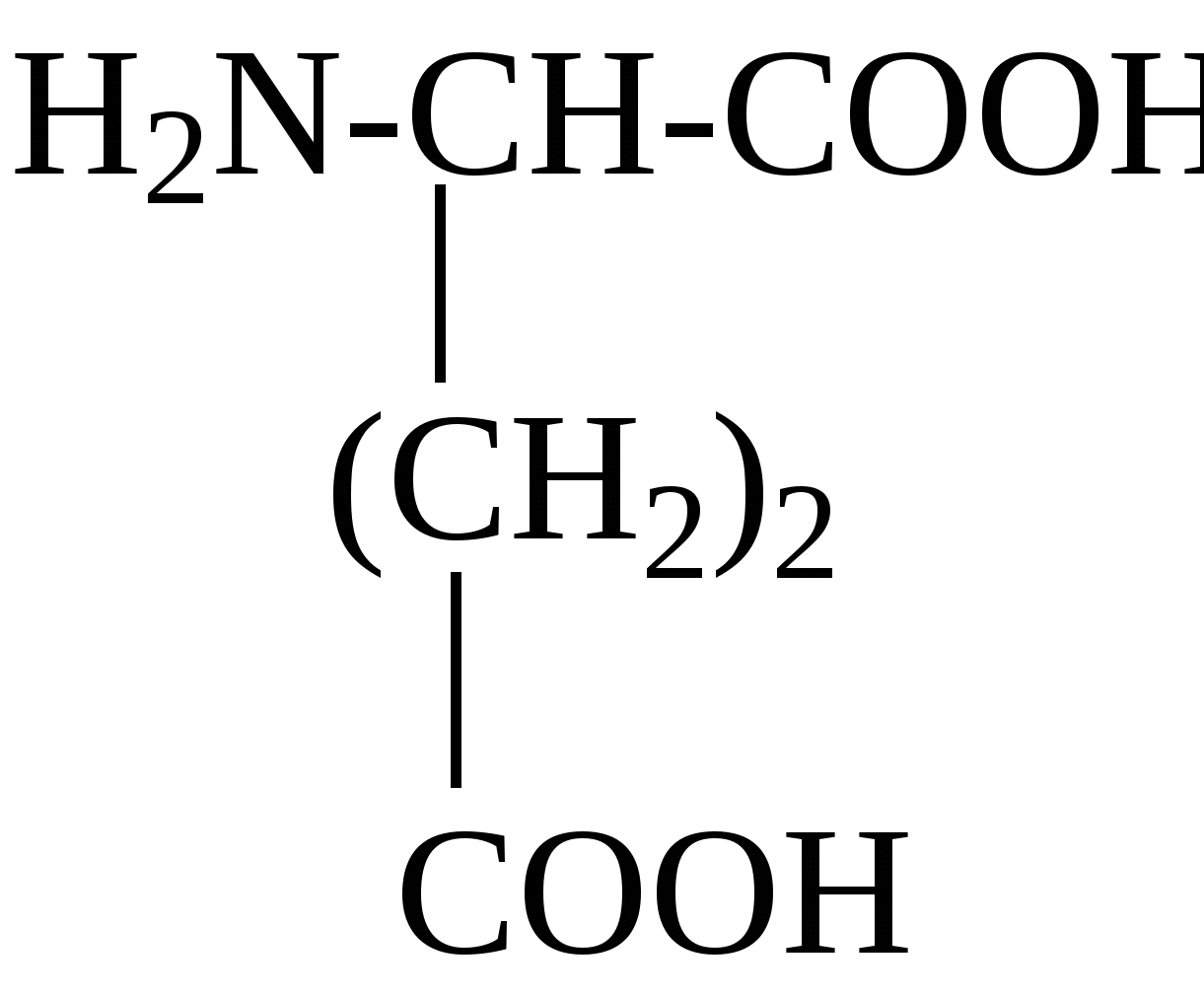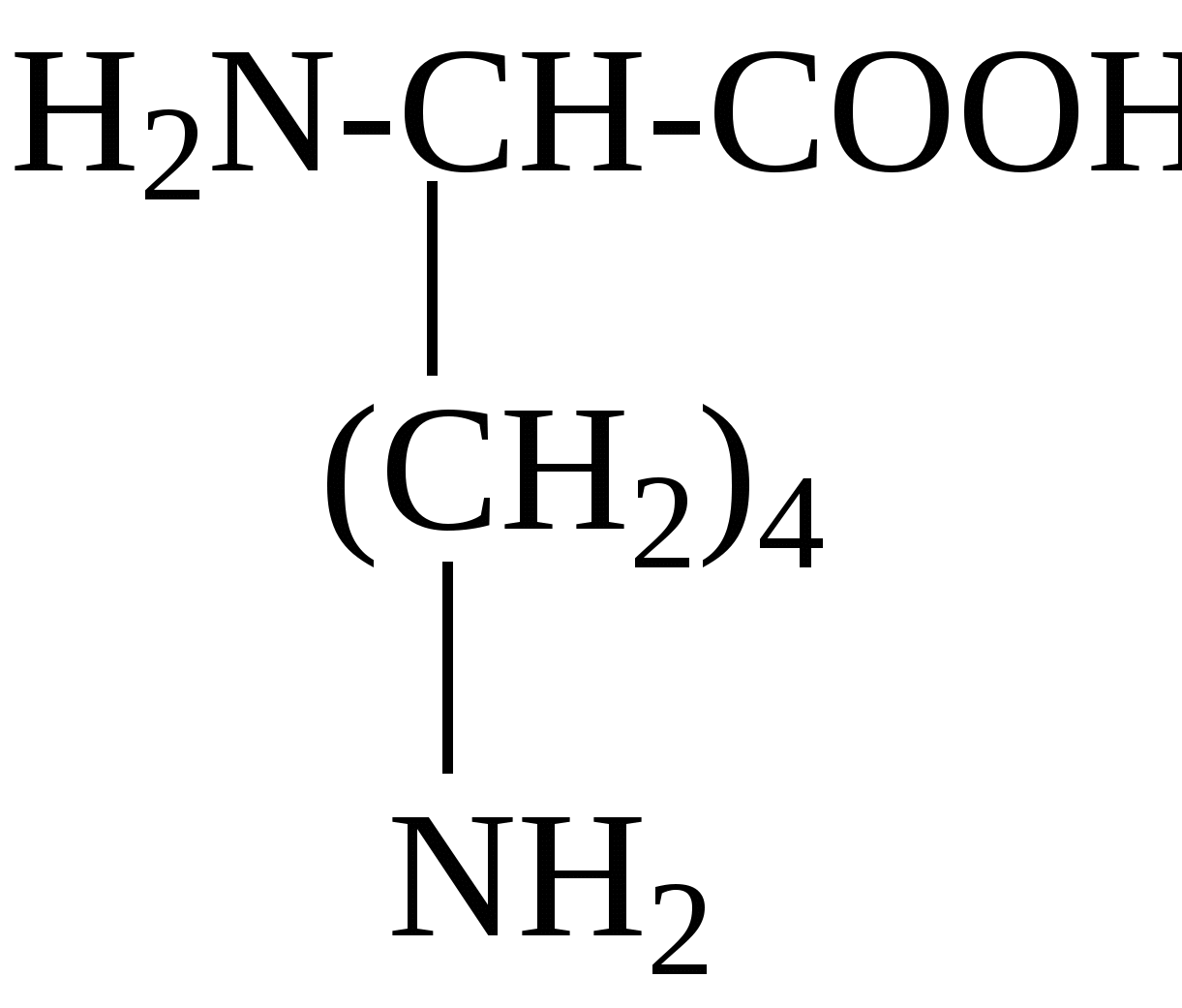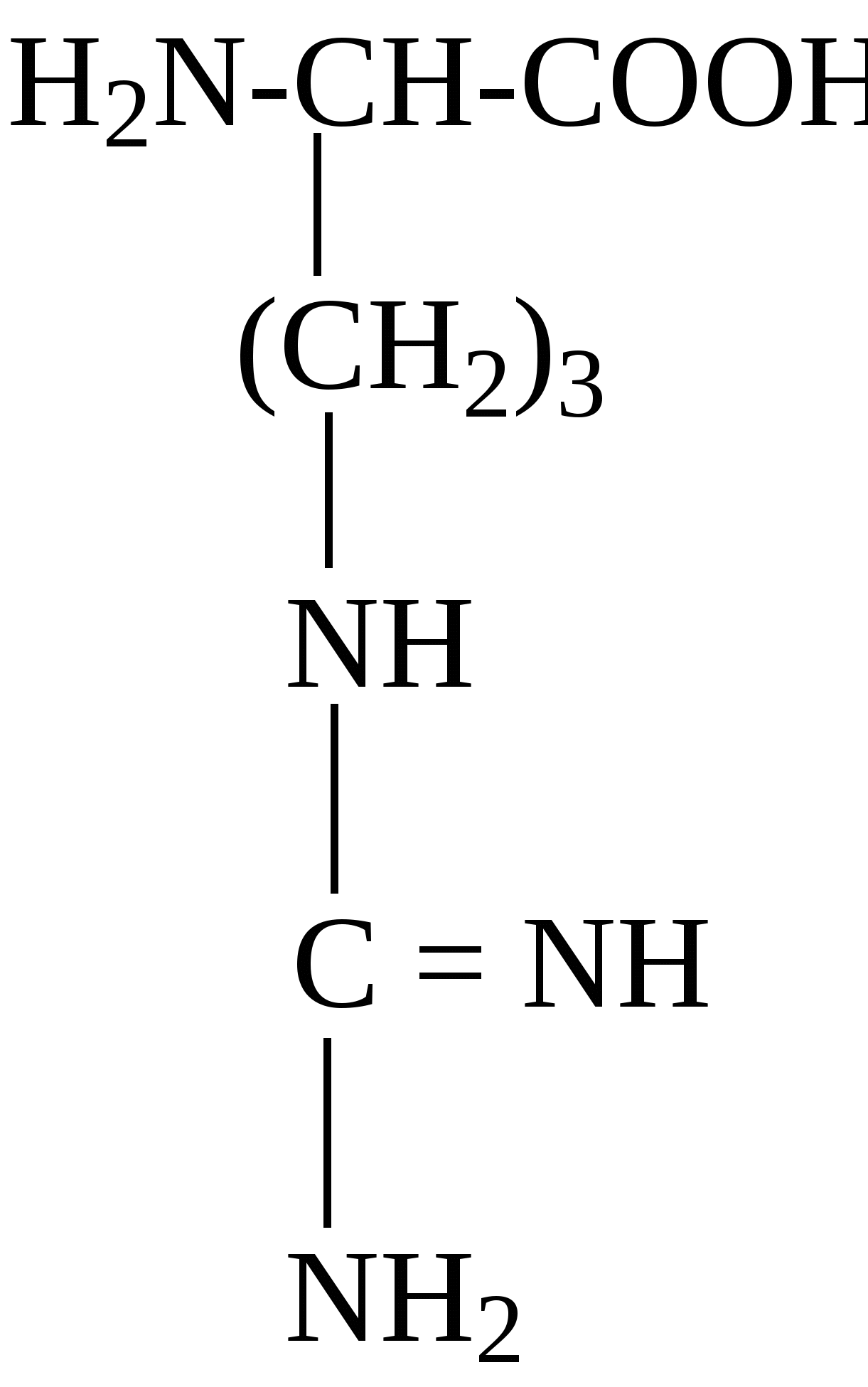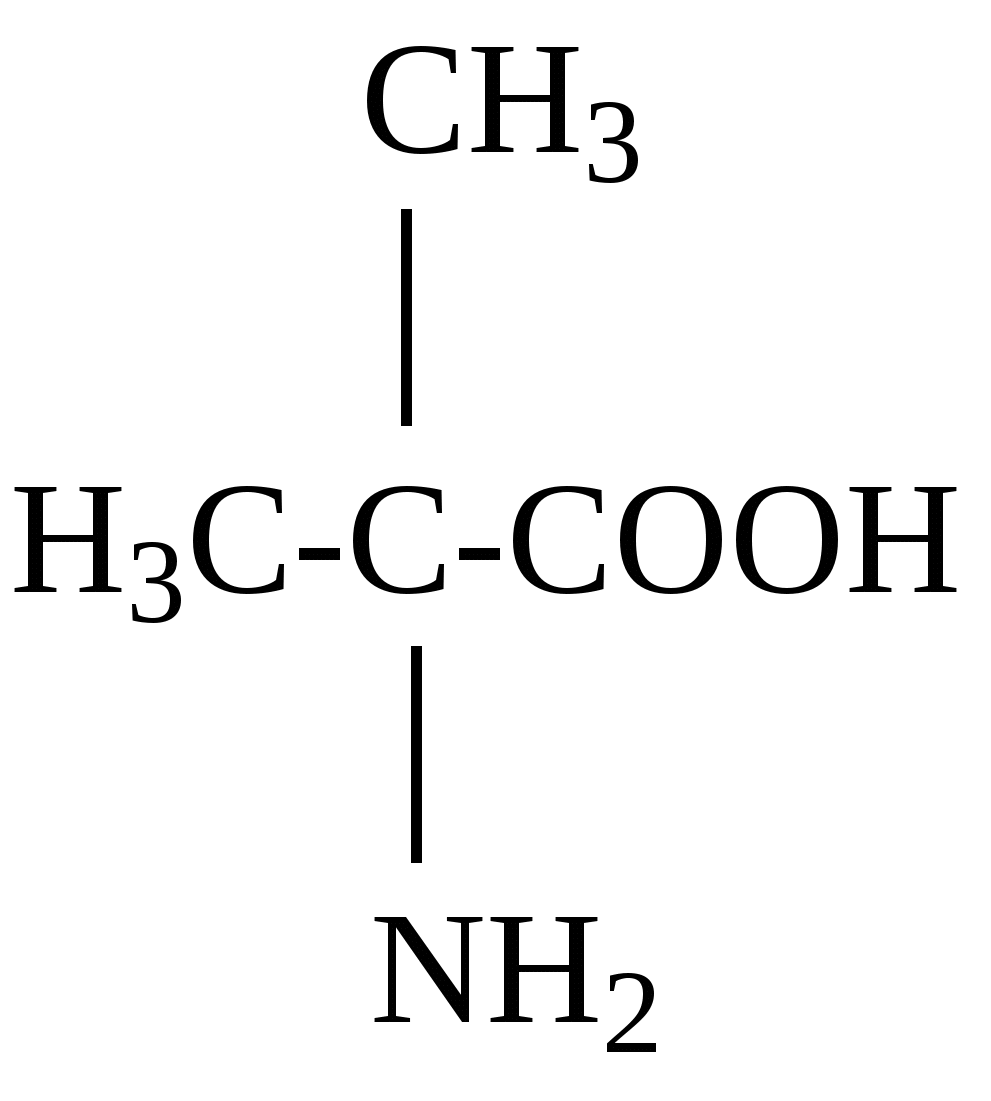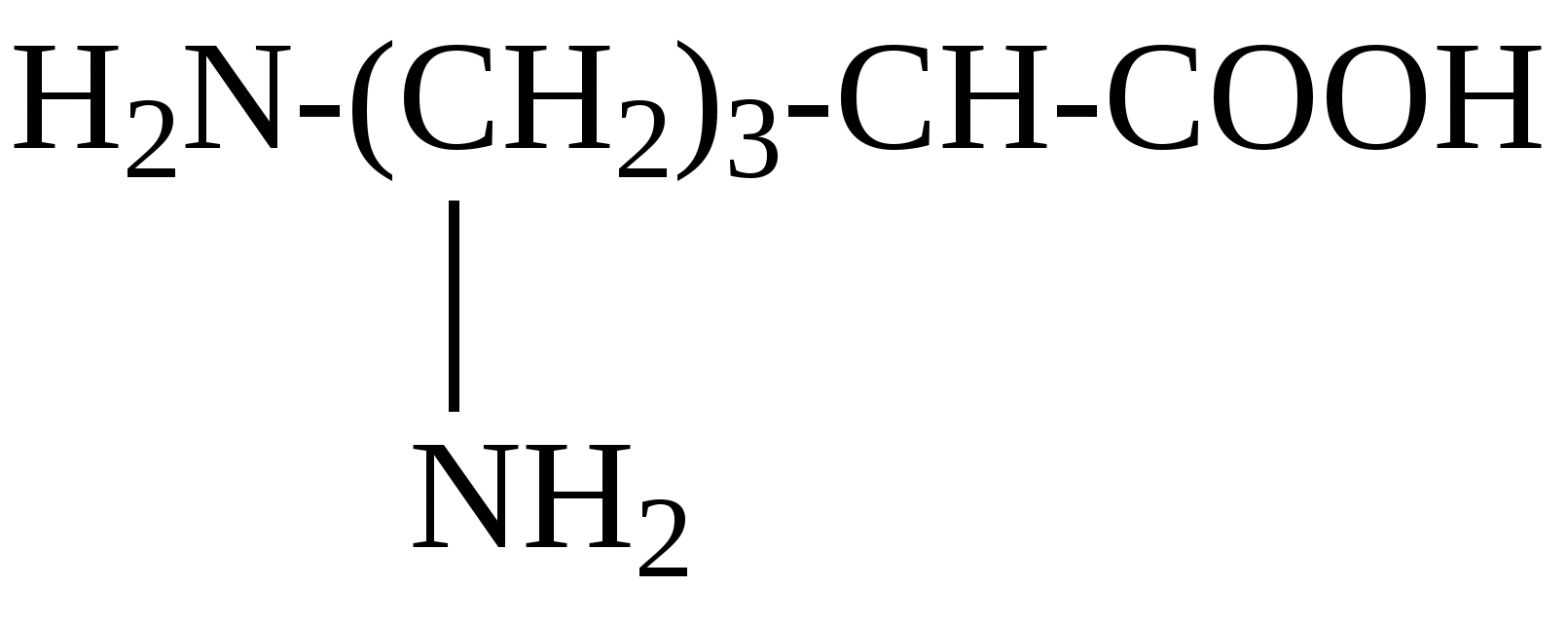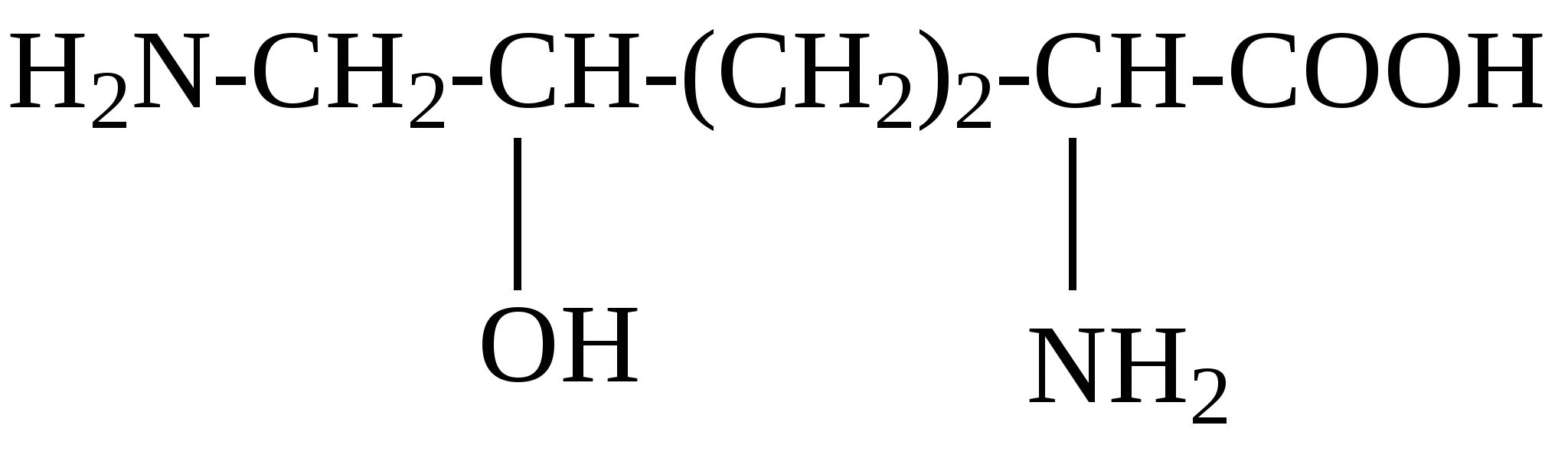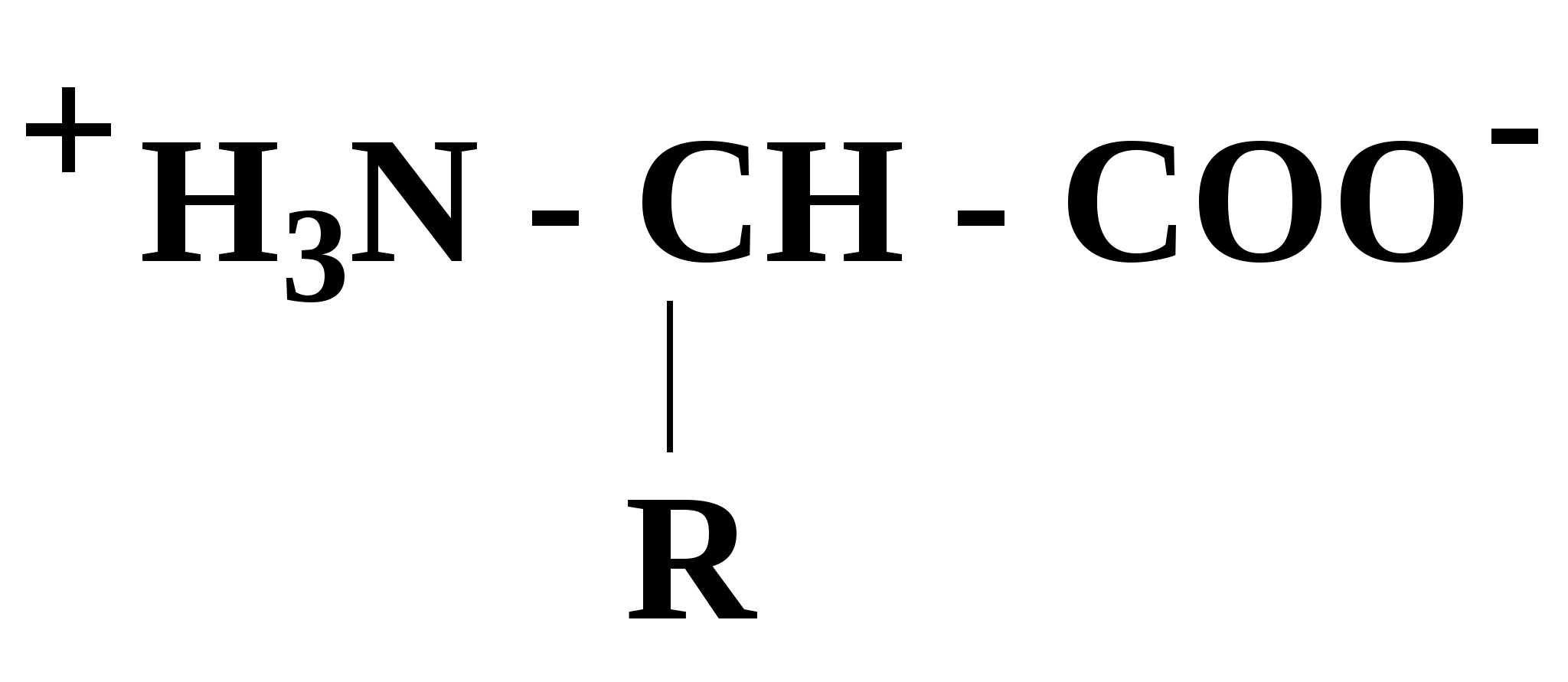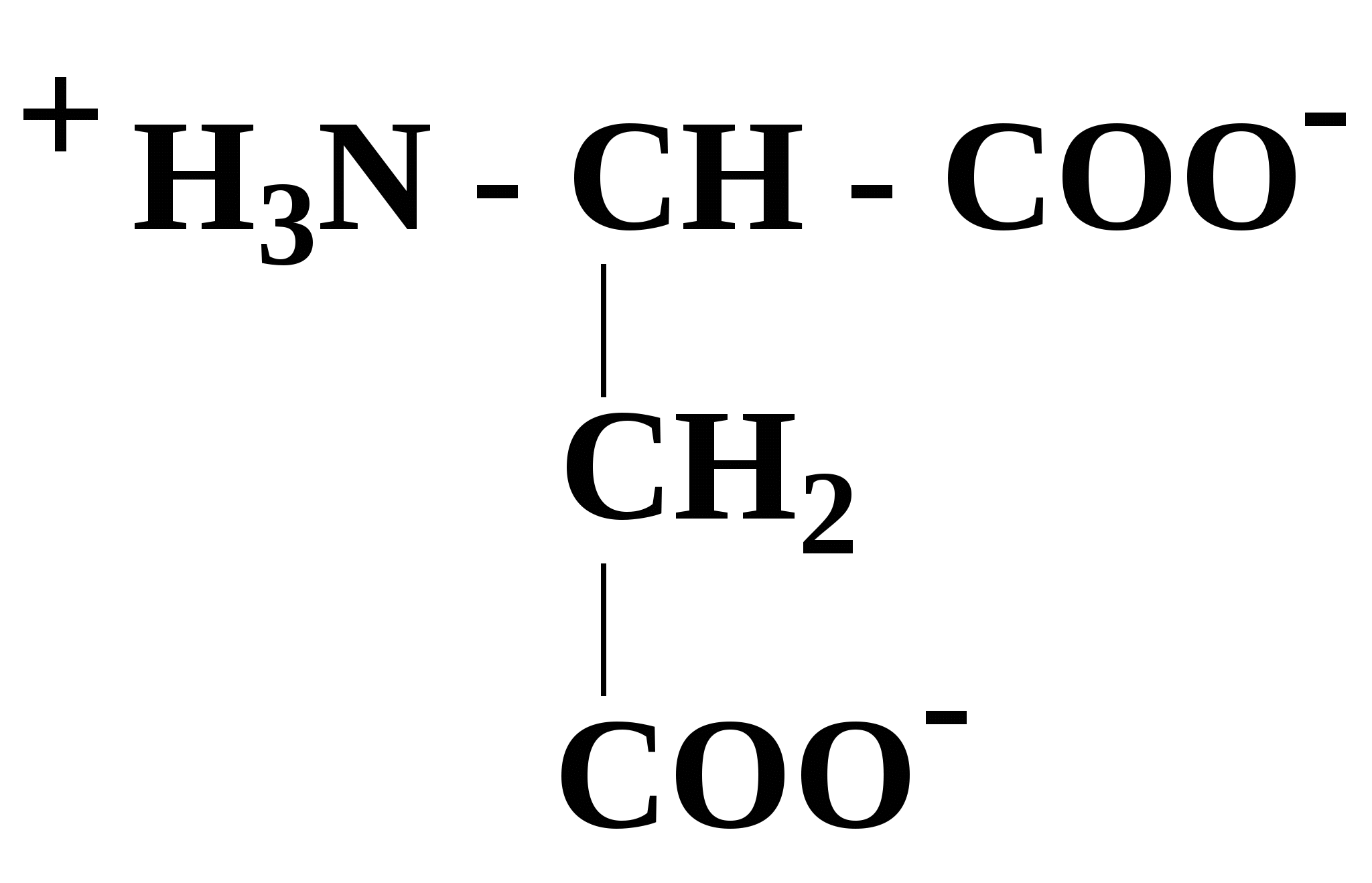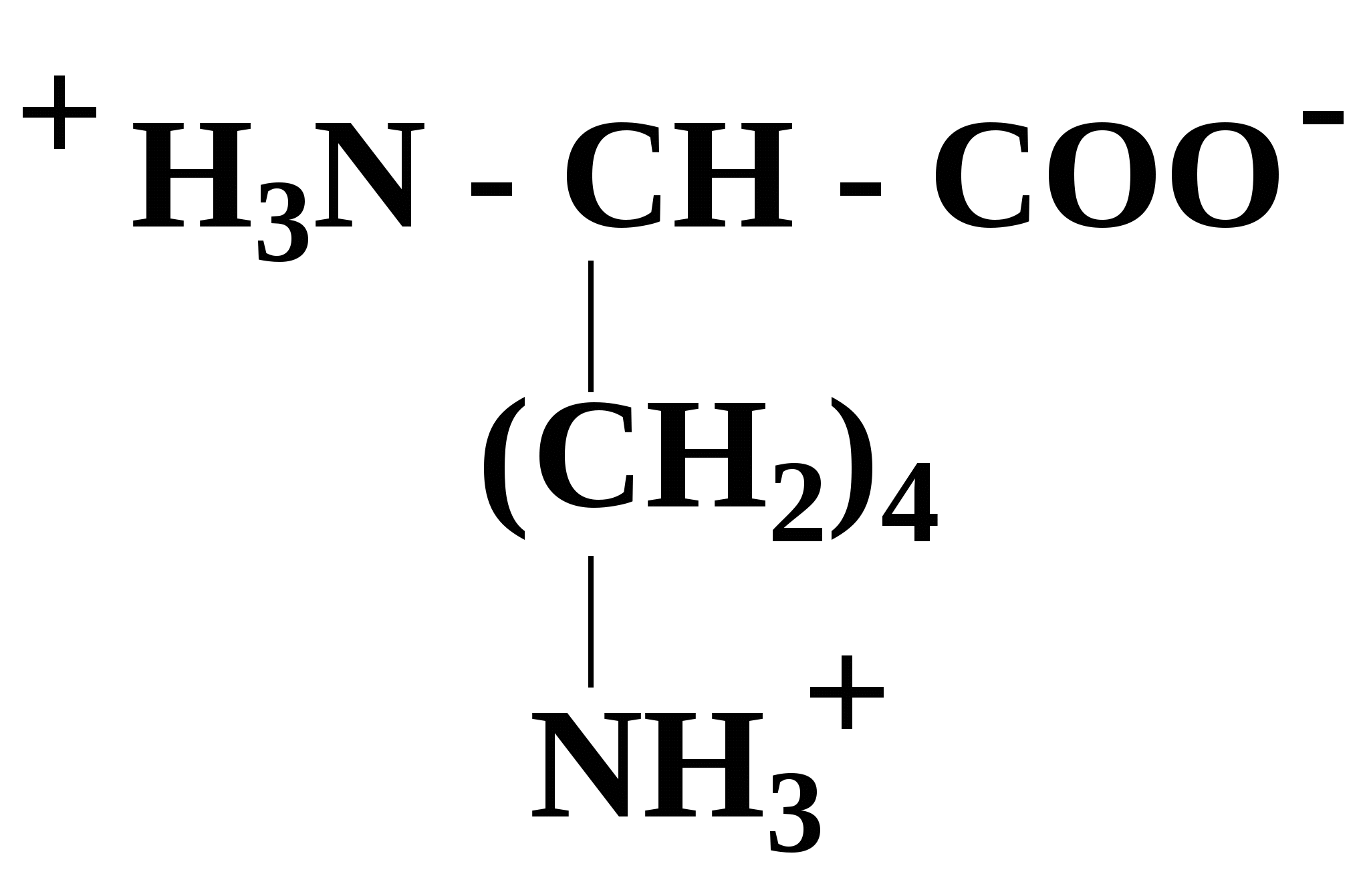Основы биологической химии предисловие
 Скачать 7.85 Mb. Скачать 7.85 Mb.
|
|
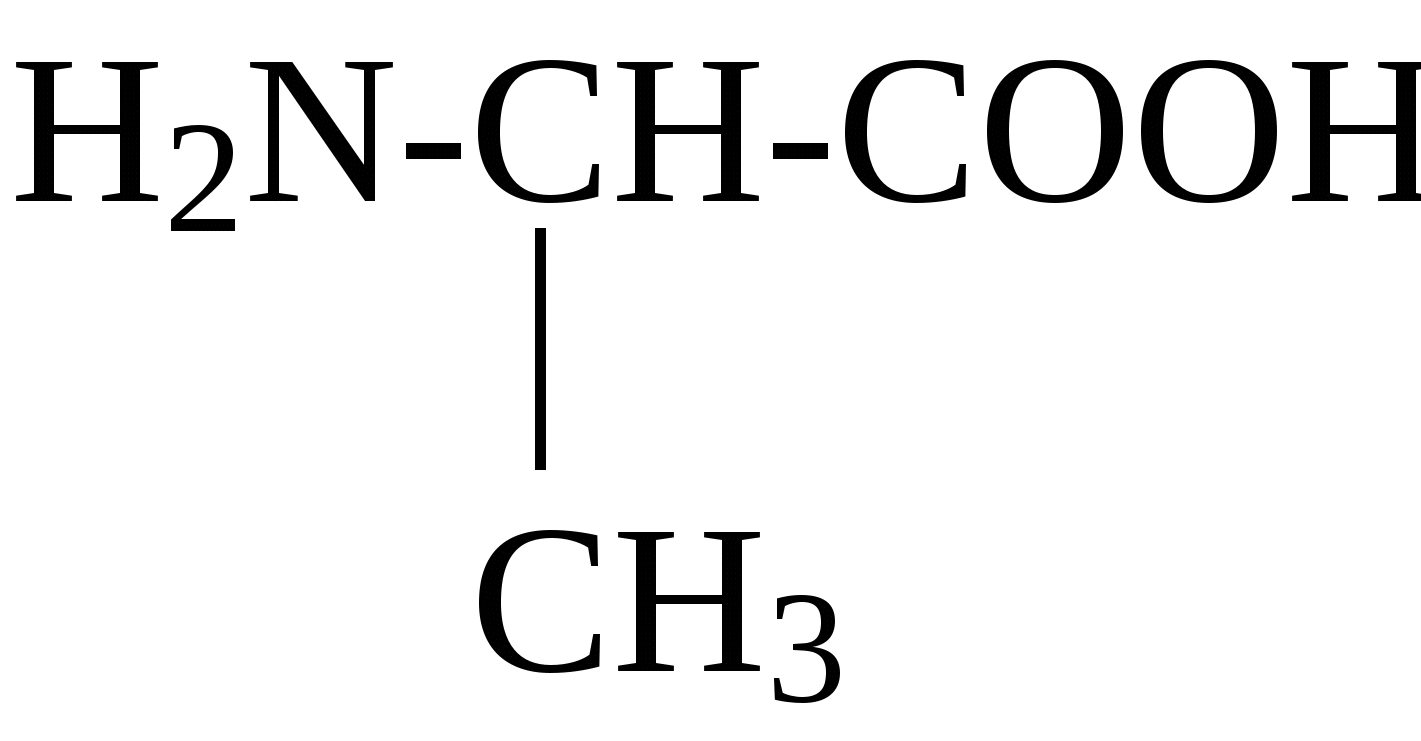
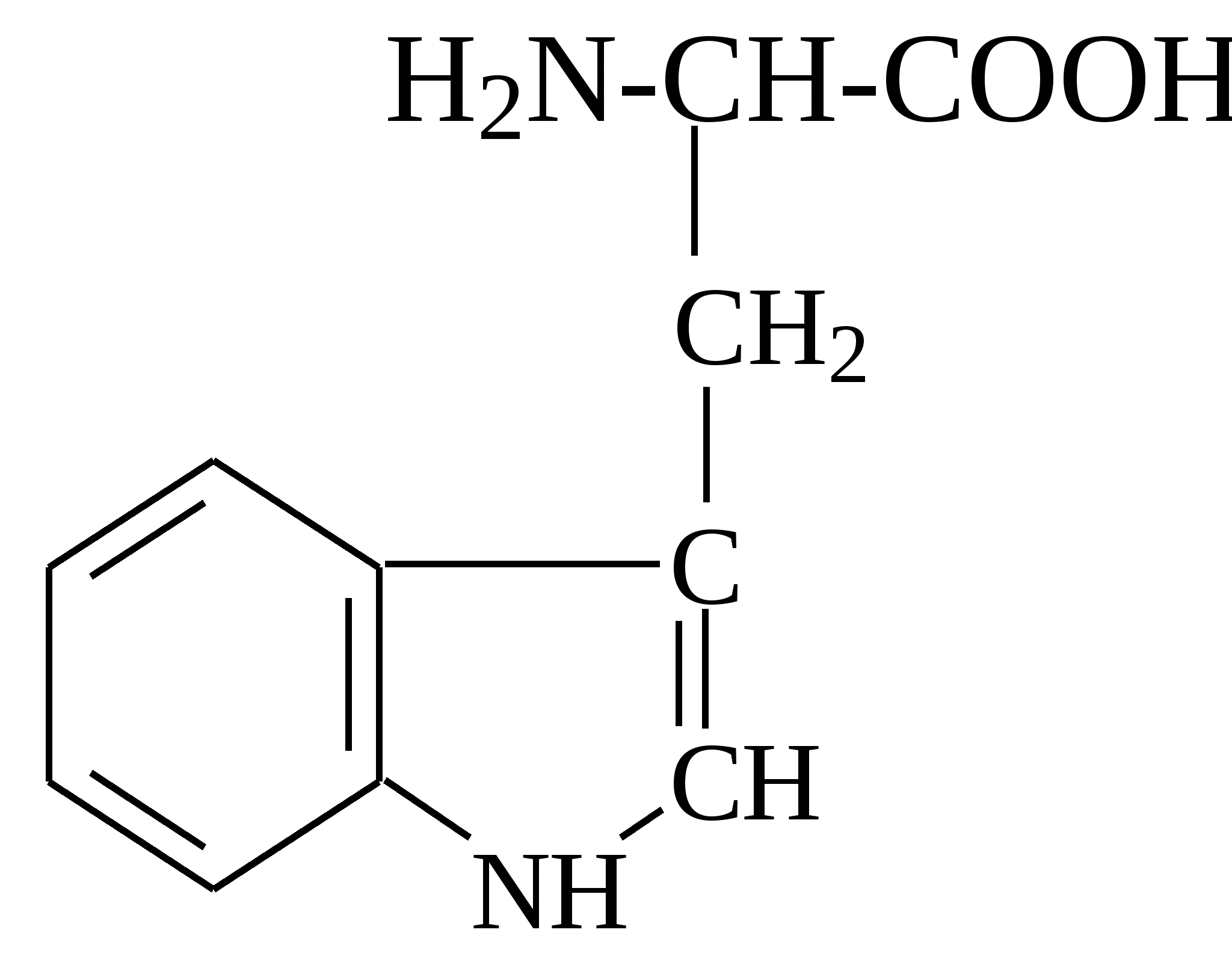
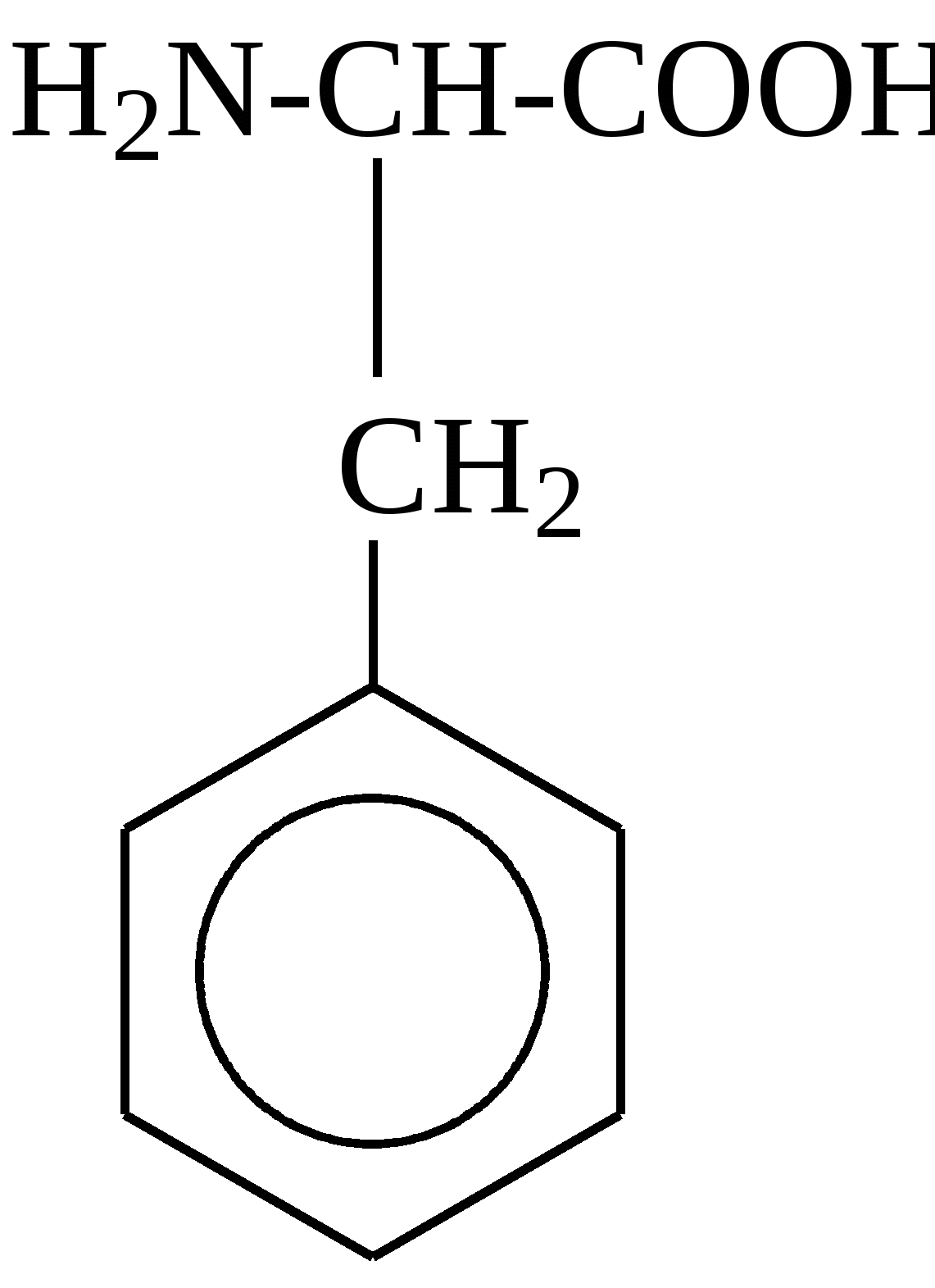
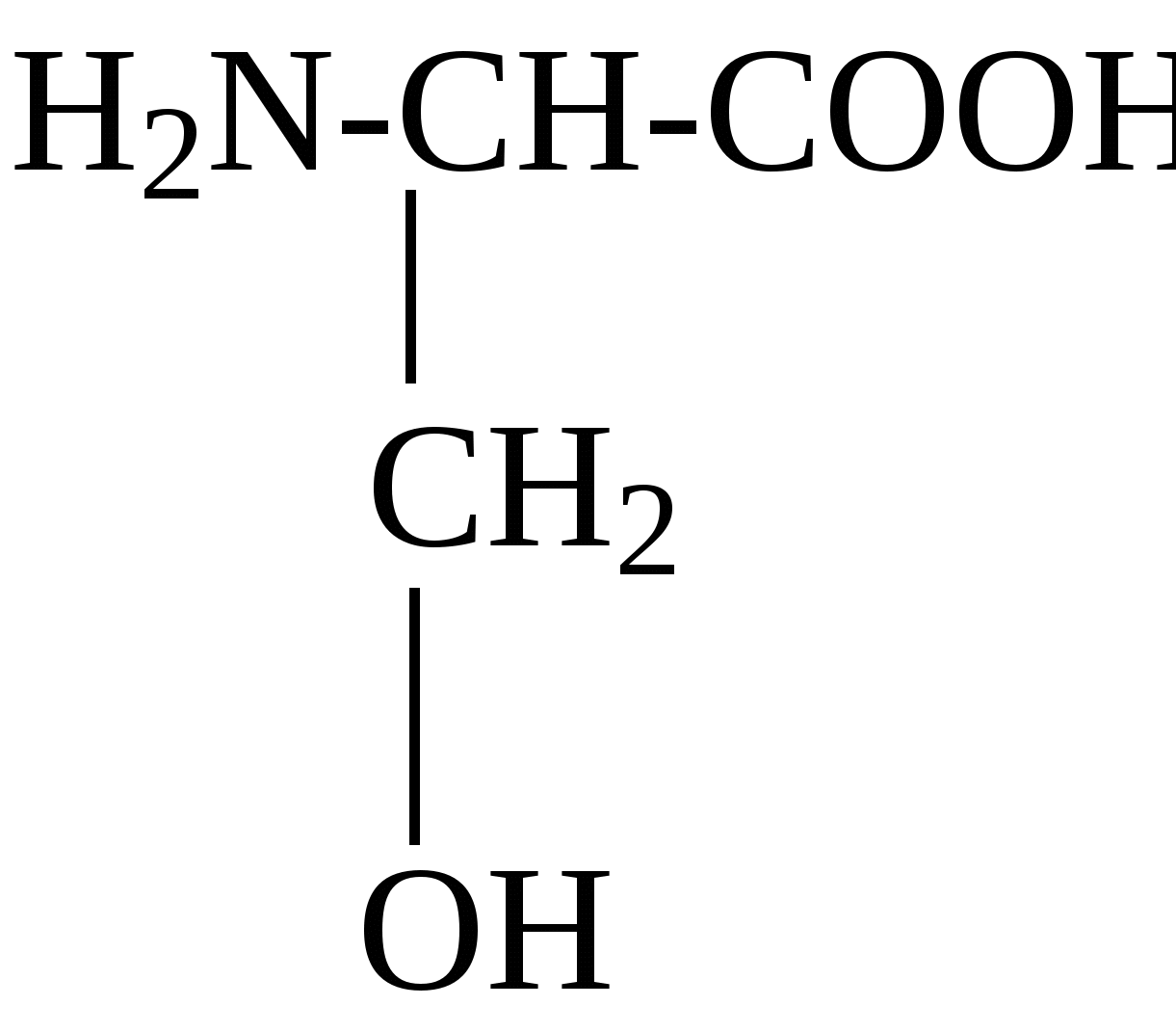
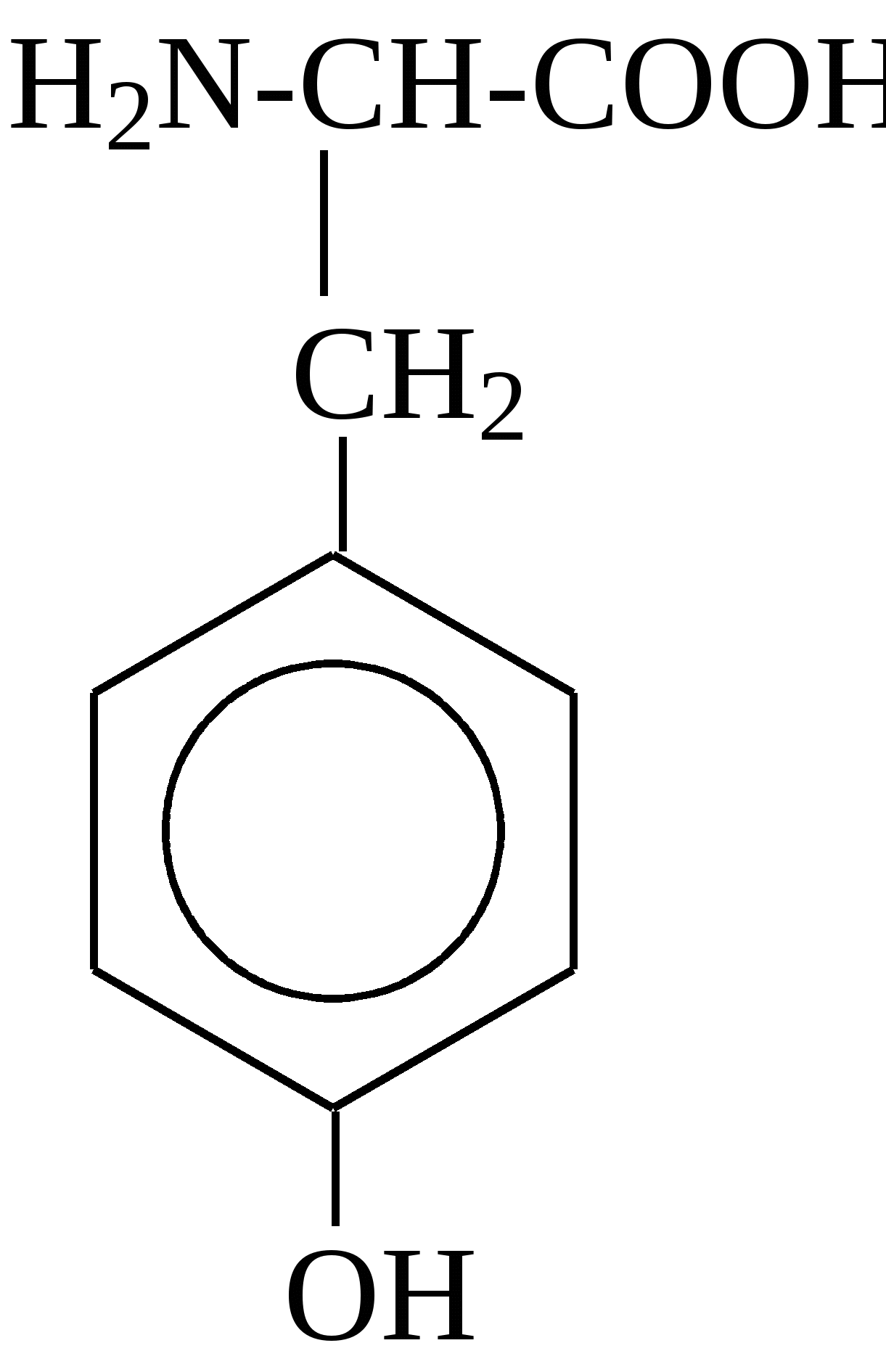
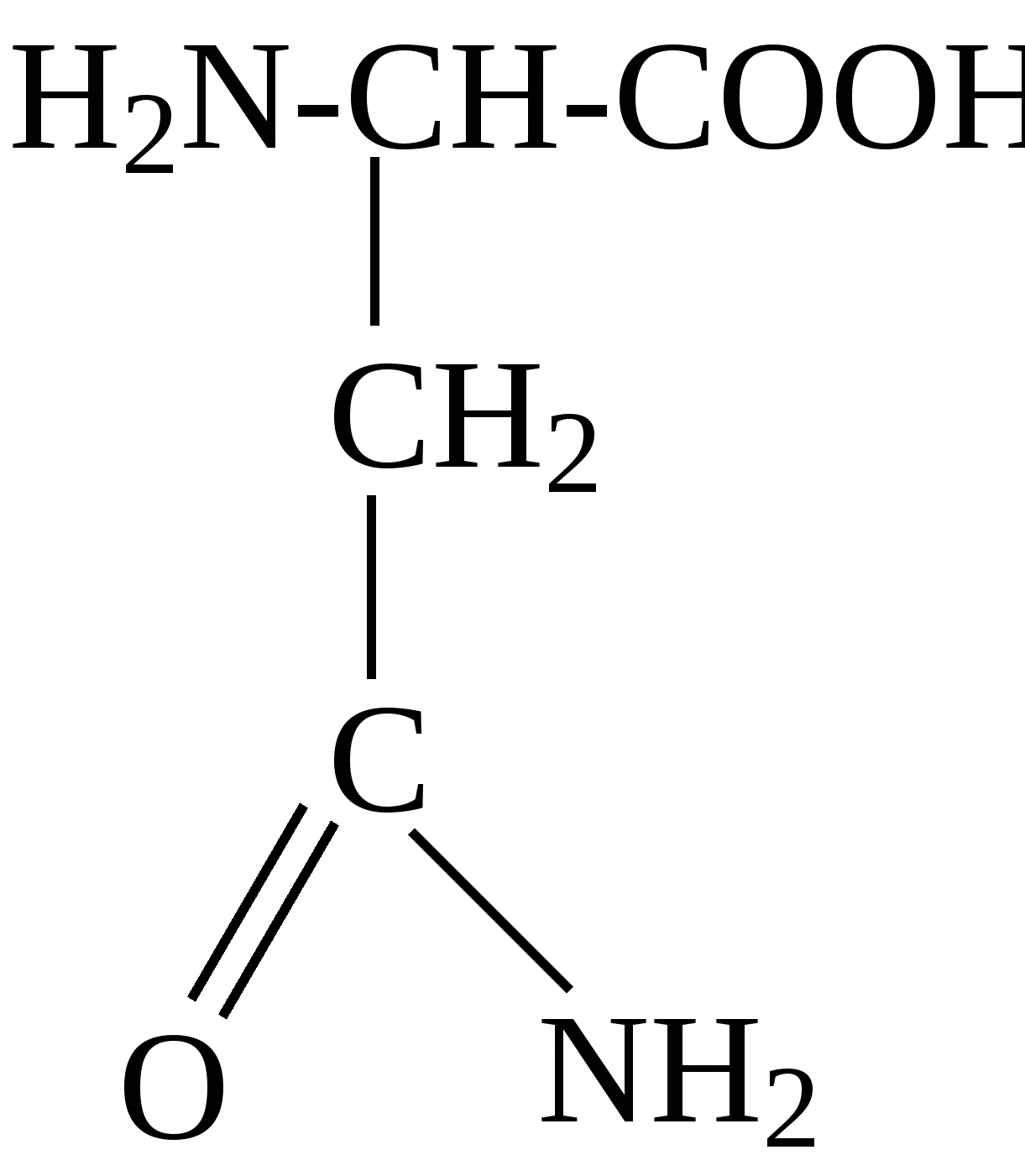
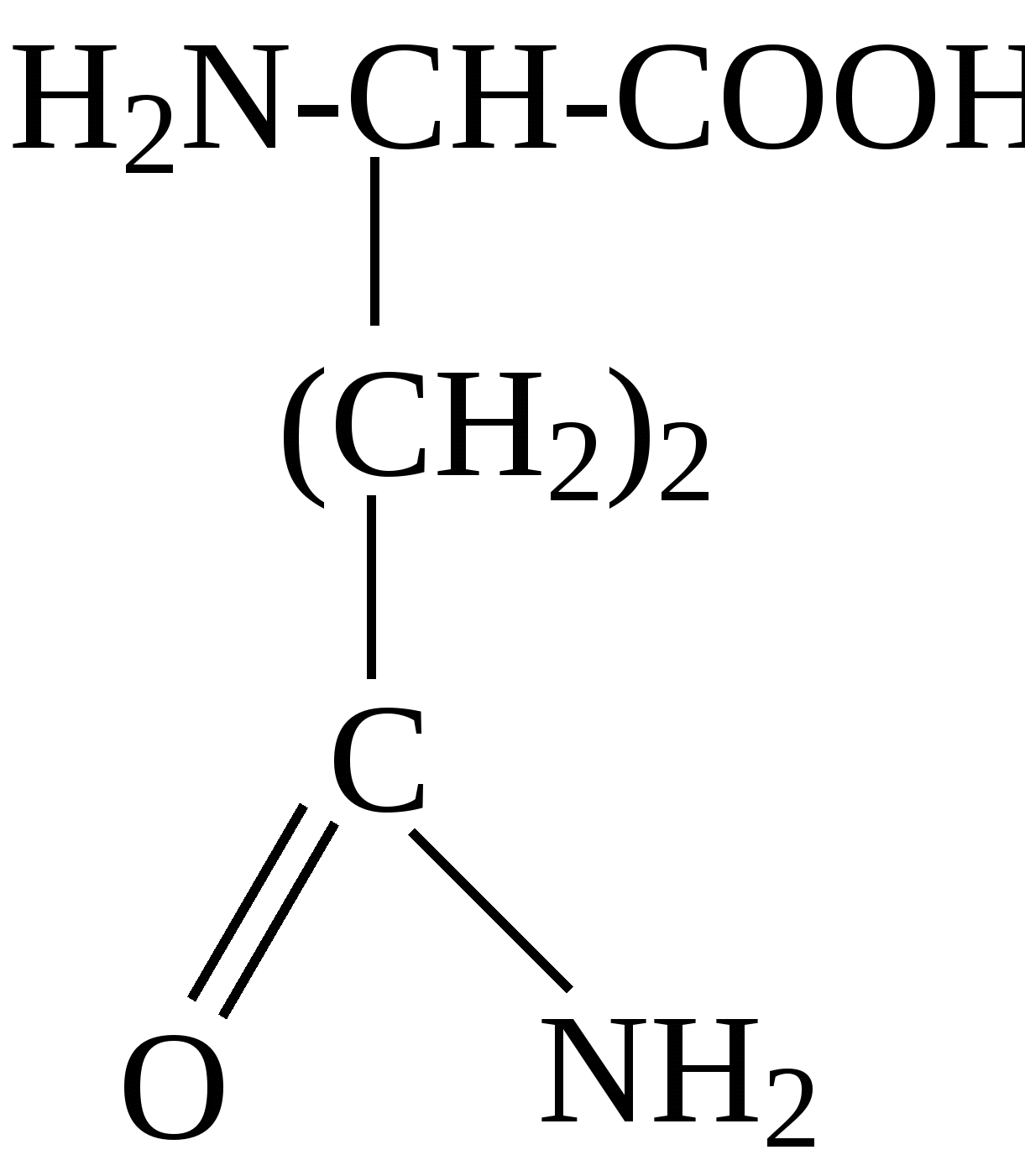
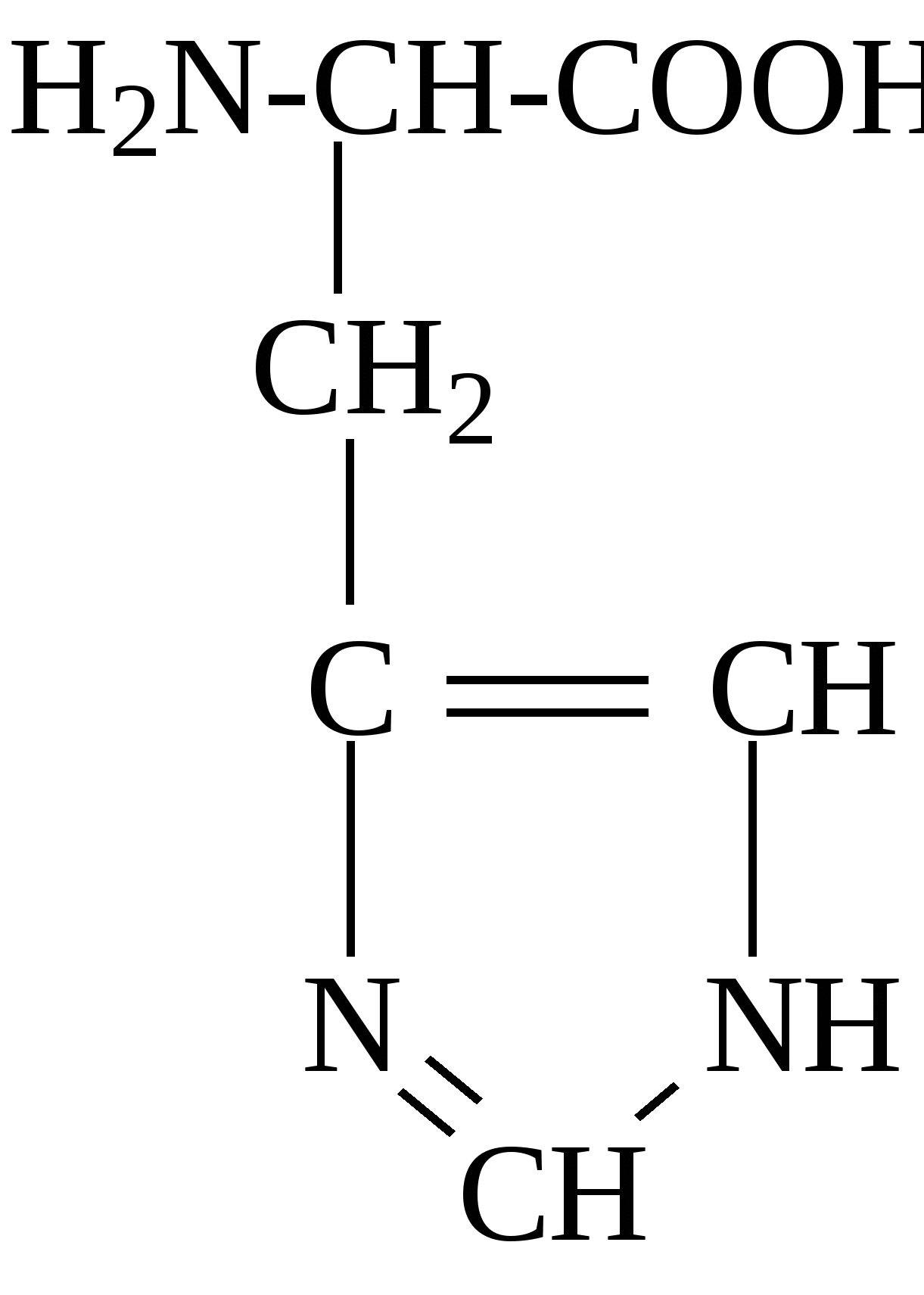
2.4. Аминокислотный состав белков С химической точки зрения белки - это высокомолекулярные азотсодержащие органические соединения (полиамиды), молекулы которых построены из остатков аминокислот. Мономерами белков служат α-аминокислоты, общим признаком которых является наличие карбоксильной группы -СООН и аминогруппы -NH2 у второго углеродного атома (α-углеродный атом): 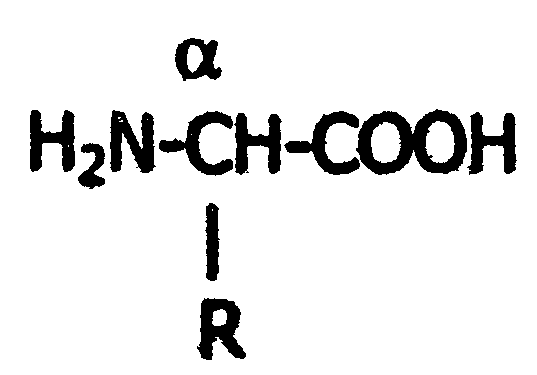 Аминокислоты классифицируют: - по полярности радикалов на полярные (гидрофильные) и неполярные (гидрофобные); - по природе радикалов на алифатические (глицин, аланин, валин, лейцин, изолейцин); гидроксиаминокислоты (серии, треонин); дикарбоновые, кислые, (аспарагиновая, глутаминовая и их амиды - аспарагин и глутамин); тиоаминокислоты (цистеин, метионин); диаминомонокарбоновые, щелочные (лизин, аргинин); ароматические (фенилаланин, тирозин); гетероциклические (триптофан, гистидин, пролин). В настоящее время известно более 200 аминокислот, существующих в природе. В организме человека содержится около 60 различных аминокислот и их производных. В белках же всех видов живых существ - от бактерий до человека - обнаруживают менее 30 из них. Эти аминокислоты делят на две группы: постоянно встречающиеся в белках (главные) и иногда встречающиеся (редкие). К первой группе относят 20 аминокислот (в том числе и пролин, который, по существу, является иминокислотой) (табл.4). Таблица 4. Аминокислоты, постоянно встречающиеся в составе белков
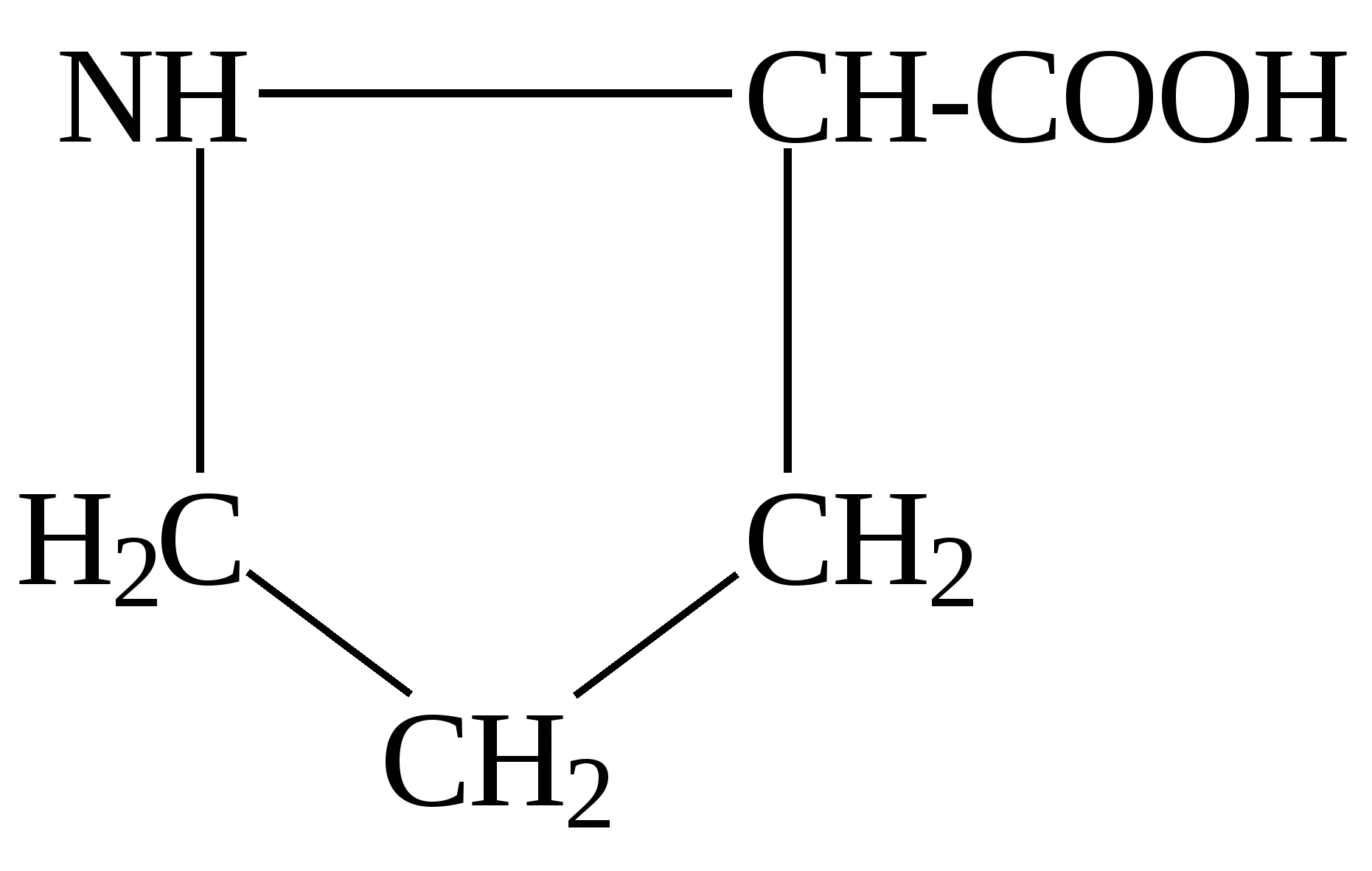
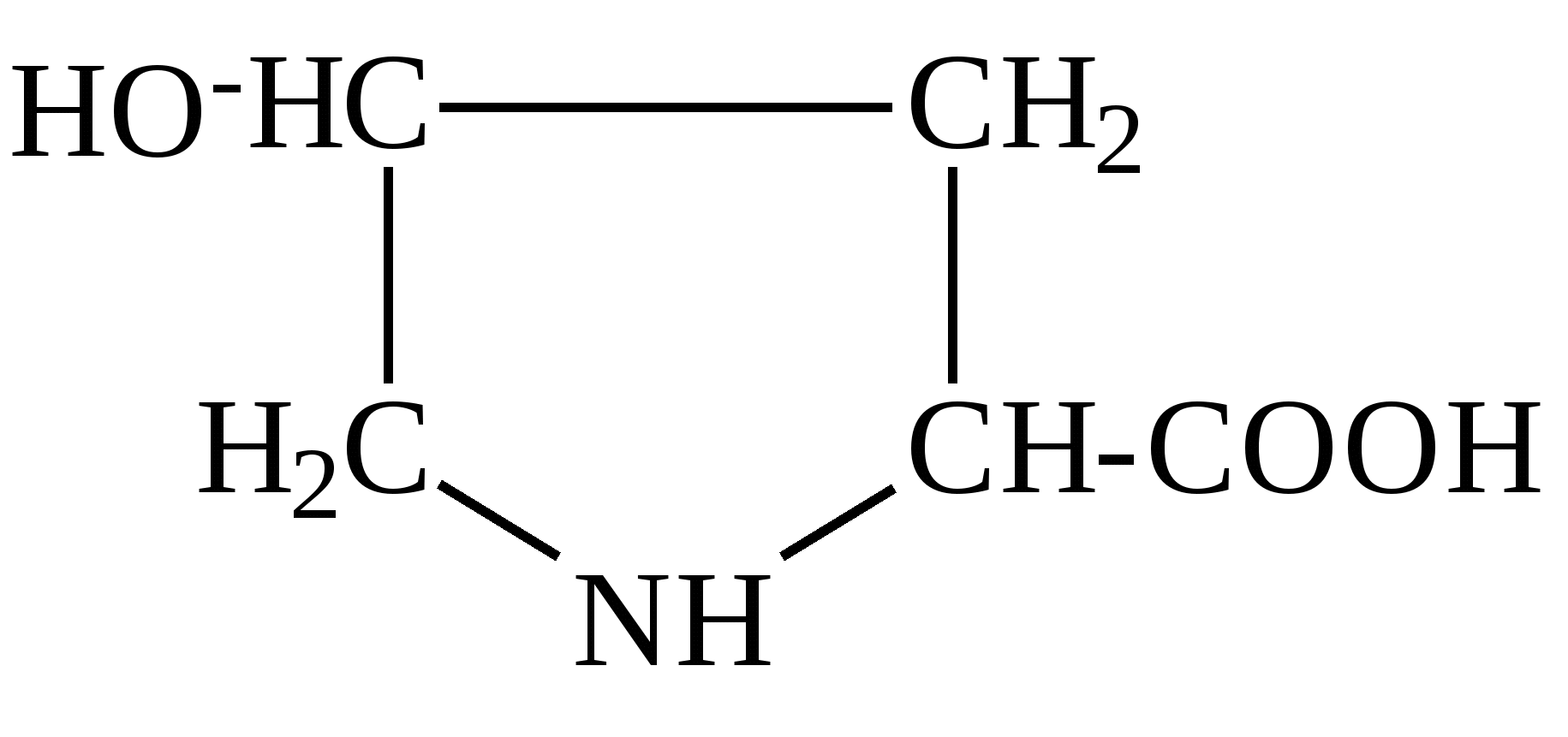
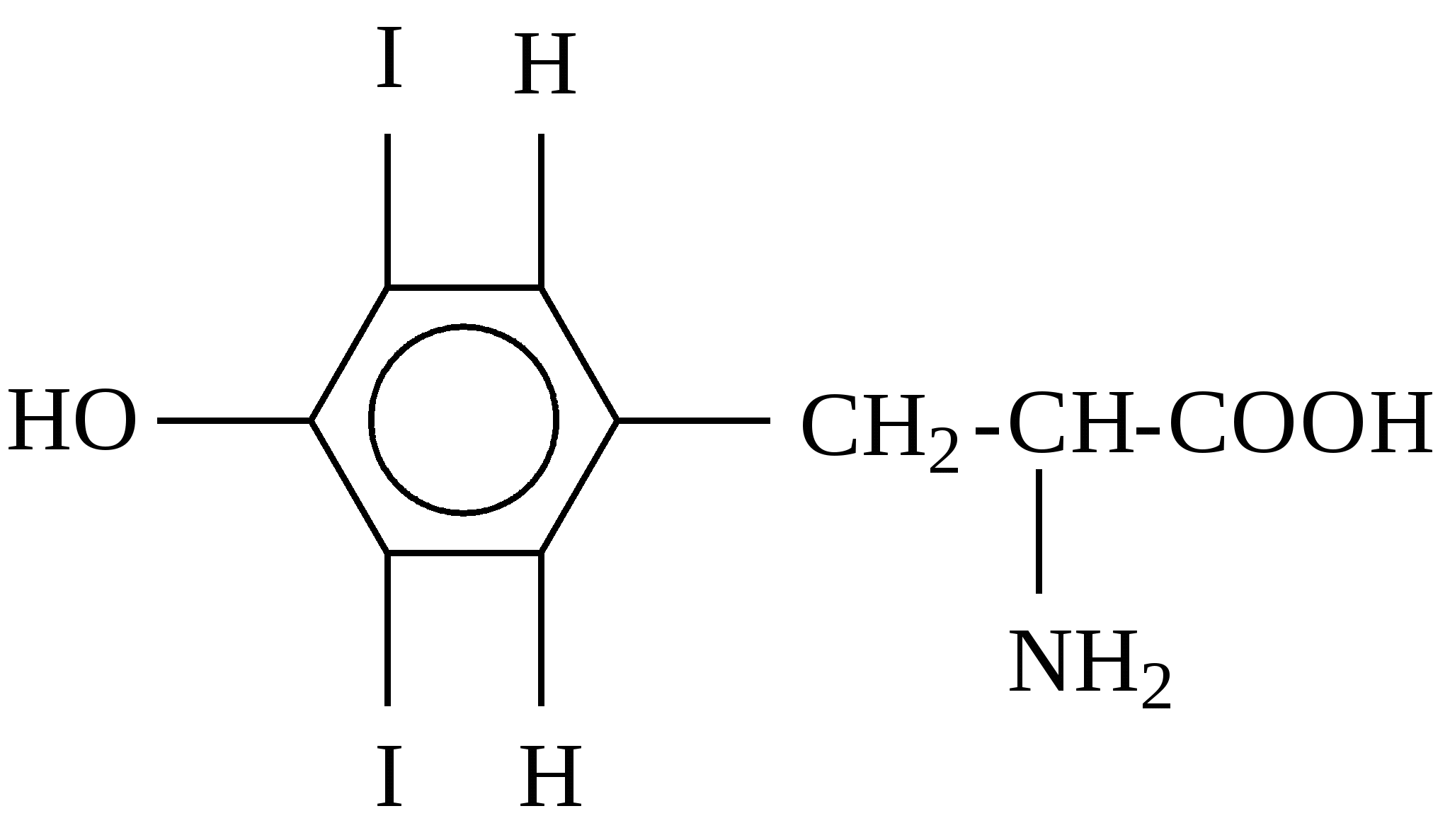
К группе редко встречающихся аминокислот принадлежат, например, гидроксипролин, гидроксилизин, орнитин, йодтирозин, α-аминоизомасляная кислота и некоторые другие. Они имеют следующее строение:
Эти аминокислоты образуются из главных уже после включения их в состав белковой молекулы. 2.5. Кислотно-основные свойства аминокислот α-Аминокислоты в силу своего химического строения проявляют кислотно-основные (амфотерные) свойства, которые определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, почти все методы выделения и идентификации аминокислот и белков. При нейтральном значении рН аминокислоты в растворах находятся в виде биполярного иона (цвиттер-иона), при этом аминогруппа протонирована (-NH3+), а карбоксильная группа - диссоциирована (-СОО-):
Ионизация аминокислоты зависит от рН среды: в кислых растворах ионизирована аминогруппа, а в щелочных - карбоксильная группа:
В кислой среде α-аминокислоты выступают как основания (по аминогруппе), а в щелочной - как кислоты (по карбоксильной группе). У некоторых аминокислот может ионизироваться также радикал (R), в связи, с чем все аминокислоты можно разделить на заряженные и незаряженные (при физиологическом значении рН=6,0 - 8,0) (см. табл. 4). В качестве примера первых можно привести аспарагиновую кислоту и лизин:
Если радикалы аминокислот нейтральные, то они не оказывают влияния на диссоциацию α-карбоксильной или α-аминогруппы, и величинырК (отрицательный логарифм, показывающий значение рН, при котором эти группы наполовину диссоциированы) остаются относительно постоянными. Величины рК для α-карбоксилыюй (pK1) и α-аминогруппы (рК2) сильно различаются. При рН < pK1 почти все молекулы аминокислоты протежированы и заряжены положительно. Напротив, при рН > рК2 практически все молекулы аминокислоты являются отрицательно заряженными, так как α-карбоксильная группа находится в диссоциированном состоянии. Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой положительный или отрицательный заряд. Значение рН, при котором суммарный заряд молекулы равен нулю, и она не перемещается в электрическом поле ни к катоду, ни к аноду, называется изоэлектрической точкой и обозначается pI. Для нейтральных α-аминокислот значение pI находят как среднее арифметическое между двумя значениями рК: При рН раствора меньше pI аминокислоты протонируются и, заряжаясь положительно, перемещаются в электрическом поле к катоду. Обратная картина наблюдается при рН > pI. Для аминокислот, содержащих заряженные (кислотные или основные) радикалы, изоэлектрическая точка зависит от кислотности или основности этих радикалов и их рК (рК3). Значение pI для них находят по следующим формулам: для кислых аминокислот: для основных аминокислот: В клетках и межклеточной жидкости организма человека и животных рН среды близко к нейтральному, поэтому основные аминокислоты (лизин, аргинин) имеют положительный заряд (катионы), кислые аминокислоты (аспарагиновая, глутаминовая) имеют отрицательный заряд (анионы), а остальные существуют в виде биполярного цвиттер-иона. 2.6. Стереохимия аминокислот Важной особенностью белковых α-аминокислот является их оптическая активность. За исключением глицина все они построены асимметрично, в связи с чем, будучи растворены в воде или в соляной кислоте, способны вращать плоскость поляризации света. Аминокислоты существуют в виде пространственных изомеров, относящихся к D- или L-ряду. L- или D-конфигурация определяется типом строения соединения относительно асимметрического атома углерода (атом углерода, связанный с четырьмя различными атомами или группами атомов). В формулах асимметрический атом углерода обозначают звездочкой. На рис.3 показаны проекционные модели L- и D- конфигураций аминокислот, которые являются как бы зеркальным отображением друг друга. Все 18 оптически активных белковых аминокислот относятся к L -ряду. Однако в клетках многих микроорганизмов и в антибиотиках, продуцируемых некоторыми из них, обнаружены D-аминокислоты. 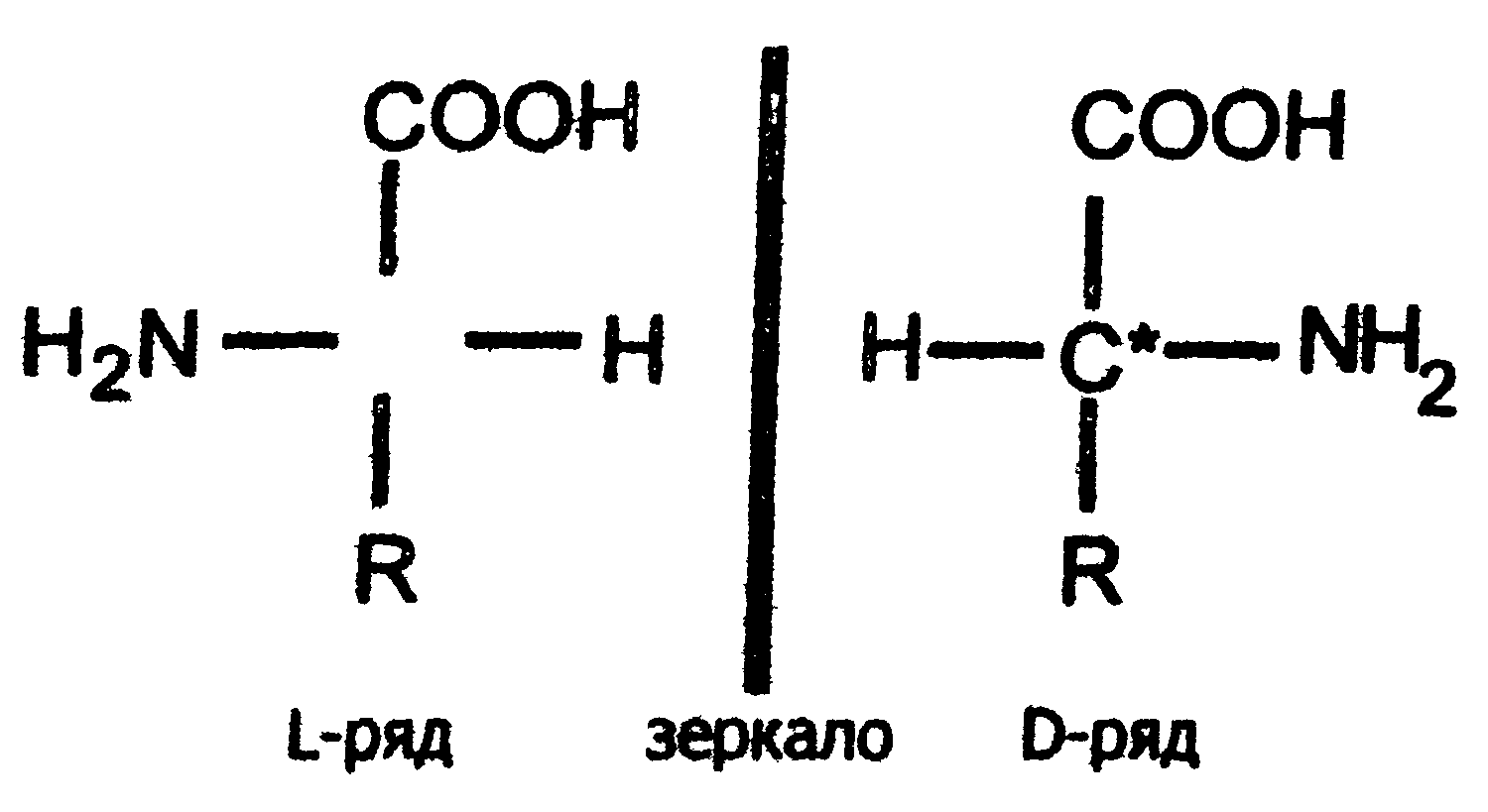 Рис. 3. Конфигурация L- и D- аминокислот 2.7. Строение белков Исходя из результатов изучения продуктов гидролиза белков и выдвинутых А.Я. Данилевским идей о роли пептидных связей -CO-NH- в построении белковой молекулы, немецкий ученый Э. Фишер предложил в начале XX века пептидную теорию строения белков. Согласно этой теории, белки представляют собой линейные полимеры α-аминокислот, связанных пептиднойсвязью - полипептиды: 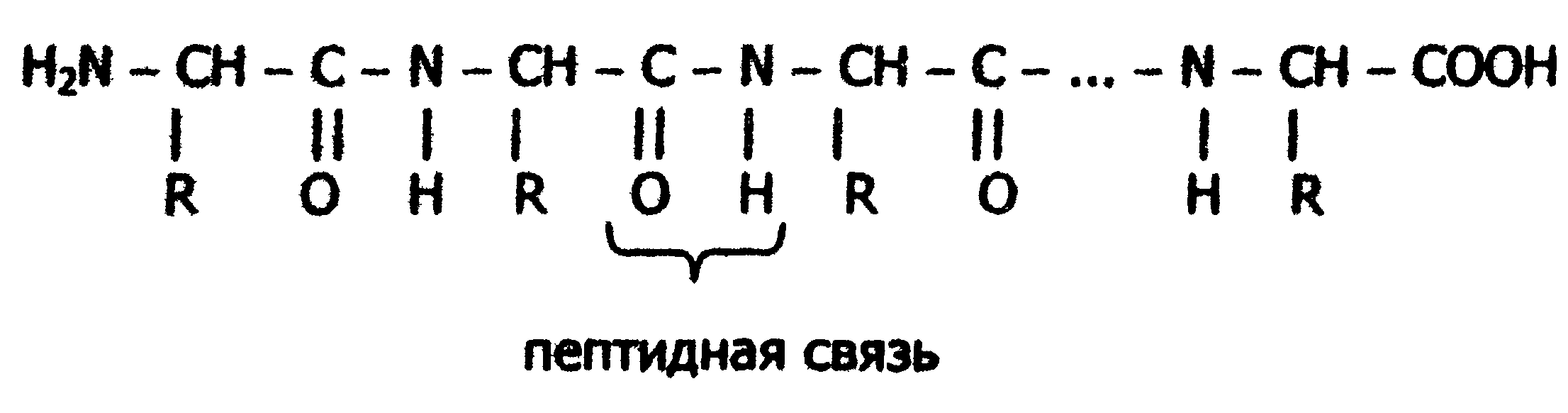 В каждом пептиде один концевой аминокислотный остаток имеет свободную α-аминогруппу (N-конец), а другой - свободную α-карбоксильную группу (С-конец). Структуру пептидов принято изображать, начиная с N-концевой аминокислоты. При этом аминокислотные остатки обозначаются символами. Например: Ala-Tyr-Leu-Ser-Tyr- •••-Cys. Этой записью обозначен пептид, в котором N-концевой α-аминокислотой является аланин, а С-концевой - цистеин. При чтении такой записи окончания названий всех кислот, кроме последних меняются на - "ил": аланил-тирозил-лейцил-серил-тирозил-••• -цистеин. Длина пептидной цепи в пептидах и белках, встречающихся в организме, колеблется от двух до сотен и тысяч аминокислотных остатков. Для определения аминокислотного состава белки (пептиды) подвергают гидролизу: 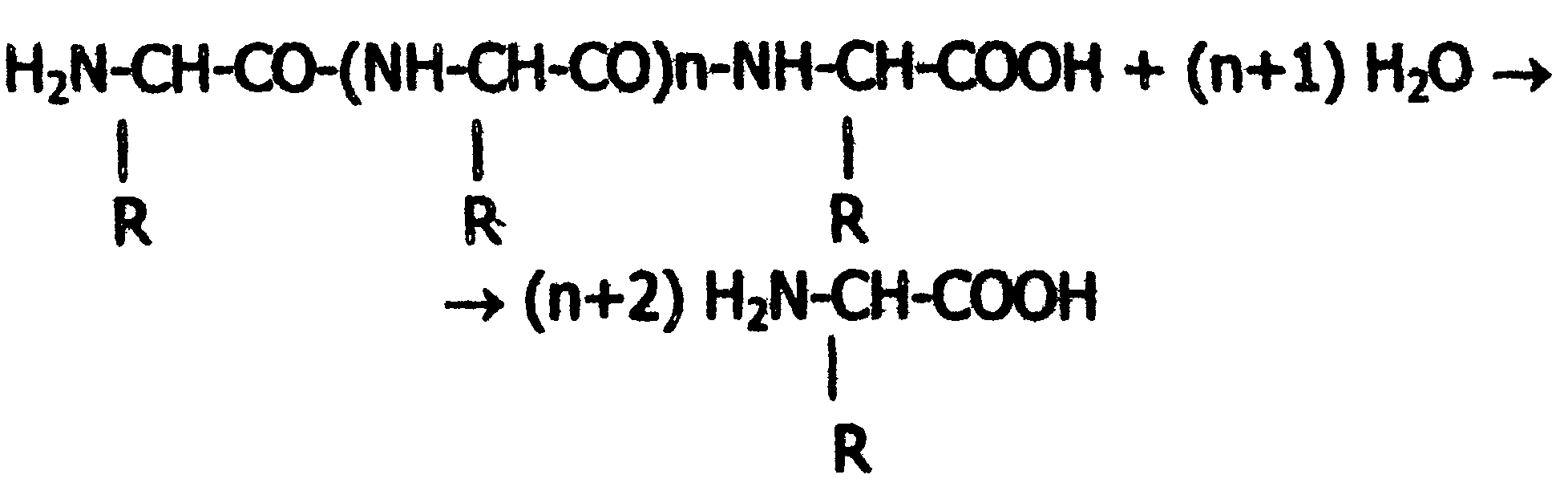 В нейтральной среде эта реакция протекает очень медленно, но ускоряется в присутствии кислот или щелочей. Обычно гидролиз белков проводят в запаянной ампуле в 6М растворе соляной кислоты при 105 °С; в таких условиях полный распад происходит примерно за сутки. В некоторых случаях белок гидролизуют в более мягких условиях (при температуре 37-40 °С) под действием биологических катализаторов-ферментов в течение нескольких часов. Затем аминокислоты гидролизата разделяют методом хроматографии на ионообменных смолах (сульфополистирольный катионит), выделяя отдельно фракцию каждой аминокислоты. Для вымывания аминокислот с ионнообменной колонки используют буферы с возрастающим значением рН. Первым снимается аспартат, имеющий кислотную боковую цепь; аргинин с основной боковой цепью вымывается последним. Последовательность снятия аминокислот с колонки определяют по профилю вымывания стандартных аминокислот. Фракционированные аминокислоты определяют по окраске, образующейся при нагревании с нингидрином: 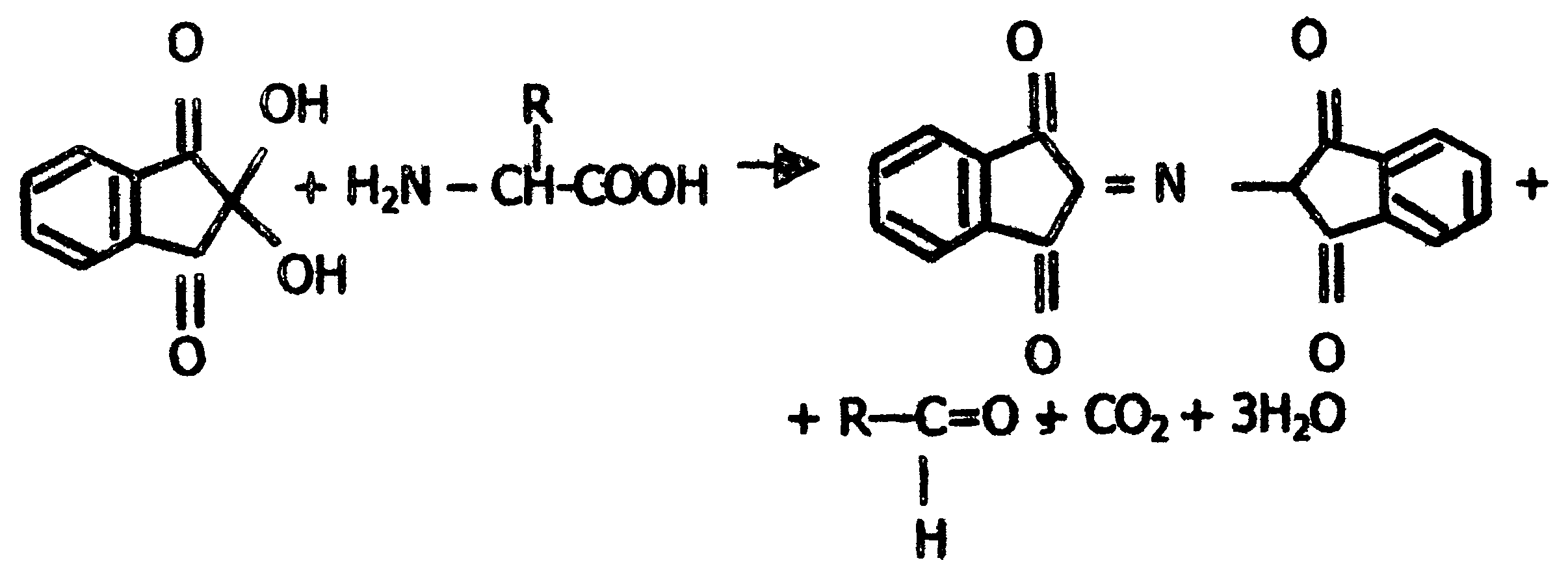 В этой реакции бесцветный нингидрин превращается; в синефиолетовый продукт, интенсивность окраски которого (при 570 нм) пропорциональна количеству аминокислоты (только пролин дает желтое окрашивание). Измерив, интенсивность окрашивания, можно рассчитать концентрацию каждой аминокислоты в гидролизате и число остатков каждой из них в исследуемом белке. В настоящее время такой анализ проводят с помощью автоматических приборов - аминокислотных анализаторов (см. ниже рис. Схемы прибора). Результат анализа прибор выдаёт в виде графика концентраций отдельных аминокислот. Этот метод нашел широкое применение в исследовании состава пищевых веществ , клинической практике; с его помощью за 2-3 часа можно получить полную картину качественного состава аминокислот продуктов и биологических жидкостей.  Рис. Схема аминокислотного анализатора: 1 - вымывающий раствор (буфер с переменным рН); 2 - хроматогрифическая колонка (в верхнюю часть колонки вносят гидролизат белка, затем начинают вымывание); 3 - раствор нингидрина; 4 - водяная баня (подогревание необходимо для ускорения реакции нингидрина с аминокислотами); 5 - спектрофотометр и записывающее устройство; 6 - хроматограмма, каждый пик которой соответствует одной аминокислоте, а площадь пика пропорциональна концентрации аминокислоты в гидролизате. 2.8. Уровни структурной организации белков В настоящее время экспериментально доказано существование четырёх уровней структурной организации белковой молекулы: первичной, вторичной, третичной и четвертичной структуры. Первичная структура Первичной структурой называют порядок чередования (последовательность) аминокислотных остатков в белке (См. стр. 25). В организме человека имеется тысячи разных белков, имеющих различную первичную структуру. Вторичная структура белков Пептидная цепь обладает значительной гибкостью. В результате внутрицепочечных взаимодействий она приобретает определённую пространственную структуру (конформацию), которая и называется вторичной. Вторичная структура белков стабилизируется за счёт образования водородных связей между карбонильной группой одного аминокислотного остатка и NH-группой другого: Чем больше образуется водородных связей, тем устойчивее вторичная структура. Но возможности пространственной укладки пептидной цепи ограничены тем, что пептидная связь имеет частично двойной характер и вращение вокруг неё невозможно. Атомы водорода и кислорода пептидной группы занимают транс-положение. Напротив, в области связей между пептидными группами и α-углеродными атомами возможно свободное вращение: 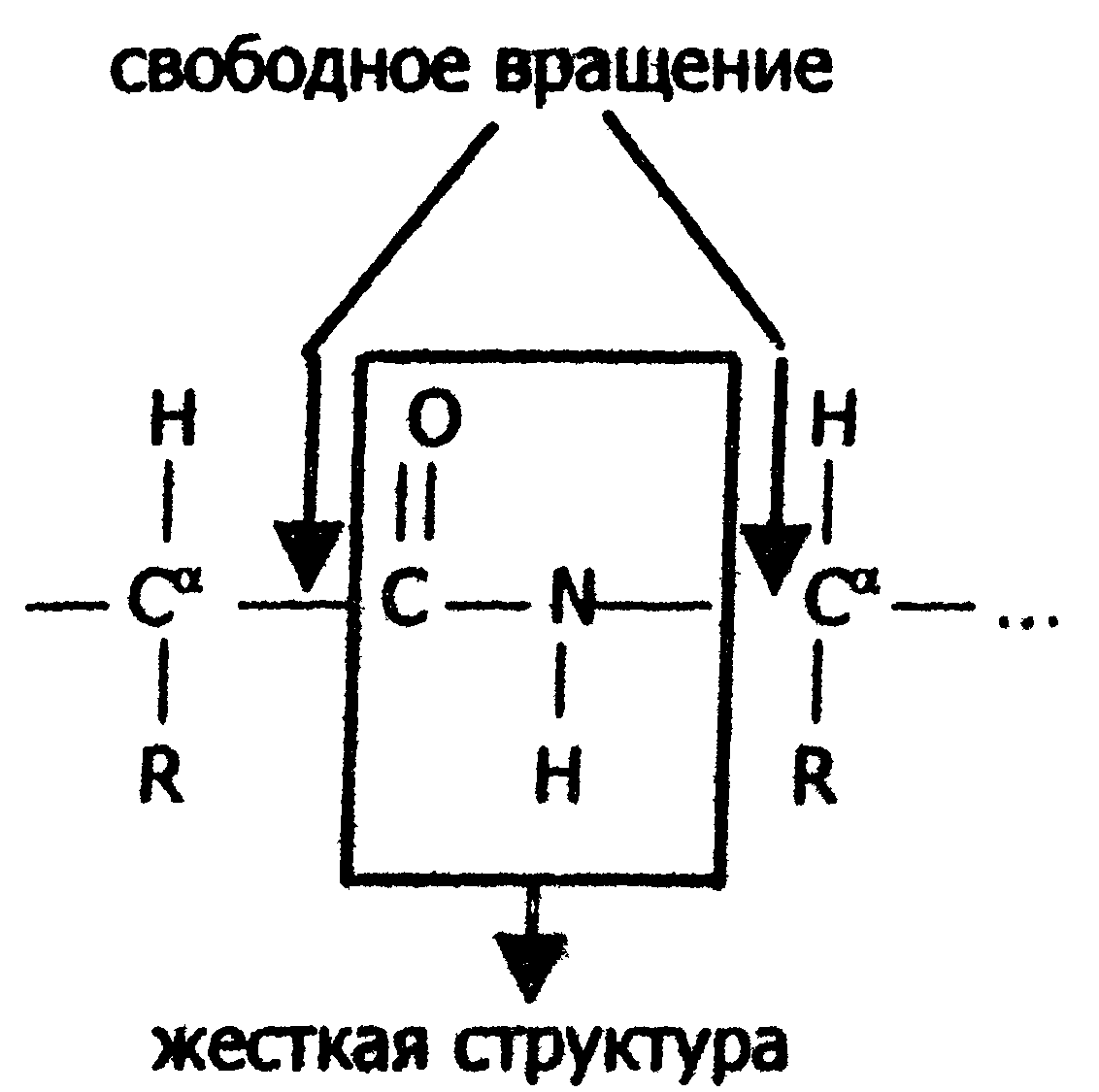 Вследствие этих ограничений при образовании водородных связей полипептидная цепь принимает не произвольную, а определенную конформацию. Известны три основных типа вторичной структуры белков: α-спираль, β-структура (складчатый слой) и беспорядочный клубок. В α-спирали NH-группа данного остатка аминокислоты взаимодействует с С=О-группой четвертого от него аминокислотного остатка. В результате образуется спираль, закрученная по часовой стрелке вследствие L-аминокислотного состава белков и содержащая на каждый виток 3,6 аминокислотных остатка. На один аминокислотный остаток приходится 0,15 нм, угол подъема спирали равен 26 градусов (рис. ниже). Витки спирали связаны водородными связями, ориентированными вдоль оси спирали, α-радикалы направлены наружу. Различные белки имеют различную степень спирализации: отношение числа аминокислот в спирали к общему числу минокислот в белке. В складчатом слое (β-структуре) пептидные цепи (или отдельные участки одной цепи) располагаются параллельно друг другу в один слой, образуя фигуру, подобную листу, сложенному гармошкой. Причём возможны варианты β-структур: они могут быть образованы параллельными цепями (N-концы целей направлены в одну и ту же сторону, (рис.ниже,а) и антипараллельными (N-концы направлены в разные стороны) (рис ниже,б). Как правило, вторичная структура белковой молекулы содержит и α-, и β-участки, а также участки, не имеющие какой-либо правильной организации, называемые "беспорядочным" клубком. В этих участках полипептидная цепь сравнительно легко изгибается, меняя конформацию, в отличие от более жёстких структур α- и β-участков. 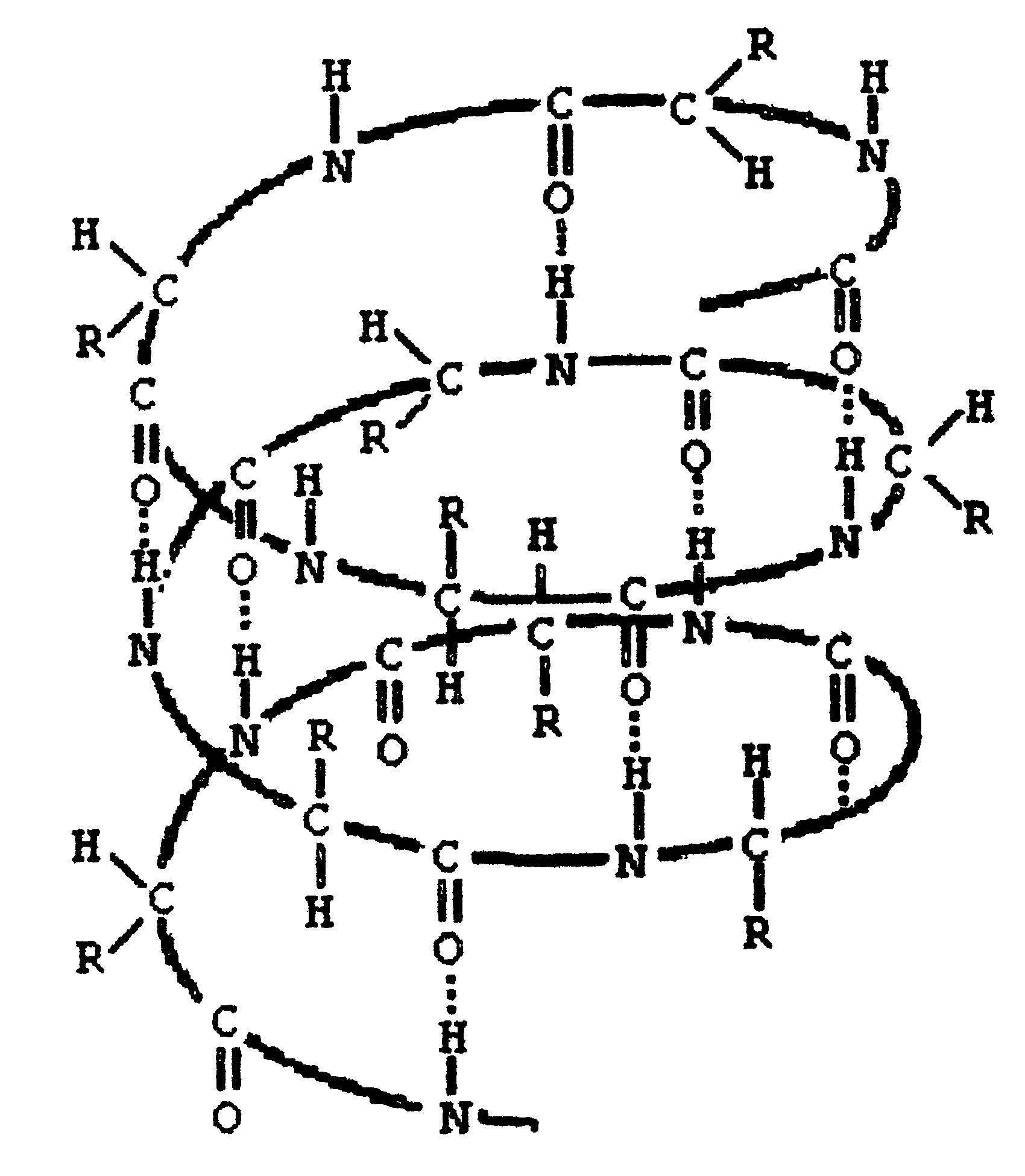 Рис. Схема α-спирали 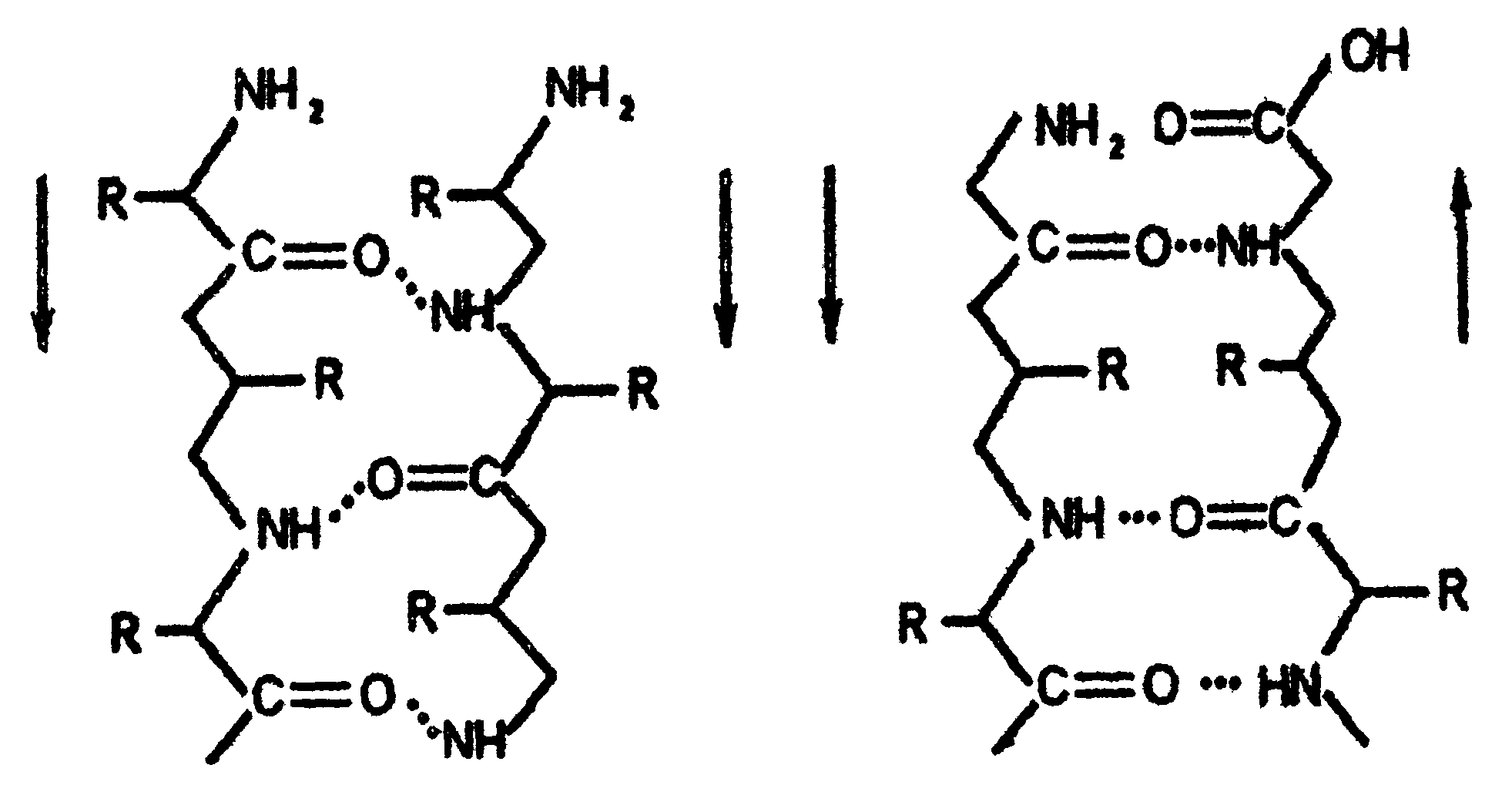
Рис. Схемы β-структур: а-параллельные цепи; б- антипараллельные цепи Третичная структура белков Третичной структурой белка называется способ укладки в пространстве полипептидной цепи, имеющей определённую вторичную структуру. По форме молекулы и особенностям пространственной структуры белки делятся на две группы: глобулярные и фибриллярные. Форма первых близка к сферической или эллипсоидной, с отношением короткой и длинной осей до 1:50. Молекулы фибриллярных белков имеют удлинённую форму (форма нити, палочки) и соотношение осей 1: (75-200). Третичная структура глобулярных белков стабилизируется в основном за счёт образования ковалентных дисульфидных связей между радикалами цистеина: 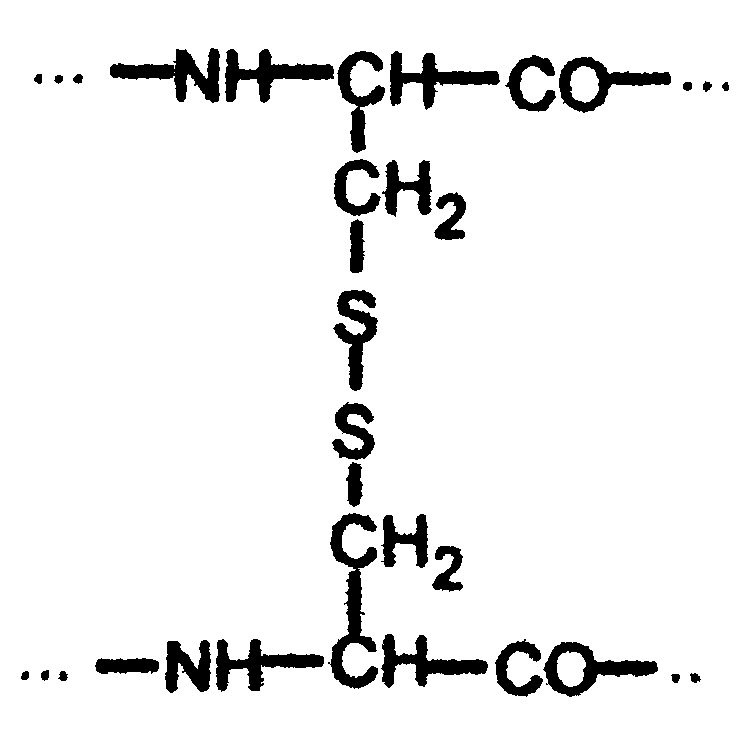 Дополнительный вклад также вносят слабые нековалентные связи: гидрофобные - между неполярными радикалами; водородные - между полярными радикалами; ионные - между заряженными радикалами (рис. 7). 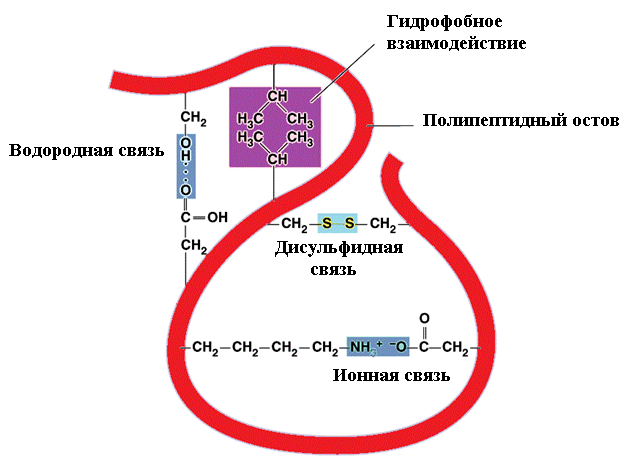 Рис.7. Связи, стабилизирующие третичную структуру белков Третичная структура белка после его синтеза в рибосомах возникает автоматически и предопределяется первичной структурой белка. Третичная структура глобулярного белка (рис.8а) не является абсолютно жёсткой, в известных пределах возможен разрыв некоторых слабых нековалентных связей и образование новых: глобула как бы пульсирует в растворе. Структурная организация фибриллярных белков имеет ряд особенностей по сравнению с глобулярными. Фибриллярные белки составляют основную массу соединительной ткани в организме человека и животных. Коллаген - самый распространённый фибриллярный белок, он составляет 1/3 часть от всех белков в организме человека. Эластин, который по сравнению с коллагеном более эластичен, содержится в тканях, испытывающих периодическое растяжение и сокращение: кровеносные сосуды, лёгкие, некоторые связки суставов. α-Кератины входят в состав эпидермиса кожи, волос, ногтей. Фибриллярные белки построены из трёх пептидных цепей (в каждой около 1000 аминокислотных остатков), каждая из которых имеет конформацию спирали, отличную от α-спирали (за исключением α-кератинов). Эти три спирали в молекуле коллагена перевиты друг с другом, образуют плотный жгут за счет водородных связей между цепями и внутри цепей. Молекулы коллагена, соединяясь «бок о бок», образуют микрофибриллы, из последних формируются более толстые - макрофибриллы, а из них - волокна и пучки волокон. Аналогичную структуру имеют α-кератины. В одном волосе, например, содержатся сотни макрофибрилл α-кератина, ориентированных по длине волоса. Фибриллярные белки имеют специфический аминокислотный состав. Например, в коллагене каждая третья аминокислота - глицин, 20%- остатки пролина и гидроксипролина, 10%- аланина и 40%- остальные аминокислоты. Если первичная структура белков даёт возможность предсказать конформацию молекулы, то есть её вторичную и третичную структуры, то третичная структура содержит информацию иного рода, а именно функциональную. Все биологические свойства белков связаны с сохранностью его третичной структуры, которую называют нативным белком. Любые воздействия, приводящие к нарушению этой конформации, сопровождаются полной или частичной потерей белком его биологических свойств. Четвертичная структура белков Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру. К ним относятся, например, миоглобин - белок мышечной ткани, ряд ферментов (лизоцим, пепсин, трипсин и так далее). Однако некоторые белки построены из нескольких полипептидных цепей, каждая из которых имеет первичную, вторичную и третичную структуры. Для таких белков введено понятие четвертичной структуры, которая представляет собой организацию нескольких полипептидных цепей в функциональную единую молекулу белка (рис.8б). Такой белок с четвертичной структурой называется олигомером или мультимером, а его полипептидные цепи - протомерами или субъединицами. Стабилизируют четвертичную структуру такие же связи, как и - третичную. Протомеры соединяются в мультимеры по принципу комплементарности - универсальному принципу живой природы. Расположение групп, образующих связи, на одном протомере соответствует их расположению на другом протомере. Принцип комплементарности лежит в основе процесса самосборки олгимерных белков.
Рис. 8. Схема третичной (а) и четвертичной (6) структуры белка При четвертичном уровне организации белки сохраняют основную конфигурацию третичной структуры (глобулярную или фибриллярную). Например, белки волос и шерсти имеют фибриллярную конформацию четвертичной структуры. Примером глобулярного мультимера может служить гемоглобин, состоящий из четырёх субъединиц глобулярного характера: двух α- и двух β-цепей. Его строение кратко можно представить формулой 2α2β. Под действием мочевины происходит обратимая диссоциация гемоглобина: 2α2β = 2α + 2β = α + α + β + β, либо 2α2β = αβ + αβ = α + α + β + β димеры протомеры Отдельные протомеры биологически неактивны, именно четвертичная структура обеспечивает ряду белков их специфические функции. Число протомеров в мультимерах всегда чётное, а молекулярные массы более 1млн. Да. Классическим примером мультимерной молекулы является вирус табачной мозаики с молекулярной массой около 40 млн. Да, состоящий из одной молекулы РНК и 2130 белковых субъединиц. 2.9. Физико-химические свойства белков Белки имеют различные химические, физические и биологические свойства, которые определяются аминокислотным составом и пространственной организацией каждого белка. Химические реакции белков очень разнообразны, они обусловлены наличием NH2-, СООН-групп и радикалов различной природы. Это реакции нитрования, ацилирования, алкилирования, этерификации, окисления-восстановления и другие. Белки обладают кислотно-основными, буферными, коллоидными и осмотическими свойствами. Кислотно-основные свойства белков Белки являются амфотерными полиэлектролитами, т.е. проявляют как кислотные, так и основные свойства. Это обусловлено наличием в молекулах белков аминокислотных радикалов, способных к ионизации, а также свободных α-амино- и α-карбоксильных групп на концах пептидных цепей. Кислотные свойства белку придают кислые аминокислоты (аспарагиновая, глутаминовая), а щелочные свойства - основные аминокислоты (лизин, аргинин, гистидин). Заряд белковой молекулы зависит от ионизации кислых и основных групп аминокислотных радикалов. В зависимости от соотношения отрицательных и положительных групп молекула белка в целом приобретает суммарный положительный или отрицательный заряд. При подкислении раствора белка степень ионизации анионных групп снижается, а катионных повышается; при подщелачивании - наоборот. При определенном значении рН число положительно и отрицательно заряженных групп становится одинаковым, возникает изоэлектрическое состояние белка (суммарный заряд равен 0). Значение рН, при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой и обозначают pI, аналогично аминокислотам. Для большинства белков pI лежит в пределах 5,5-7,0, что свидетельствует о некотором преобладании в белках кислых аминокислот. Однако есть и щелочные белки, например, сальмин - основной белок из молок семги (pl=12). Кроме того, есть белки, у которых pI имеет очень низкое значение, например, пепсин - фермент желудочного сока (pl=l). В изоэлектрической точке белки очень неустойчивые и легко выпадают в осадок, обладая наименьшей растворимостью. Если белок не находится в изоэлектрическом состоянии, то в электрическом поле его молекулы будут перемещаться к катоду или аноду, в зависимости от знака суммарного заряда и со скоростью, пропорциональной его величине; в этом заключается сущность метода электрофореза. Этим методом можно разделять белки с различным значением pI. Белки хотя и обладают свойствами буфера, но емкость их при физиологических значениях рН ограничена. Исключение составляют белки, содержащие много гистидина, так как только радикал гистидина обладает буферными свойствами в интервале рН 6-8. Таких белков очень мало. Например, гемоглобин, содержащий почти 8% гистидина, является мощным внутриклеточным буфером в эритроцитах, поддерживая рН крови на постоянном уровне. Растворимость белков Полярные группы белков способны взаимодействовать с водой (гидратироваться), а также с низкомолекулярными органическими соединениями и ионами (с этим свойством связана транспортная функция белков). Количество воды, связанной с белком, достигает 30-50 г на 100 г белка. Гидрофильных полярных групп значительно больше на поверхности белковой глобулы, чем внутри ее, эти группы образуют так называемую гидратную оболочку белковой молекулы. Но есть и гидрофобные белки, они нерастворимы в воде, но растворяются в жирах (липидах) и встречаются в основном в клеточных мембранах. Растворимость белков зависит от количества гидрофильных (полярных) групп, от размеров и формы молекул, от величины суммарного заряда, а также от наличия в растворе других растворенных веществ. Например, некоторые белки не растворяются в дистиллированной воде, но растворяются в присутствии небольшой концентрации нейтральных солей. При высоких концентрациях солей белки выпадают в осадок (высаливание), причем для осаждения различных белков требуется разное количество соли, что используется для фракционирования белков. Чаще всего для разделения белков методом высаливания используют сульфат аммония. После удаления соли (например, диализом) осажденный белок вновь растворяют, при этом сохраняются его нативные свойства. Растворимость белков зависит также от особенностей их структурной организации: глобулярные белки, как правило, лучше растворимы, чем фибриллярные. рН среды влияет на заряд белка, а, следовательно, на его растворимость. Растворимость и устойчивость белка минимальны при рН, соответствующем изоэлектрической точке белка. Между температурой и растворимостью белка строгой зависимости не имеется. Одни белки (глобулины, пепсин, фосфорилаза мышц) в водных или солевых растворах с повышением температуры растворяются лучше; другие (альдолаза мышц, гемоглобин и другие) - хуже. Денатурация и ренатурация При нагревании растворов белков до 60-80% или при действии реагентов, разрушающих нековалентные связи в белках, происходит разрушение третичной (четвертичной) и вторичной структуры белковой молекулы, она принимает в большей или меньшей степени форму беспорядочного случайного клубка. Этот процесс называют денатурацией. В качестве денатурирующих реагентов могут быть кислоты, щелочи, спирты, фенолы, мочевина, гуанидинхлорид и др. Сущность их действия в том, что они образуют водородные связи с =NH и =СО - группами пептидного остова и с кислотными группами радикалов аминокислот, подменяя собственные внутримолекулярные водородные связи в белке вследствие чего вторичная и третичная структуры изменяются. При денатурации падает растворимость белка, он "свертывается" (например, при варке куриного яйца), утрачивается биологическая активность белка. На этом основано, например, применение водного раствора карболовой кислоты (фенола) в качестве антисептика. В определенных условиях при медленном охлаждении раствора денатурированного белка происходит ренатурация - восстановление исходной (нативной) конформации. Это подтверждает тот факт, что характер укладки пептидной цепи определяется первичной структурой. 2.10. Классификация белков Строгой номенклатуры и классификации белков до сих пор не существует. Названия белков дают по случайным признакам, чаще всего принимая во внимание источник выделения белка или же учитывая растворимость его в тех или иных растворителях, форму молекулы и др. Классификация белков проводится по составу, по форме частиц, по растворимости, по аминокислотному составу, по происхождению и т.д. 1. По составу белки делят на две большие группы: простые и сложные белки. К простым (протеинам) относят белки, дающие при гидролизе только аминокислоты (протеиноиды, протамины, гистоны, проламины, глутелины, глобулины, альбумины). В качестве примеров простых белков могут служить фиброин шелка, яичный сывороточный альбумин, пепсин и др. К сложным (к протеидам) относят белки, составленные из простого белка и добавочной (простетической) группы небелковой природы. Группу сложных белков делят на несколько подгрупп в зависимости от характера небелкового компонента: - металлопротеиды, содержащие в своем составе металлы (Fe, Си, Mg и др.), связанные непосредственно с полипептидной цепью; - фосфопротеиды - содержат остатки фосфорной кислоты, которые сложноэфирными связями присоединены к молекуле белка по месту гидроксильных групп серина, треонина; - гликопротеиды - их простетическими группами являются углеводы; - хромопротеиды - состоят из простого белка и связанного с ним окрашенного небелкового соединения, все хромопротеиды биологически очень активны; в качестве простетических групп в них могут быть производные порфирина, изоаллоксазина и каротина; - липопротеиды - простетическая группа липиды - триглицериды (жиры) и фосфатиды; - нуклеопротеиды - белки, состоящие из простого белка и соединенной с ним нуклеиновой кислоты. Эти белки играют колоссальную роль в жизнедеятельности организма и будут рассмотрены ниже. Они входят в состав любой клетки, некоторые нуклеопротеиды существуют в природе в виде особых частиц, обладающих патогенной активностью (вирусы). 2. По форме частиц - белки делят на фибриллярные (нитеподобные) и глобулярные (сферические) (см. стр 30). 3. По растворимости и особенностям аминокислотного состава выделяют следующие группы простых белков: - протеиноиды - белки опорных тканей (костей, хрящей, связок, сухожилий, волос, ногтей, кожи и т.д.). Это в основном фибриллярные белки с большой молекулярной массой (> 150000 Да), нерастворимые в обычных растворителях: воде, солевых и водно-спиртовых смесях. Они растворяются только в специфических растворителях; - протамины (простейшие белки) - белки, растворимые в воде и содержащие 80-90% аргинина и ограниченный набор (6-8) других аминокислот, представлены в молоках различных рыб. Вследствие высокого содержания аргинина имеют основные свойства, их молекулярная масса сравнительно мала и примерно равна 4000-12000 Да. Они являются белковым компонентом в составе нуклеопротеидов; - гистоны - хорошо растворимы в воде и разбавленных растворах кислот (0,1Н), отличаются высоким содержанием аминокислот: аргинина, лизина и гистидина (не менее 30%) и поэтому обладают основными свойствами. Эти белки в значительных количествах содержатся в ядрах клеток в составе нуклеопротеидов и играют важную роль в регуляции обмена нуклеиновых кислот. Молекулярная масса гистонов невелика и равна 11000-24000 Да; - глобулины - белки, нерастворимые в воде и солевых растворах с концентрацией соли более 7%. Глобулины полностью осаждаются при 50%-ном насыщении раствора сульфатом аммония. Эти белки отличаются высоким содержанием глицина (3,5%), их молекулярная масса > 100000 Да. Глобулины - слабокислые или нейтральные белки (р1=6-7,3); - альбумины - белки, хорошо растворимые в воде и крепких солевых растворах, причем концентрация соли (NH4)2S04 не должна превышать 50 % от насыщения. При более высокой концентрации альбумины высаливаются. По сравнению с глобулинами эти белки содержат глицина в три раза меньше и имеют молекулярную массу, равную 40000-70000 Да. Альбумины имеют избыточный отрицательный заряд и кислые свойства (pl=4,7) из-за большого содержания глутаминовой кислоты; - проламины - группа растительных белков, содержащаяся в клейковине злаковых растений. Они растворимы только в 60-80%-ном водном растворе этилового спирта. Проламины имеют характерный аминокислотный состав: в них много (20-50%) глутаминовой кислоты и пролина (10-15%), в связи с чем они и получили свое название. Их молекулярная масса более 100000 Да; - глютелины - растительные белки нерастворимые в воде, растворах солей и этаноле, но растворимы в разбавленных (0,1Н) растворах щелочей и кислот. По аминокислотному составу и молекулярной массе сходны с проламинами, но аргинина содержат больше, а пролина меньше. 2.11. Методы выделения и очистки белков Последовательность операций по выделению белков обычно сводится к измельчению биологического материала, экстрагированию белков (т.е. переводу их в растворенное состояние) и, наконец, выделению исследуемого белка из смеси других белков, т.е. очистке и получению индивидуального белка. Все операции проводят при температуре, близкой к 0°С и не применяют сильных кислот и оснований, чтобы избежать денатурации. Исходный биологический материал измельчают при помощи ножевых или пестиковых гомогенизаторов, часто используют валковые или шаровые мельницы. Кроме того, применяется метод попеременного замораживания и оттаивания ткани, в основе разрушающего действия которого лежат разрывы клеточной оболочки, вызванные кристалликами льда. Для разрушения тканей используют также ультразвук, пресс-методы и метод "азотной бомбы", который заключается в насыщении клеток азотом под высоким давлением, а затем резким сбрасыванием давления - выделяющийся газообразный азот как бы "взрывает" клетки. Измельченную ткань заливают экстрагентом, в качестве, которого используют 8-10% растворы солей, буферные смеси, органические растворители, а также неионные детергенты - вещества, нарушающие гидрофобные взаимодействия между белками и липидами, между белковыми молекулами. Однако ими пользуются осторожно, чтобы не нарушить третичную (четвертичную) структуру белков. Из органических соединений используют водные растворы глицерина и слабые растворы сахарозы. Так как растворению и стабилизации белков способствуют кислые и слабощелочные среды, то в качестве буферных смесей используют фосфатные, цитратные, боратные буферные смеси. Нерастворимые части ткани осаждают центрифугированием. В надосадочной жидкости содержатся растворимые белки. Главная трудность выделения индивидуального белка в его отделении от остальных белков, так как все белки обладают сходными свойствами и их разделение основано на небольших различиях в свойствах разных белков. Рассмотрим ряд методов выделения белков. 1. Избирательная денатурация. Многие белки денатурируются и выпадают в осадок при нагревании раствора до 50-70 °С или при подкислении до рН ≈ 5. Если выделяемый белок выдерживает эти условия, то часть посторонних белков можно удалить из раствора таким способом. 2. Высаливание представляет собой процесс осаждения белков из раствора при добавлении различных солей. Чаще всего используют зависимость растворимости белков от концентрации сульфата аммония. Если в раствор добавить небольшое количество (NH4)2SO4, (например, 10г на 100мл раствора), то наименее растворимые белки выпадут в осадок. Осадок отделяют центрифугированием, а к надосадочной жидкости добавляют еще 10 г (NH4)2S04 и получают второй осадок. Продолжая эту процедуру, получают ряд фракций: в одной из них содержание искомого белка больше, чем в других. 3. Методы ионно-обменной хроматографии и электрофореза основаны на различиях в количестве и природе ионогенных групп аминокислотных радикалов. Для хроматографии белков применяют ионообменники на основе целлюлозы или других гидрофильных полимеров. Электрофорез применяют в различных вариантах. Наиболее простой из них - электрофорез на бумаге. Полоску фильтровальной бумаги пропитывают буферным раствором и включают ее в электрическую цепь с постоянным током. Процедуру проводят в герметически закрытой камере. Белки из электрофореграмме обнаруживают, обрабатывая полоску красителем, связывающимся с белками и образующим цветные соединения. После окончательного разделения белков на фракции, в зависимости от заряда белковой молекулы, отдельные белки вымывают (предварительно разрезав полоску на части) подходящим растворителем и осаждают. Для получения больших количеств очищенного белка вместо полоски бумаги в этом методе используют толстый блок какого-либо инертного материала - крахмала, целлюлозного порошка или полимеры, образующие гели - агар, полиакриламид. 4. Методы гель-фильтрации и ультрацентрифугирования основаны на различиях белков по молекулярной массе. Молекулярная масса белков достигает десятки и сотни тысяч атомных единиц массы (а.е.м., или Да). Обычные методы определения молекулярной массы - криоскопия и эбулиоскопия - для белков неприменимы. Для определения молекулярных масс белков разработаны специфические методы. Наиболее распространенный из них - метод ультрацентрифугирования, разработанный шведским ученым Сведбергом. Он основан на измерении скорости седиментации веществ. Во вращающемся роторе ультрацентрифуги центробежное ускорение достигает 100000-500000 g (g - ускорение свободного падения). На поверхность буферного раствора, налитого в кювету ультрацентрифуги, наносят тонкий слой раствора белка и кювету помещают в ротор. При вращении ротора более плотные, чем растворитель, молекулы белка перемещаются в направлении от оси вращения. Положение белковой зоны регистрируют специальной оптической системой по показателю преломления, который больше в зоне белка, чем в буферном растворе. На основании результатов центрифигурирования вычисляют коэффициент седиментации где х - расстояние от оси вращения до белковой зоны, см; t - время седиментации, с; dx/dt–скорость седиментации, см/с; ω- угловая скорость вращения ротора, рад/с. За единицу коэффициента седиментации условно принята величина 10-13 с, называемая сведбергом и обозначаемая "S". Молекулярная масса белка пропорциональна его коэффициенту седиментации, коэффициенту диффузии и плотности: Где R - универсальная газовая постоянная (8.314 Дж/град моль); Т - абсолютная температура опыта; S - коэффициент седиментации, с; О - коэффициент диффузии, см2/с; V - удельный парциональный объем молекулы белка, т.е. величина, обратная плотности молекулы, см3/г; р - плотность растворителя при данной температуре, г/см3. Более просто молекулярную массу белка можно определить методом гель-фильтрации, или молекулярного просеивания. Метод основан на применении специальных полимерных веществ (например, сефадекс), набухшие зерна которых имеют поры определенного размера. Небольшие молекулы легко проходят в эти поры, а диффузия крупных молекул затруднена. Это явление и лежит в основе разделения веществ методом гель-фильтрации. Принципиальная схема метода изображена на рисунке приведенном ниже, белковый раствор вместе с буфером перемещаются вдоль колонки между гранулами сефадекса. Белки проходят медленнее, чем буферный раствор, причем тем медленнее, чем меньше молекулярная масса белка, так как их молекулы легче диффундируют внутрь гранул сефадекса. В результате в колонке образуются отдельные зоны белков: чем ниже расположена зона, тем больше молекулярная масса белка. Белковые фракции, различающиеся молекулярной массой, собирают в отдельные пробирки и идентифицируют хроматографически. Между объемом вымывания (объем буфферного раствора, затраченный на вымывание из колонки данной фракции - V, мл) и логарифмом молекулярной массы (IgM) - линейная зависимость (см. рис.9,б). Предварительно колонку калибруют, пропуская через нее растворы стадартных белков с известной молекулярной массой. 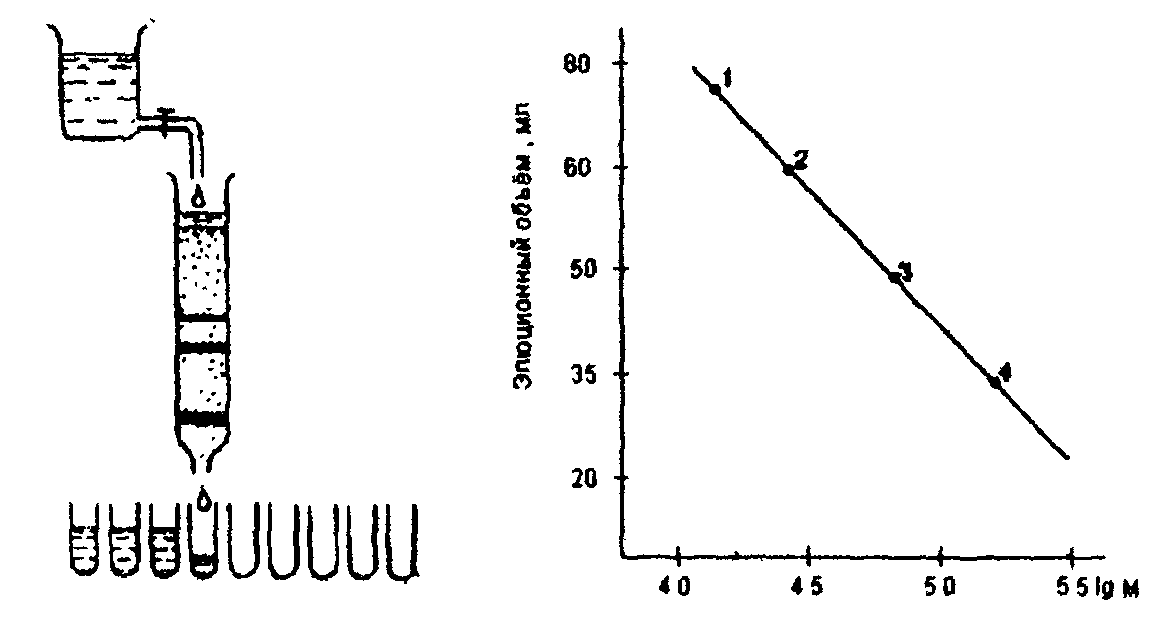 Очистка белков Белки, всегда содержат некоторое количество низкомолекулярных примесей, особенно ионов солей. Для полного освобождения от этих примесей белки подвергают дальнейшей очистке путем диализа, электродиализа, кристаллизации и перекристаллизации. Метод диализа состоит в длительном (сутки и больше) пропускании воды через сосуд, в который погружен диализационный мешочек с раствором белка. Его делают из материалов, хорошо проницаемых для маленьких молекул и ионов, но не пропускающих большие молекулы белка. К таким материалам относят целлофан, коллодиевую пленку и др. Таким образом, происходит вымывание низкомолекулярных примесей из раствора белка через диализационный материал, внутри остается белок. Затем диализ продолжают еще 1-3 суток дистиллированной водой. Но даже после диализа на поверхности белковых молекул могут оставаться частично ионы. Потому далее полученный раствор белка подвергают электродиализу: против мембран диализационной камеры (мешочка) помещают электроды, на которые подают напряжение, в результате чего в омывающую мембраны воду уходят остатки ионов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||