Основная цель лабораторных занятий связать теоретиче
 Скачать 131.07 Kb. Скачать 131.07 Kb.
|
Опыт 3. Образование и реакции амминокомплекса меди.Поместить в две пробирки по 10 капель раствора сульфата меди(II). В первую пробирку добавить 2 капли раствора соли бария. Во вторую пробирку внести кусочек гранулированного олова и на- блюдать выделение на его поверхности красноватого налета меди. Получить комплексное соединение меди, для чего поместить в пробирку несколько капель раствора сульфата меди(II) и по кап- лям добавлять концентрированный раствор гидроксида аммония. Наблюдать растворение выпавшего вначале осадка гидроксида ме- ди(II) и изменение цвета раствора при образовании комплексного сульфата тетраамминомеди(II). Полученный раствор разделить в две пробирки и провести те же два опыта, которые были проделаны с раствором сульфата меди(II). Написать уравнения всех проведенных реакций в молеку- лярной и ионно-молекулярной формах. Опыт 4. Получение тетраиодовисмутата калия. В пробир- ку к 3 – 4 каплям раствора нитрата висмута(III) прибавлять по кап- лям раствор иодида калия до выпадения темно-бурого осадка иодида висмута(III). Растворить этот осадок в избытке раствора иодида ка- лия и отметить цвет полученного раствора. Написать уравнения всех проведенных реакций в молекулярной и ионно-молекулярной фор- мах. Опыт 5. Получение комплексного аниона иодида рту- ти(II). Налить в пробирку 3 − 4 капли раствора нитрата ртути(II) и добавить 1 − 2 капли раствора иодида калия. Отметить цвет обра- зующегося осадка иодида ртути(II). В пробирку по каплям добавить избыток раствора иодида калия до полного растворения полученно- го осадка, которое обусловлено образованием в растворе комплекс- ных анионов тетраиодомеркурата. Отметить цвет полученного рас- 15 твора. Этот анион можно выделить в осадок ионами серебра: в про- бирку добавить 1 – 2 капли раствора нитрата серебра(I). Отметить цвет осадка. Записать уравнения всех реакций в молекулярной и ионно-молекулярной формах. Примечание: соли ртути ядовиты. Поэтому опыт проводить осторожно и затем тщательно вымыть руки. Опыт 6. Образование гидроксокомплекса цинка(II). В пробирку налить 3 − 4 капли раствора сульфата цинка(II) и добавить по каплям раствор гидроксида натрия, находящийся в штативе с ре- активами, до выпадения осадка гидроксида цинка(II). Затем в вы- тяжном шкафу добавить по каплям 6 н раствор гидроксида натрия до полного растворения осадка вследствие образования комплексно- го аниона тетрагидроксоцинка(2−). Составить уравнения реакций в молекулярной и ионно-молекулярной формах. Опыт 7. Внутрикомплексные соединения. В 3 пробирки внести по 3 капли раствора хлорида железа(III). Одну оставить в ка- честве контрольной. В две другие добавить по 3 капли раствора ще- лочи. К образовавшемуся осадку в одну из них добавить 12 – 15 ка- пель 2 н щавелевой кислоты, в другую – столько же 2 н лимонной кислоты СН2(СООН)–С(ОН)СООН–СН2(СООН). В обе пробирки и в контрольную внести 1 – 2 капли раствора роданида калия или аммо- ния, который образует с ионами Fe3+ ярко окрашенный роданид же- леза Fe(SCN)3. Отметьте цвет полученных растворов. При растворе- нии гидроксида железа (III) в щавелевой и лимонной кислотах обра- зуются внутрикомплексные соединения, в которых карбоксильные группы кислот присоединяются к комплексообразователю. Для ща- велевокислого комплекса формула имеет вид:  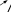 O =С–O HO–С= O O =С–O HO–С= OO= С–OH  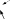 Fe FeO– С=O .   O O O O  С С С СO OH 16 Реакциисучастием комплексных соединений, несопровождающиесяразрушениемкомплексногоиона Это реакции обмена, в которых комплексные ионы ведут се- бя аналогично анионам кислородсодержащих кислот, таким как SO2 , CO2 и т.п. 4 3 |
