варя. Ведёрников 2. Основные сведения из гидравлики
 Скачать 4.59 Mb. Скачать 4.59 Mb.
|
§ 9. Термодинамические процессы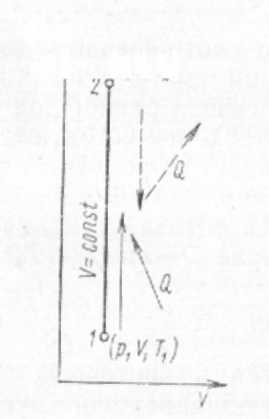 Термодинамическим процессом называется изменение термодинамической системы (газа) в результате взаимодействия ее с внешней средой. Рис. 1. Изохорный процесс изменения состояния газа 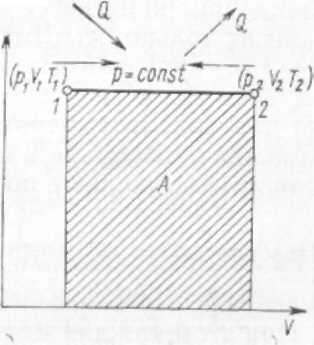 Рис. 2. Изобарный процесс изменения состояния газа Переход газа из начального состояния в конечное всегда осуществляется через множество промежуточных состояний. Совокупность точек, соответствующих на графике этим состояниям, образует линию, которая служит графическим изображением процесса в системе координат р—V. В зависимости от того, в каких условиях происходит переход газа из начального состояния в конечное, различают следующие термодинамические процессы: изохорный, изобарный, изотермический, адиабатный, политропный. Изохорный процесс характеризуется тем, что переход газа из одного состояния в другое происходит без изменения удельного объема. В системе р—V координат этот процесс изображается ли- нией J—2, параллельной оси ординат (рис. 1). Эта линия называется изохорой. В изохорном процессе газ не совершает внешней работы потому, что его объем не изменяется. Все подведенное количество теплоты идет на увеличение внутренней энергии газа, на повышение его температуры. В процессе 1—2 теплота подводится к газу, а в процессе 2—1 — отводится. Математическое выражение процесса: P2/P1 = T2/T1 или p/T = R/V = const. 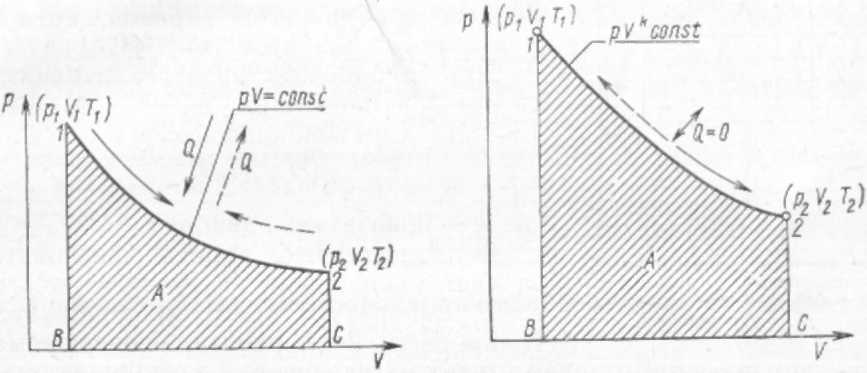 Рис. 3. Изотермический процесс Рис. 4. Адиабатный процесс измс- изменения состояния газа нения состояния газа Изобарный процесс — это термодинамический процесс, протекающий при постоянном давлении. Линия 1—2, изображающая этот процесс, параллельна оси абсцис и называется изобарой (рис. 2). Работа Л в изобарном процессе измеряется площадью прямоугольника, высота которого р, а основание V2—V1. В изобарном процессе количество теплоты, сообщенное газу, идет на увеличение внутренней энергии и на совершение внешней работы. В процессе 1—2 теплота к газу подводится, газ увеличивает объем и совершается работа против внешних сил. В процессе 2—1 теплота от газа отводится, объем газа уменьшается, и внешние силк совершают над газом работу, при этом газ охлаждается. Математическое выражение процесса: V1/V2= T2/T1 или- V/T =R/p=const. Изотермический процесс протекает при постоянной температуре. Его уравнение: pV = const или p2/p1= V1/V2 В системе координат р—V процесс изображается равнобокой гиперболой, которая называется изотермой (рис. 3). Работа Л в изотермическом процессе измеряется площадью, ограниченной изотермой 1—2, ординатами 1—В и 2—С, отрезком абсциссы ВС. В изотермическом процессе 1—2 температура газа не изменяется, поэтому его внутренняя энергия также не изменяется, а все 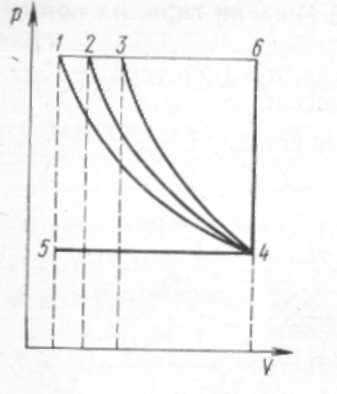 подведенное количество теплоты расходуется на совершение внешней работы. В процессе 2—1 внешние силы совершают над газом работу, при этом теплота полностью отводится от газа. Адиабатный процесс характеризуется отсутствием теплообмена с окружающей средой. В системе координат р—V этот процесс изображается кривой, которая называется адиабатой (рис. 4). При адиабатном процессе изменяются все три параметра: р, V, Т. Математическое выражение процесса: pVR = const, где R — показатель адиабаты. Рис. 5. Термодинамические процессы: 1-4-изотермический 2-4-политропный 3-4-адиабатный 5-4-изобарный 6-4-изохорный В процессе 1—2 работа совершается за счет уменьшения внутренней энергии газа, температура при этом понижается. В процессе 2—1 работа, совершаемая над газом внешними силами, идет на увеличение внутренней энергии, на повышение его температуры. На диаграмме р—V работа Л в адиабатном процессе показана заштрихованной площадкой. Политропный процесс характеризуется тем, что он протекает с изменением всех параметров состояния газа и при наличии теплообмена с внешней средой. Кривая, изображающая политропный процесс, называется политропой. Математическое выражение процесса: р Vn = const, где п — показатель политропы. На рис. 5 для сравнения показаны все термодинамические процессы. § 10. Второй закон термодинамики Основное назначение термодинамических процессов, протекающих в любом тепловом двигателе, состоит в том, чтобы превращать теплоту, подводимую к рабочему телу (газу), в полезную работу, которую газ совершает в процессе своего расширения. Но построить машину, в которой бы газ только расширялся, невозможно. Поэтому во всех тепловых машинахпосле расширения газа происходит его сжатие и возвращение в первоначальное состояние. Процессы, в результате которых рабочее тело, проходя последовательно различные состояния, возвращается в первоначальное, называют круговыми или циклическими. В системе p—V координат термодинамический цикл изображается замкнутым контуром. Если линия расширения в этом контуре лежит выше линий сжатия, то цикл протекает по направлению вращения часовой стрелки и называется прямым. Прямые циклы — это циклы тепловых двигателей. Термодинамический цикл может протекать и в обратном направлении. В этом случае линия расширения лежит ниже линии сжатия. Такие циклы называют обратными, и они являются циклами холодильных машин. Основной закон, которому подчиняются термодинамические циклы,- второй закон термодинамики. Он гласит, что процесс, при котором не происходит никаких изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, поэтому теплота не может перейти от холодного тела к горячему без каких-либо других изменений в термодинамической системе, например без затраты работы. Если обозначить через Q1 количество теплоты, подведенное к 1 кг рабочего тела в термодинамическом цикле, а через Q2 количество теплоты, отданное холодному источнику, то полезно использованное количество теплоты Q (Дж/кг), т. е. превращенное в полезную работу, будет Q = Ql-Q2. В 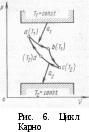 ажнейшей характеристикой термодинамического цикла служит отношение количества полезно использованной теплоты ко всей затраченной. Это отношение называется термическим КПД цикла и обозначается буквой ηt. ажнейшей характеристикой термодинамического цикла служит отношение количества полезно использованной теплоты ко всей затраченной. Это отношение называется термическим КПД цикла и обозначается буквой ηt.ηt=(Qi-Q2)/Q1 Термический КПД цикла всегда меньше единицы. При созданий тепловых машин стремятся, чтобы КПД был по возможности больше. Впервые экономичность термодинамических циклов проанализировал в прошлом веке французский инженер Карно. Он исследовал цикл, который занимает в термодинамике особое место и носит название цикла Карно. Цикл Карно (рис. 6) образован двумя изотермами и двумя адиабатами. Рабочее тело; параметры состояния которого соответствуют точке а в системе р—V координат, сообщается с источником теплоты. К телу подводится теплота при постоянной температуре Т1. Таким образом создаются условия для расширения рабочего тела, которое протекает по изотерме а—Ь. В ходе этого процесса к рабочему телу подводится количество теплоты Qi, его объем увеличивается, а давление уменьшается. Когда рабочее тело достигнет состояния, соответствующего точке Ь, его изолируют от источника теплоты, и дальнейшее расширение протекает без теплообмена с окружающей средой по адиабате 6—с. Температура рабочего тела понижается от Т1 до Т2. При состоянии, соответствующем точке с, рабочее тело сообщается с холодным источником (холодильником), и от него отводится теплота при постоянной температуре Т2. Создаются условия для изотермического сжатия. Процесс идет по изотерме с—d. От рабочего тела отводится количество теплоты Q2, после чего его контакт с холодным источником прекращается. Возвращение рабочего тела в состояние, соответствующее точке d, осуществляется в результате сжатия без теплообмена с окружающей средой по адиабате d— а. Карно доказал, что этот цикл является циклом максимальной экономичности. Не существует других термодинамических циклов, термический КПД которых был бы больше, чем КПД цикла Карно. Была также установлена чрезвычайно важная зависимость КПД тепловой машины от температуры T1, нагревателя и температуры Т2 холодильника. Независимо от конструкций и выбора рабочего тела максимальное значение КПД тепловой машины определяется выражением: ηmax=(T1- Т2)/ Т1 Цикл Карно — идеальный цикл. Его невозможно в точности осуществить в реальной тепловой машине, потому что нельзя обеспечить изотермический подвод и отвод теплоты, а также расширение и сжатие рабочего тела без теплообмена с окружающей средой. Тем не менее исследования Карно имеют большое значение. Они показали, что для повышения экономичности тепловых двигателей надо осуществлять подвод теплоты к рабочему телу при возможно более высокой температуре, а отвод —при возможно более низкой. § 11. Свойства водяного пара Водяной пар широко используют в качестве рабочего тела в поршневых паровых машинах и паровых турбинах, а также как теплоноситель в теплообменных аппаратах. Поэтому изучение свойств водяного пара занимает в термодинамике важное место. Пар получают двумя способами: испарением и кипением. Испарением называется процесс парообразования, происходящий только с поверхности жидкости. Испарение идет при любой температуре, причем интенсивность его увеличивается с повышением температуры. Кипение — интенсивный переход жидкости в пар, протекающий во всем объеме. Кипение происходит при строго определенной для каждой жидкости температуре, которая зависит от давления Чем выше давление, тем соответственно выше температура, при которой кипит жидкость. Температура кипения остается постоянной, пока вся жидкость не превратится в пар. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным. При равновесии устанавливается постоянная плотность пара, которая отвечает определенному давлению. Это давление называют упругостью насыщенного пара. Упругость насыщенного пара возрастает с повышением температуры. Состояние насыщенного пара очень неустойчиво. Малейшее изменение условий, в которых он находится, приводит либо к конденсации пара, либо к дополнительному парообразованию. Насыщенный пар может быть сухим и влажным. Пар, не содержащий в своем составе частиц жидкости, называют сухим насыщенным паром. Влажный насыщенный пар представляет собой механическую смесь сухого пара и мельчайших частиц жидкости. Количество теплоты, необходимое для превращения жидкости в пар при неизменной температуре, называют теплотой парообразования. С увеличением давления теплота парообразования уменьшается. Если к сухому насыщенному пару подводить теплоту при постоянном давлении, то температура его будет повышаться, объем увеличится и сухой насыщенный пар перейдет в состояние перегретого. Степень перегрева пара ∆t определяют разностью температур перегретого tП и насыщенного tH паров: ∆t = tП-tH Чем выше температура перегрева пара, тем ближе он по своим свойствам к идеальному газу. Водяной пар получают в паровых котлах различных размеров и типов. Так как экономичность тепловых двигателей повышается с увеличением температуры горячего источника, в паросиловых установках всегда используют перегретый пар. В настоящее время в нашей стране освоено изготовление паровых котлов большой производительности с температурой перегретого пара до 585°С. Перегрев пара осуществляется в пароперегревателях, в которые пар поступает из котла во влажном насыщенном состоянии. В пароперегревателях пар сначала подсушивается, т. е. из него полностью удаляется влага, а затем перегревается до заданной температуры. Промышленный технологический пар следует рассматривать как реальный газ, который подчиняется уравнению Ван-дер-Ваальса. Для каждого вещества существует так называемое критическое состояние, которое характеризуется критическим давлением рк и критической температурой tK. В этом состоянии плотность жидкости и ее насыщенного пара становятся одинаковыми; исчезает различие между жидкостью и ее насыщенным паром. Вещество, находящееся в критическом состоянии, является однофазным. Оно обладает свойствами газообразных и жидких тел одновременно. При температуре выше критической никаким повышением давления перегретый пар не может быть обращен в жидкость. |
