ОТВЕТЫ НА БИЛЕТЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ. Отдельное спасибо ребятам со второго потока лечебного факультета 2012 г
 Скачать 2.33 Mb. Скачать 2.33 Mb.
|
Характеристика фермента
2) Гормональная регуляция углеводного обмена. Гормоны, повышающие и понижающие уровень глюкозы в крови. Механизм их действия. Гормоны понижающие глюкозу – инсулин. Контринсулярные гормоны – адреналин, глюкагон, глюкокортикоиды, тироксин СТГ. Инсулин – анаболик, стимулирует синтез:
и тормозит их распад. Действие инсулина:
Адреналин:
Глюкагон:
СТГ:
Глюкокортикоиды:
Тироксин:
Синтез и секреция инсулина и глюкагона регулируются глюкозой. При повышении концентрации глюкозы в крови секреция инсулина увеличивается, а глюкагона – уменьшается. При пищеварении уровень инсулина высокий, а глюкагона – низкий. В постабсорбтивный период уровень инсулина низкий, а глюкагона – высокий. Концентрация глюкозы в крови в этих условиях поддерживается за счёт процессов распада гликогена в печени и глюконеогенеза. В течение 12-часового голодания гликоген печени – основной поставщик глюкозы. Низкий инсулин – глюкагоновый индекс вызывает активацию гликогенфосфорилазы и мобилизацию гликогена. Через сутки после последнего приёма пищи гликоген печени полностью исчерпан и глюконеогенез - единственный поставщик глюкозы в крови. 3) В крови снижено содержание мочевины. Нарушение какого метаболичес кого пути можно предположить, каковы возможные причины этих нарушений? Орнитиновый цикл,отсутствие ферментов Билет 19 1)Понятие об обмене веществ. Процессы анаболизма и катаболизма, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты. Обмен веществ и энергии - совокупность процессов превращения веществ и энергии в живых организмах и обмен веществами и энергией между организмом и окружающей средой. Обмен веществ включает 3 этапа: 1)поступление веществ в организм, 2)метаболизм, или промежуточный обмен, 3) выделение конечных продуктов обмена. Основные функции метаболизма: -извлечение энергии из окружающей среды (в форме химической энергии органических веществ), -превращение экзогенных веществ в строительные блоки, -Сборка белков, нуклеиновых кислот, жиров из строительных блоков, -синтез и разрушение тех биомолекул, которые необходимы для выполнения различных специфических функций данной клетки. Центральные метаболиты: -ацетил-КоА, -ПВК, -ЩУК, -ФГА. Катаболизм - ферментативный распад высокомолекулярных соединений до составляющих их мономеров и дальнейший распад мономеров до конечных продуктов: углекислого газа, аммиака, лактата. Главные реакции катаболизма – реакции окисления, поставляющие клетке энергию. Энергия может запасаться в двух формах: 1)АТФ, 2)НАДФН+Н - донор водорода в реакциях восстановления при синтезе ряда соединений. Анаболизм - ферментативный синтез основных макромолекул клетки, а также образование биологически активных соединений, требует затраты свободной энергии (АТФ, НАДФН+Н ). Отличия катаболизма и анаболизма: Катаболизм – распад, запасание АТФ / Анаболизм – синтез, но потребление АТФ. Пути не совпадают, разное число реакций. Отличаются по локализации. Разная генетическая и аллостерическая регуляция. Унификация питательных веществ идёт в три фазы: I . Подготовительная фаза. Высокомолекулярные соединения распадаются под действием гидролаз ЖКТ до мономеров. Протекает в ЖКТ и лизосомах. Не является поставщиком энергии (1%). II фаза. Превращение мономеров в простые соединения - центральные метаболиты (ПВК, ацетилКоА) эти продукты связывают 3 вида обмена, до 2-3 с, протекает в цитоплазме, завершается в митохондриях, даёт 20-30% энергии, поставляемой анаэробно III фаза. Цикл Кребса аэробные условия, полное окисление поступивших с пищей веществ, выделяется большое количество энергии и аккумулируется она в АТФ. Анаболический путь: 1 фаза. Синтез белков начинается с образования α-кетокислот. 2 фаза. Аминирование α-кетокислот, получение АМК. 3 фаза. Из АМК образуются белки Общий путь катаболизма: После образования ПВК дальнейший путь распада веществ до углекислого газа и воды происходит одинаково в общем пути катаболизма (ОПК). ОПК включает реакции окислительного декарбоксилирования ПВК и ЦТК. Реакции ОПК происходят в матриксе митохондрий и восстановленные коферменты передают водород на компоненты дыхательной цепи. Катаболические пути сходятся, вливаясь на третьей фазе в ЦТК. На первой фазе белки дают 20 АМК. На второй фазе 20 АМК дают ацетилКоА и аммиак. На третьей фазе ЦТК даёт углекислый газ, воду и энергию 2) Витамины РР и В2, структура, признаки витаминной недостаточности и участие в обмене веществ. B2 –Рибофлавин G 2-2,5 мг/сут Флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД) являются производными витамина В2 (диметилизоаллоксазинрибитола). 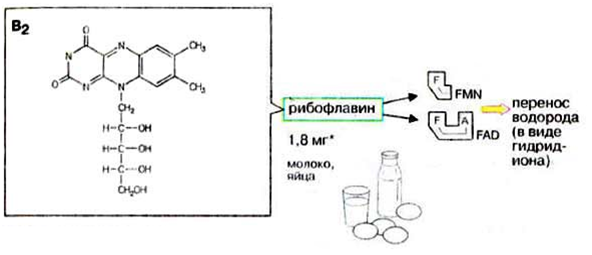 Пищевые источники витамина В2: капуста, горох, яблоки, зеленая фасоль, помидоры, репа, дрожжи, яйца, печень, мясо, молоко. Дефицит витамина В2: -расстройство пищеварения и нервной системы, -хронические гастриты и колиты, -общая слабость, -кожные заболевания, -снижает сопротивляемость болезням. Биофункция: Входит в состав дыхательных флавиновых ферментов (ФМФ и ФАД). Осуществляет перенос H+ и e–. Авитоминоз/гипервитаминоз: Поражение глаз, светобоязнь, поражение слизистой полости рта, глоссит, задержка роста. PP Никотиновая кислота 15-25 мг/сут Кофермент оксидоредуктаз Биороль: Участвует в процессах клеточного дыхания (перенос H+ и e–). Регулирует секреторные и моторные функции желудочно-кишечного тракта и печени. Входит в состав НАД и НАДФ. НАД и НАДФ: Никотинамидадениндинуклеотид (НАД) и никотин-амидадениндинуклеотидфосфат (НАДФ) - производные витамина РР -никотинамида (антипеллагрического витамина). Пищевые источники: Мясо, печень, почки, рыба, дрожжи. Авитоминоз/гипервитаминоз: Воспаление кожи (пеллагра), расстройства желудочно-кишечного тракта. Авитаминоз РР – пеллагра(болезнь трех Д): -дерматит, - деменция, - диарея. Симптомы пеллагры наиболее резко выражены у больных с недостаточным белковым питанием. Это объясняется недостатком триптофана, который является предшественником никотинамида. 3) В моче больного найдено значительное количество гомогентизиновой кислоты. Как образуется гомогентизиновая кислота в организме. Содержится ли она в моче здоровых людей? Назовите заболевание, обнаруженное у выше указанного больного и причину его возникновения? Алкаптонурия. Образование гомогентизиновой кислоты: У животных является промежуточным соединением в процессе катаболизма аминокислот фенилаланина и тирозина: Фенилаланин → Тирозин ⇋ п-гидроксифенилпировиноградная кислота → Гомогентизиновая кислота → Малеилацетоуксусная кислота → Фумарилацетоуксусная кислота → Фумаровая кислота + Ацетоуксусная кислота Гомогентизиновая кислота является предшественником токоферолов, пластохинона. Медицина При наследственном заболевании алкаптонурия, выражающемся в нарушении обмена аминокислот из-за отсутствия оксидазы гомогентизиновой кислоты, метаболизм аминокислот останавливается на стадии образования гомогентизиновой кислоты, которая выводится с мочой. Билет 20 1)Обмен и биологическое значение глутаминовой и аспарагиновой аминокислот в организме человека. Глу и асп – первичные и заменимые АМК Пути синтеза: -восстановительное аминирование, -трансаминирование Глутамин синтезируется из глу под действием глутаминсинтетазы. Аспарагин синтезируется из асп и глутамина. Судьба Асп: -Аспарагин -Синтез пуриновых и пиримидиновых омнований -В-аланин: КоАSH, Азотистые веществава мыщц: анзерин,карнозин Судьба Глу: -Фолиевая кислота -Глутамин -Пролин -Глутатион -Синтез Пуриновых нуклеотидов Глутамин:
Образование амидов АМК:  Образование аммонийных солей:
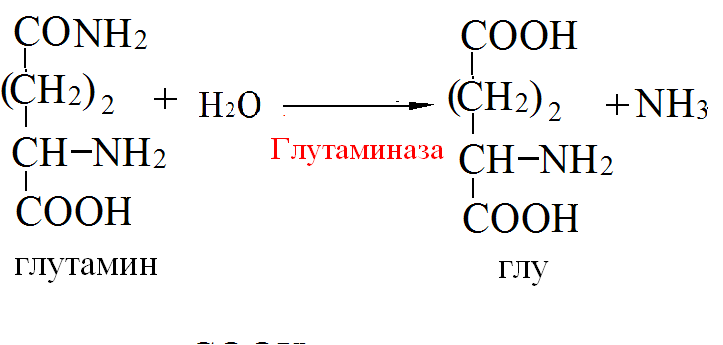 Аспарагиновая кислота (аминоянтарная кислота, аспартат, аминобутандиовая кислота) — алифатическая аминокислота, одна из 20 протеиногенных аминокислот организма. Встречается во всех организмах в свободном виде и в составе белков. Кроме того, выполняет роль нейромедиатора в ЦНС. Аспарагиновая кислота: - присутствует в организме в составе белков и в свободном виде - играет важную роль в обмене азотистых веществ - участвует в образовании пиримидиновых оснований и мочевины Аспарагиновая кислота и аспарагин являются критически важными для роста и размножения лейкозных клеток при некоторых видах лимфолейкоза. Фермент микробного происхождения L-аспарагиназа, нарушающий превращение аспарагиновой кислоты в аспарагин и наоборот, оказывает сильное специфическое цитостатическое действие при этих видах лейкозов. Основные функции Аспарагиновая кислота является прямым предшественником аспарагина и участвует в синтезе незаменимых аминокислот метионина и треонина, в синтезе пиримидиновых нуклеотидов. Она играет важную роль в обмене веществ, в деятельности ДНК и РНК, синтезе иммуноглобулинов, способствует удалению вредного аммиака из организма. Важный фактор предотвращения усталости. Аспарагиновая кислота, будучи связывающим субстратом энергетического и пластического обмена, обладает способностью повышать основной обмен и участвует в передаче и модуляции межнейронных сигналов. Используется в качестве биологически активной добавки в питании спортсменов. Потребность Cуточная потребность - 6 г. Пищевые источники Значительное количество аспарагиновой кислоты содержат проращенных семенах Физиологич.роль: -присутствует в организме в составе белков и в свободном виде -играет важную роль в обмене азотистых веществ -участвует в образовании пиримидиновых оснований и мочевины -Аспарагиновая кислота и аспарагин являются критически важными для роста и размножения лейкозных клеток при некоторых видах лимфолейкоза. -Фермент микробного происхождения L-аспарагиназа, нарушающий превращение аспарагиновой кислоты в аспарагин и наоборот, оказывает сильное специфическое цитостатическое действие при этих видах лейкозов. 2)Микроэлементы: железо, медь и кобальт. Их роль в организме. Понятие о микроэлементозах. Железо: Общее количество железа в организме:
65 % - железо гемоглобина, 10 % - железо миоглобина, 5 % - железо в составе ферментов, 20 % железа депонировано в печени, костном мозге, селезёнке (связано с ферритином, гемосидерином), 0,1-0,2 % - транспортное железо. На 1 г гемоглобина приходится 3,4 мг железа. В сутки требуется 3-5г железа Источники:
Биороль:
Понижена концентрация железа при:
Повышена при:
Гиперсидероз - избыточное содержание железа в организме. Причины повышения концентрации железа в сыворотке: -усиление деградации эритроцитов при гемолитической анемии, -нарушение синтеза гемоглобина (В12-дефицитная анемия), -острый гепатит, -гемосидероз, -гемохроматоз. Понижение при: -недостаточном поступлении железа в организм, -нарушении депонирования железа при беременности, -гастроэктомии, -снижении кислотности и ахлоргидрии, -хронической диарее, стеаторее, -неспецифическом колите, -потерях крови, -язвенной болезни. Транспортные формы железа: 1)Трансферрин
Атомы железа транспортируются в клетку путём взаимодействия комплекса Fe-трансферрин со специфическими рецепторами мембраны 2)Лактоферрин Находится лактоферрин в:
3) Ферритин – основная форма депонированного железа Накапливается в :
Избыток железа в тканях содержится в виде гемосидерина. |
