ОТВЕТЫ НА БИЛЕТЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ. Отдельное спасибо ребятам со второго потока лечебного факультета 2012 г
 Скачать 2.33 Mb. Скачать 2.33 Mb.
|
|
Репликация
Этапы репликации Инициация репликации происходит в нескольких точках хромосомы. Точки инициации репликации- ориджины репликации. Во время миграции репликативной вилки происходит разделение цепей родительской ДНК с участием ДНК-хеликазы. Далее действует раскручивающий белок. ДНК-полимераза α катализирует синтез короткого (до 10 нуклеотидов) олигонуклеотида, то есть праймера, с которого начинается синтез ДНК. Затем на конец одной цепи присоединяется ДНК-полимераза δ (дельта). Расположение оснований в двух нитях не только комплементарно, но и антипараллельно. Элонгация репликации – репликация обеих материнских цепей ДНК и связывание друг с другом фрагментов новообразованных цепей ДНК.
Этап III – терминация синтеза ДНК – наступает, скорее всего, когда исчерпана ДНК-матрица и трансферазные реакции прекращаются. Точность репликации ДНК чрезвычайно высока, возможна одна ошибка на 1010 трансферазных реакций, однако подобная ошибка обычно легко исправляется за счет процессов репарации. Транскрипция Транскри́пция (Т.) в биологии, осуществляющийся в живых клетках биосинтез рибонуклеиновой кислоты (РНК) на матрице — дезоксирибонуклеиновой кислоте (ДНК). Т. — один из фундаментальных биологических процессов, первый этап реализации генетической информации, записанной в ДНК в виде линейной последовательности 4 типов мономерных звеньев — нуклеотидов. Т. осуществляется специальными ферментами — ДНК зависимыми РНК-полимерами. В результате Т. образуется полимерная цепь РНК (также состоящая из нуклеотидов), последовательность мономерных звеньев которой повторяет последовательность мономерных звеньев одной из двух комплементарных цепей копируемого участка ДНК. Продуктом Т. являются 4 типа РНК, выполняющих различные функции: 1) информационные, или матричные, РНК, выполняющие роль матриц при синтезе белка рибосомами; 2) рибосомальные РНК, являющиеся структурными компонентами рибосом; 3) транспортные РНК, являющиеся основными элементами, осуществляющими при синтезе белка перекодирование информации, заключённой в информационной РНК, с языка нуклеотидов на язык аминокислот; 4) РНК, играющие роль затравки репликации ДНК. Т. ДНК происходит отдельными участками, в которые входит один или несколько генов. Фермент РНК-полимераза «узнаёт» начало такого участка (промотор), присоединяется к нему, расплетает двойную спираль ДНК и копирует, начиная с этого места, одну из её цепей, перемещаясь вдоль ДНК и последовательно присоединяя мономерные звенья — нуклеотиды — к образующейся РНК в соответствии с принципом комплементарности. По мере движения РНК-полимеразы растущая цепь РНК отходит от матрицы и двойная спираль ДНК позади фермента восстанавливается. Когда РНК-полимераза достигает конца копируемого участка (терминатора), РНК отделяется от матрицы. Число копий разных участков ДНК зависит от потребности клеток в соответственных белках и может меняться в зависимости от условий среды или в ходе развития организма. Механизм регуляции Т. хорошо изучен у бактерий; изучение регуляции Т. у высших организмов — одна из важнейших задач молекулярной биологии Посттранскрипционный процессинг- ферментативные превращения транскриптов, после чего они стают активными. Процессинг включает:
Свойства аминокислотного кода: 1)Триплетность. Одна АМК кодируется тремя нуклеотидами. 2)Вырожденность. 3)Несколько кодонов кодируют одну и ту же АМК. 4)Однозначность и специфичность. Каждому кодону соответствует одна АМК. 5)Неперекрываемость. Отсутствие знаков препинания. 6)Считывание триплетов идёт без пропусков. 7)Универсальность. 8)Среди 64 кодонов – 3 кодона нонсенс (УАГ, УАА, УГА) бессмысленные. 9)Неоднозначность соответствия в считывании кодонов. Строгая комплементарность в двух первых буквах кодона, в случае же третьей буквы это необязательно. Обратная транскрипция — это процесс образования двуцепочечной ДНК на матрице одноцепочечной РНК. Данный процесс называется обратной транскрипцией, так как передача генетической информации при этом происходит в «обратном», относительно транскрипции, направлении. Идея обратной транскрипции вначале была очень непопулярна, так как противоречила центральной догме молекулярной биологии, которая предполагала, что ДНК транскрибируется в РНК и далее транслируется в белки. Однако в 1970 году Темин и Балтимор независимо друг от друга открыли фермент, названный обратной транскриптазой (ревертазой), и возможность обратной транскрипции была окончательно подтверждена. В 1975 году Темину и Балтимору была присуждена Нобелевская премия в области физиологии и медицины. 3) При длительном приеме антибиотиков и сульфаниламидов угнетается микрофлора кишечника, способная синтезировать пиридоксин. В результате может возникнуть гиповитаминоз В6. Какие реакции превращения глутаминовой кислоты нарушаются в этом случае? Реакции трансаминирования Билет 12 1)Регуляция процессов биосинтеза белка на генетическом уровне (теория Жакоба и Моно). Гормональная регуляция белкового обмена. Гормоны анаболического и катаболического действия.
Сущность теории – «выключение» или «включение» генов.
По теории Жакоба-Моно в биосинтезе белка у бактерий участвует 3 типа генов:
Гормональная регуляция белкового обмена: СТГ:
приводит к положительному азотистому балансу Инсулин:
Эстрогены:
Андрогены:
Тироксин в малых дозах в детстве:
Тироксин в больших дозах у взрослых:
Глюкокортикоиды:
2)Витамин В6, биотин, их химическая структура и признаки витаминной недостаточности. Участие в обмене веществ. Химическая формула: 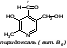 Действие: Являясь структурной единицей ряда ферментов, витамин В6 играет активную роль в обмене веществ. Он участвует в процессах углеводного, липидного и белкового обмена. Благодаря пиридоксину нормализуется липидный обмен при атеросклерозе. Витамин необходим для нормальной работы центральной и периферической нервной системы. Пиридоксин участвует в обмене целого ряда важных аминокислот и биологически активных веществ. Также витамин В6 обладает регенеративными свойствами. Важной особенностью пиридоксина является то, что он служит антидотом при передозировке некоторых лекарств, таких как противотуберкулезные препараты Симптомы гиповитаминоза : начальными проявлениями гиповитаминоза В6 являются поражения кожи в виде дерматитов, которые могут осложняться нагноительными процессами и омертвением участков ткани. Со стороны слизистых оболочек наиболее часты атрофические изменения и воспалительные процессы в виде стоматитов, гастритов и энтероколитов. Довольно часто, особенно в детском возрасте, при авитаминозе В6 поражается нервная система и проявляется это в повышенной раздражительности, сонливости у детей, а при тяжелом авитаминозе могут наблюдаться судорожные припадки, отставание в развитии, задержка в росте. В более старшем возрасте часто возникает повышенная утомляемость, бессонница и снижение работоспособности. Симптомы гипервитаминоза: В клинической практике гипервитаминоз В6 не описывается из-за низкой токсичности и высоких темпов метаболизма пиридоксина. 3)Будет ли протекать глюконеогенез, если в клетке цитратный цикл и дыхательная цепь полностью ингибированы. Ответ поясните. Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитами являются в первую очередь молочная и пи-ровиноградная кислоты, так называемые гликогенные аминокислоты, гли-церол и ряд других соединений. Иными словами, предшественниками глюкозы в глюконеогенезе может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот. Билет 13. 1)Классификация и характеристика сложных белков (липопротеины, хромопротеины, гликопротеины, нуклеопротеины, фосфопротеины). Липопротеины: а)в протестетическую группу входят ТАГ, фосфолипиды, стериды, б)синтезируются в печени или в слизистой оболочке кишечника. Биологическая роль липопротеинов: а)входят в состав плазматических мембран (20-80%), б)содержатся в нервной ткани, в)находятся в плазме крови ХМ, ЛПНП, ЛПВП, ЛПОНП. Хромопротеины: состоят из простого белка и связанного с ним окрашенного компонента. Например: гемоглобин, миоглобин. Гликопротеины (гликоконъюгаты): а)белки, содержащие олигосахаридные цепи, ковалентно присоединённые к полипептидной основе, б)углеводные компоненты ковалентно соединены с азотом аспарагина молекулы белка, в)при развитии ряда болезней (рак, астма, иммунодефицит, ревматоидный артрит) изменяются структуры гликоконъюгатов. Функции гликопротеинов: 1)структурная (находятся в плазматических мембранах), 2)смазочная и защитная (муцины, слизь), 3)транспорт витаминов, липидов, микроэлементов (все белки плазмы крови, кроме альбуминов, гликопротеины), иммунологическая (иммуноглобулины, антигены гистосовместимости, комплемент, интерферон), 4)гормоны (хорионический гонадотропин, ТТГ), 5)ферменты (протеазы, нуклеазы, гликозидазы, гидролазы, факторы свёртывания), 6)места клеточных контактов распознавания, 7)гормональные рецепторы, 8)лектины влияют на эмбриональное развитие и дифференцировку, могут влиять на выбор мест метастазирования раковых клеток. Нуклеопротеины - состоят из белка и нуклеиновой кислоты: белок – гистоны, протамины, НК – ДНК, РНК – полинуклеотиды, состоящие из мононуклеотидов. Значение нуклеотидов: а)синтез НК, б)энергетическая роль, в)коферменты, г)транспортная функция. Фосфопотеины: состоят из белка и фосфорной кислоты, фосфорная кислота присоединяется через ОН-группу серина. Пример фосфопротеинов: казеиноген в молоке, овальбумин и фосвитин в яйцах, ихтулин в икре рыбы, в большом количестве содержатся в клетках ЦНС. Биологическая роль фосфопротеинов: входят в состав мозга, в растущем организме фосфор – пластический материал, способны отдавать фосфорную кислоту для макроэргов и ферментов. 2) Вторичный липолиз триглицеридов. Окисление глицерина до конеч¬ных продуктов (СО2 и Н2О). Биоэнергетика процесса. Окисление глицерина: Баланс аэробного распада глицерина: От глицерина до ФГА затрата – 1 АТФ и получение + 3 АТФ (окислительное фосфорилирование). На втором этапе гликолиза при окислении 1 молекулы ФГА получаем 2 АТФ и 1 НАДН+Н, то есть 2+3=5 АТФ. Таким образом от глицерина до ПВК получаем (3-1) + 5 = 7АТФ. Окислительное декарбоксилирование ПВК даёт 3АТФ. ЦТК даёт 12 АТФ. ИТОГО: 7+3+12 = 22АТФ даёт окисление 1 молекулы глицерина в аэробных условиях. 3) Больной 40 лет поступил в клинику с жалобами на боли в правом подреберье, желтушность кожи. Какие биохимические показатели (пигменты крови и мочи, активность ферментов) помогут уточнить вид желтухи? АСТ/АЛТ Уробилин в моче Билирубин и уробилиноген-кровь Билет 14 1)Структура гликогена, синтез и распад гликогена в печени и мышцах. Гликогенозы. В организме человека содержится до 450 г гликогена Распад гликогена: Гликогенозы: Болезнь Гирке: Вызывается отсутствием глюкозо-6-фосфатазы. Гепато-ренальный гликогеноз. Клинические проявления: 1)нарушается нормальная структура гликогена, 2)гепатомегалия, 3)гипогликемия натощак, 4)дети отстают в росте. Рекомендуется частое кормление пищей, богатой глюкозой. Болезнь Помпе: Возникает при дефекте фермента кислой α -гликозидазы. Сердечный гликогеноз. Клинические проявления:
Болезнь Кори: Дефект амило-1,6-гликозидазы. Клинические проявления:
Болезнь Гесса: Дефект фосфорилазы печени. Клинические проявления:
Рекомендуется потребление углеводов в виде крахмала. Болезнь Андерсена: Дефект ветвящего фермента. Клинические проявления:
Болезнь Мак-Ардля: Возникает при отсутствии фосфорилазы мышц. Проявляется по-разному в зависимости от возраста:
Диагностика гликогенозов: Тест толерантности к глюкозе. Исследование сахара крови. Биопсия печени. Определение активности ферментов. 2) Изогидрия. Механизмы поддержания изогидрии. Ацидоз и алкалоз. Изогидрия – постоянство рН, обусловленное действием буферных систем и физиологическим контролем. В норме кислотно-основной баланс поддерживается тремя механизмами:
Буферные системы организма устраняют сдвиги рН:
Физиологические механизмы восстанавливают и буферную ёмкость. Ацидоз – избыточное содержание анионов кислот.
Газовый ацидоз –увеличение концентрации углекислоты и повышение парциального давления углекислого газа в крови, гиперкапния. Развивается при уменьшении легочной вентиляции, при вдыхании воздуха с высокой концентрацией углекислого газа:
Метаболический ацидоз – избыточное накопление кислот в организме.
Диабетический кетоацидоз: Анализ крови при кетоацидозе
Проведена терапия:
При метаболическом ацидозе:
Алкалоз- нарушение КЩР, при котором в крови увеличена концентрация катионов и снижена концентрация Н.
Различают:
Газовый алкалоз:
Причины газового алкалоза: Стимуляция дыхательного центра
Рефлекторная стимуляция дыхательного центра при
Метаболический алкалоз – в крови накапливаются основания, дефицит ионов водорода. Причины:
При метаболическом алкалозе:
3) Сипмтомами авитаминоза В1 является расстройство нервной систе¬мы, потеря памяти, изменение психики. Почему к дефициту витамина В1 особо чув¬ствительна центральная нервная система? Дефицит витамина В1 называют болезнью бери-бери, для него характерны глубокие расстройства периферической и центральной нервной системы, нарушения деятельности сердца, а также других внутренних органов. В следствие дефицита витамина В1 в организме происходит энергетическое голодание клеток, особенно к этому чувствительны клетки сердечной мышцы и нервной системы. Причины авитаминоза В1 – неправильное питание, болезни пищеварительной системы, сопровождающиеся нарушением всасываемости витаминов. Часто этот тип авитаминоза наблюдается у алкоголиков. Билет 15 1)Паратгормон и тиреокальцитонин. Влияние гормонов на обмен кальция и фосфора в организме человека Паратгормон - пептид из 84 аминокислот. Выделяется при уменьшении содержания кальция в крови. Органы-мишени: почки, костная ткань -способствует резорбции кости остеокластами и вымыванию солей кальция в кровь -снижает экскрецию кальция и повышает экскрецию фосфора почками посредством стимуляции синтеза кальцитриола в почках увеличивает эффективность всасывания кальция в кишечнике. -В крови при действии паратгормона возрастает концентрация кальция. Тиреокальцитонин - пептид из 32 аминокислот Секретируется клетками щитовидной железы. Мишень кальцитонина – костная ткань Кальцитонин способствует: -отложению кальция и фосфора в кости в результате деятельности остеобластов, -подавлению резорбции кости (ингибитор остеокластов). При действии кальцитонина концентрация кальция в крови уменьшается и возрастает в костях. 2) Сопряжение обмена углеводов и липидов. Сопряжение обмена углеводов и аминокислот. Пути превращения и образования пировиноградной кислоты. Взаимосвязь обменов осуществляется благодаря интегрирующим системам: нервной, эндокринной,сосудистой. Взаимосвязь обеспечивается: информационный уровенем, структурный уровенем, общим энергетическим обеспечением, на уровне общих метаболитов, на уровне Ц.Т.К. Взаимосвязь углеводного и липидного обменов осуществляется через: ацетил-КоА, ФГА, НАДФН2 из пентозного цикла идёт на синтез жирных кислот, ЩУК нужен для работы Ц.Т.К. Жиры сгорают в пламени углеводов. При избытке в пище углеводов возникает ожирение. ФГА и ацетил-КоА– источники глицерина и жирных кислот. При спячке у животных происходит образование углеводов из жиров. Взаимосвязь белкового и жирового обменов на уровне: ПВК, ацетил-КоА, кетоновых тел. Из белков осуществляется синтез жира. Взаимосвязь углеводного и белкового обменов на уровне: ПВК, ЩУК, ацетил-КоА, пентоз, глюкопластичных и кетопластичных аминокислот. Углеродные скелеты АМК вступают в Ц.Т.К. Возможно образование углеводов из белков (ГНГ) и белков из углеводов (из ПВК образуется аланин). 3) При тяжелых вирусных гепатитах у больного может развиться печеночная кома, обусловленная токсическим действием аммиака на клетки мозга. Ка кова причина накопления аммиака в крови? Как изменится концентрация мочевины в крови у данных больных? Азотемия. Понижены функции почек воз-ие повыш мочевины и креатина. Токсич возд вещ-в Билет 16 1)Обмен и биологическое значение серосодержащих аминокислот (метионин и цистеин). Участие метионина в реакциях трансметилирования. Молеку лярная патология обмена этих аминокислот. Обмен метионина Метионин - незаменимая, гликогенная АМК. Пищевые источники: яйца,молочные продукты,мясо Метионин участвует в реакциях трансметилирования: -Трансметилирование – перенос метильной группы. - Донором метильной группы служит S-аденозилметионин. -Метильная группа стаёт подвижной с помощью АТФ. -Кофермент, переносящий метильную группу – ТГФК. Реакции трансметилирования применяются в: -синтезе фосфатидилхолина, -синтезе карнитина, -синтезе креатина, -синтезе адреналина из норадреналина, -синтезе анзерина из карнозина, -метилировании азотистых оснований в нуклеотидах, -инактивации метаболитов и обезвреживании чужеродных соединений. Вторая активная форма метионина витамин U: 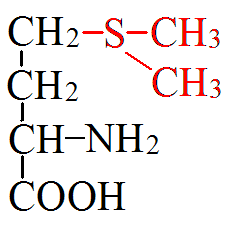
Цистеин:
Синтез: Окисление: 1)2) 3)4) Патологии связанные с обменом цистеина: Гомоцистеинурия
Цистинурия
Цистиноз (болезнь накопления)
Цистотионинурия
2) Микроэлементы: селен, цинк, марганец, стронций, фтор, йод, молибден. Микроэле ментозы. Микроэлементозы – патологические процессы, вызванные дефицитом, избытком или дисбалансом микроэлементов в организме. Природные микроэлементозы:
Техногенные микроэлементозы: связаны с производственной деятельностью человека. Различают:
Ятрогенные микроэлементозы:
Вторичные микроэлементозы возникают
Селен:
селенопротеин Р из плазмы, селенопротеин Р из почек и печени.
Биороль:
Недостаток:
Избыток: развивается селеновый токсикоз:
Цинк: В организме взрослого человека 1,5-2 г цинка:
Содержится в яйцах, мясе, молоке, печени, морских продуктах, грибах, укропе, чесноке, зерне. Суточная потребность 15 мг цинка. Источники:
Суточная потребность 15 мг цинка. Биороль:
фосфолипаза С, ДНК-полимераза, альдолаза, пируваткарбоксилаза),
Недостаток цинка:
Причины недостатка:
Марганец: В организме взрослого человека содержится 10–20 мг. Содержится в бобах и злаках Биороль:
Избыток:
Дефицит Mn приводит к нарушению синтеза гликозаминогликанов хрящевой ткани и задержке роста. Стронций: близок к кальцию и может включаться в костную ткань вместо него, Уровская болезнь –
Фтор:
При недостатке фтора – кариес. Лечение: вода и паста с фтором. При избытке – флюороз. Йод: В организме взрослого человека 20-30 мг йода. 10 мг содержится в щитовидной железе. Суточная доза -150 мкг йода. Йод всасывается через кожу, слизистые, лёгкие. Выделяется через почки, экскреторными железами. Источники:
Биороль:
Молибден:
Биороль: 1. В животных организмах присутствуют 3 молибденсодержащих фермента:
2. Молибден – ростовой фактор бактерий. Может привести к избыточному размножению их в кишечнике. Молибденовая подагра:
3) Оценить состояние больного, если: рН крови - 7,31, рН мочи - 4,8. Общее содержание СО2 в крови повышено. рСО2 - 80 мм рт ст. Титрометрическая кислотность мочи повышена. Билет 17. 1)Основные пути обмена аминокислот: декарбоксилирование, дезаминиро вание. Биологическая роль биогенных аминов. Дезаминирование АМК- отщепление аминогруппы в форме аммиака с образованием безазотистого остатка АМК. Выделяют четыре типа дезаминирования:
В организме человека преобладает окислительное дезаминирование. Непрямое дезаминирование:
Неокислительное дезаминирование серина, гистидина и треонина
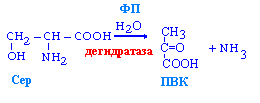 Окислительное дезаминирование (минорный путь):
Декарбоксилирование АМК – процесс отщепления карбоксильной группы АМК в виде углекислого газа.
Образование ГАМК: Образование биогенных аминов В организме животных многие биогенные амины выполняют роль гормонов и нейромедиаторов. Например гистамин:
Разлагаются в организме при участии ферментов аминоксидаз. 2) Витамины Р и С, их структура, признаки витаминной недостаточности, влияние на обмен веществ. Витамин С (Аскорбиновая кислота) 50-100мг/сут 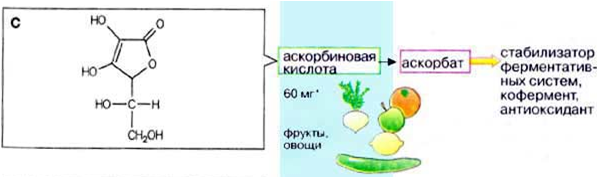 Функции:
Пищевые источники: Свежие фрукты, растения: шиповник, черная смородина, цитрусовые. Авитоминоз/гипервитаминоз: Развивается цинга (кровоточивость десен, мелкие кровоизлияния в коже, поражение стенок кровеносных сосудов). Нарушение синтеза коллагена. Враги витамина С
дневная норма витамина С.
у организма 10 мг витамина С. Витамин Р-рутин Функция: Укрепляет стенки капилляров, регулируя их проницаемость, усиливает действие аскорбиновой кислоты. Стабилизирует основное вещество соединительной ткани путем ингибирования гиалуронидазы. Пищевые источники: В листьях руты душистой, гречихи, чайного куста; цитрусовые, черная смородина. Авитоминоз/гипервитаминоз: Повышает проницаемость сосудов – кровотечения, общая слабость, боли в конечностях. 3) У больного после переливания крови развилась желтуха. Какой вид желтухи можно заподозрить? Как изменились показатели пигментного обме на в крови и моче? Гемолитическая. В крови-несвободный билирубин. в моче уробилин повышен Билет 18 1)Классификация ферментов. Общая характеристика класса оксидоредук таз. Коферменты оксидоредуктазных реакций. 1. Оксидоредуктазы - катализируют окислительно-восстановительные реакции 2. Трансферазы - катализируют реакции межмолекулярного переноса 3. Гидролазы - осуществляет гидролитический разрыв связей с присоединением воды в месте разрыва. Гидролазы - простые белки 4. Лиазы - негидролитический разрыв связей (С-С; C-H; C-S) 5. Изомеразы - катализирует реакции оптической и геометрической изомеризации. 6. Лигазы (синтетазы) - осуществляют синтез сложных органических веществ за счет образования новых связей с использованием АТФ Шифр ферментов: в кадом шифре указывается 4 цифры 1 - класс ферментов 2 - подкласс (указывает какая группировка является донором) 3 - подподкласс (указывает какая группировка является акцептором) 4 - порядковый номер фермента в подподклассе Характеристика оксидоредуктаз: Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота. Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры. Наиболее распространены следующие рабочие названия оксидоредуктаз: 1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. 2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами. 3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата. 4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода. 5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода. 6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов  |
