Ответы к экзамену По биохимии 1 структура и функции белков 3 ферменты 10 нуклеиновые кислоты и нуклеотиды 21
 Скачать 29.52 Mb. Скачать 29.52 Mb.
|
|
Вопрос №150 Обмен железа: всасывание, транспорт, депонирование. Основные причины возникновения железодефицитных анемий и гемахроматозов. В организме взрослого человека содержится 3 - 4 г железа, из которых только около 3,5 мг находится в плазме крови. Гемоглобин имеет примерно 68% железа всего организма, ферритин - 27%, миоглобин - 4%, трансферрин - 0,1%, На долю всех содержащих железо ферментов приходится всего 0,6% железа, имеющегося в организме. Источниками железа при биосинтезе железосодержащих белков служат железо пищи и железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезёнки. В нейтральной или щелочной среде железо находится в окисленном состоянии - Fe3+, образуя крупные, легко агрегирующие комплексы с ОН-, другими анионами и водой. При низких значениях рН железо восстанавливается и легко диссоциирует. Процесс восстановления и окисления железа обеспечивает его перераспределение между макромолекулами в организме. Ионы железа обладают высоким сродством ко многим соединениям и образуют с ними хелатные комплексы, изменяя свойства и функции этих соединений, поэтому транспорт и депонирование железа в организме осуществляют особые белки. В клетках железо депонирует белок ферритин, в крови его транспортирует белок трансферрин. В пище железо в основном находится в окисленном состоянии (Fe3+) и входит в состав белков или солей органических кислот. Освобождению железа из солей органических кислот способствует кислая среда желудочного сока. Наибольшее количество железа всасывается в двенадцатиперстной кишке. Аскорбиновая кислота, содержащаяся в пище, восстанавливает железо и улучшает его всасывание, так как в клетки слизистой оболочки кишечника поступает только Fe2+. В суточном количестве пищи обычно содержится 15 - 20 мг железа, а всасывается только около 10% этого количества. Организм взрослого человека теряет около 1 мг железа в сутки. 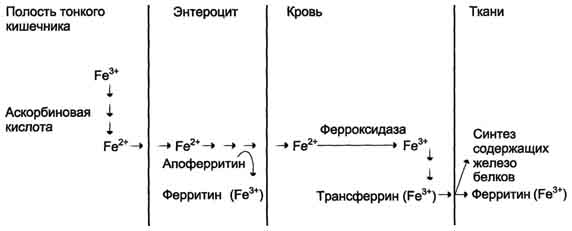 Количество железа, которое всасывается в клетки слизистой оболочки кишечника, как правило, превышает потребности организма. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин "улавливает" железо в энтероцитах и превращается в ферритин, который остаётся в энтероцитах. Таким способом снижается поступление железа в капилляры крови из клеток кишечника. Когда потребность в железе невелика, скорость синтеза апоферритина повышается. Постоянное слущивание клеток слизистой оболочки в просвет кишечника освобождает организм от излишков железа. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется. Железо, поступающее из энтероцитов в кровь, транспортирует белок плазмы крови трансферрин. Количество железа, которое всасывается в клетки слизистой оболочки кишечника, как правило, превышает потребности организма. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин "улавливает" железо в энтероцитах и превращается в ферритин, который остаётся в энтероцитах. Таким способом снижается поступление железа в капилляры крови из клеток кишечника. Когда потребность в железе невелика, скорость синтеза апоферритина повышается. Постоянное слущивание клеток слизистой оболочки в просвет кишечника освобождает организм от излишков железа. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется. Железо, поступающее из энтероцитов в кровь, транспортирует белок плазмы крови трансферрин. В плазме крови железо транспортирует белок трансферрин - гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe3+). Поступающее в кровь железо окисляет фермент ферроксидаза, известный как медьсодержащий белок плазмы крови церулоплазмин. В норме трансферрин крови насыщен железом приблизительно на 33%. Трансферрин взаимодействует со специфическими мембранными рецепторами клеток. В результате этого взаимодействия в цитозоле клетки образуется комплекс Са2+-кальмодулин-ПКС, который фосфорилирует рецептор трансферрина и вызывает образование эндосомы. АТФ-зависимый протонный насос, находящийся в мембране эндосомы, создаёт кислую среду внутри эндосомы. В кислой среде эндосомы железо освобождается из трансферрина. После этого комплекс рецептор - апотрансферрин возвращается на поверхность плазматической мембраны клетки. При нейтральном значении рН внеклеточной жидкости апотрансферрин изменяет свою конформацию, отделяется от рецептора, выходит в плазму крови и становится способным вновь связывать ионы железа и включаться в новый цикл его транспорта в клетку. Железо в клетке используется для синтеза железосодержащих белков или депонируется в белке ферригине. Ферритин содержится почти во всех тканях, но в наибольшем количестве в печени, селезёнке и костном мозге. Незначительная часть ферритина экскретируется из тканей в плазму крови. Поскольку поступление ферритина в кровь пропорционально его содержанию в тканях, то концентрация ферритина в крови - важный диагностический показатель запасов железа в организме при железодефидитной анемии. Содержание железа в клетках определяется соотношением скоростей его поступления, использования и депонирования и контролируется двумя молекулярными механизмами. Скорость поступления железа в неэритроидные слетки зависит от количества белков-рецепторов трансферрина в их мембране. Избыток железа в клетках депонирует ферритин. Синтез рецепторов трансферрина регулируется а уровне трансляции этих белков и зависит от содержания железа в клетке. Нарушения метаболизма железа Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, после операций на ЖКТ. При железодефицитной анемии уменьшается размер эритроцитов и их пигментация (гипохромные эритроциты малых размеров). В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в тканях и плазме крови снижается концентрация ферритина. Причина этих изменений - недостаток железа в организме, вследствие чего снижается синтез гема и ферритина в неэритроидных тканях и гемоглобина в эритроидных клетках. Гемохроматоз. Когда количество железа в клетках превышает объём ферритинового депо, железо откладывается в белковой части молекулы ферритина. В результате образования таких аморфных отложений избыточного железа ферритин превращается в гемосидерин. Гемосидерин плохо растворим в воде и содержит до 37% железа Накопление гранул гемосидерина в печени, поджелудочной железе, селезёнке и печени приводит к повреждению этих органов - гемохроматозу. Гемохроматоз может быть обусловлен наследственным увеличением всасывания железа в кишечнике, при этом содержание железа в организме больных может достигать 100 г. Это заболевание наследуется по аутосомнорецессивному типу. Накопление гемосидерина в поджелудочной железе приводит к разрушению β-клеток островков Лангерханса и, как следствие этого, к сахарному диабету. Отложение гемосидерина в гепатоцитах вызывает цирроз печени, а в миокардиоцитах - сердечную недостаточность. Больных наследственным гемохроматозом лечат регулярными кровопусканиями, еженедельно или один раз в месяц в зависимости от тяжести состояния больного. К гемохроматозу могут привести частые переливания крови, в этих случаях больных лечат препаратами, связывающими железо. Вопрос №151 Особенности метаболизма эритроцитов: катаболизм глюкозы. Образование и обезвреживание активных форм кислорода, роль глюкозо-6Ф-ДГ. Эритроциты - единственные клетки, которые имеют только клеточную мембрану и цитоплазму. Дифференцировка стволовых клеток в специализированные происходит в клетках костного мозга и заканчивается в кровотоке. Особенности строения эритроцитов соответствуют их функциям: большая площадь поверхности обеспечивает эффективность газообмена, эластичная клеточная мембрана облегчает движение по узким капиллярам, специальная ферментативная сисгема защищает эти клетки от активных форм кислорода. Эритроциты лишены митохондрий, поэтому в качестве энергетического материала они могут использовать только глюкозу. В эритроцитах катаболизм глюкозы обеспечивает сохранение структуры и функции гемоглобина, целостность мембран и образование энергии для работы ионных насосов. Глюкоза поступает в эритроциты путём облегчённой диффузии с помощью ГЛЮТ-2. Около 90% поступающей глюкозы используется в анаэробном гликолизе, а остальные 10% - в пентозофосфатном пути. 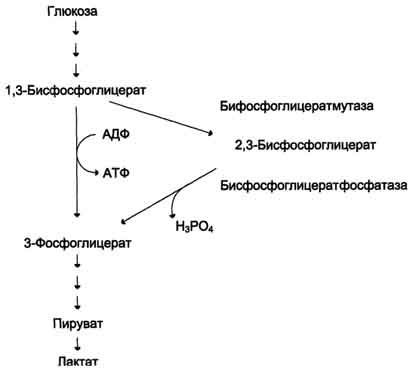 Конечный продукт анаэробного гликолиза лактат выходит в плазму крови и используется в других клетках, прежде всего гепатоцитах. АТФ, образующийся в анаэробном гликолизе, обеспечивает работу Nа+, К+-АТФ-азы и поддержание самого гликолиза, требующего затраты АТФ в гексокиназной и фосфофруктокиназной реакциях. Конечный продукт анаэробного гликолиза лактат выходит в плазму крови и используется в других клетках, прежде всего гепатоцитах. АТФ, образующийся в анаэробном гликолизе, обеспечивает работу Nа+, К+-АТФ-азы и поддержание самого гликолиза, требующего затраты АТФ в гексокиназной и фосфофруктокиназной реакциях. Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками - присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата. Образующийся только в эритроцитах 2,3-бисфосфоглицерат служит важным аллостерическим регулятором связывания кислорода гемоглобином. Глюкоза в эритроцитах используется и в пентозофосфатном пути, окислительный этап которого обеспечивает образование кофермента NADPH, необходимого для восстановления глу-татиона. Обезвреживание активных форм кислорода в эритроцитах 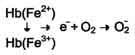 Большое содержание кислорода в эритроцитах определяет высокую скорость образования супероксидного анион-радикала (О2-), пероксида водорода (Н2О2) и гидроксил радикала (ОН.). Эритроциты содержат ферментативную систему, предотвращающую токсическое действие активных форм кислорода и разрушение мембран эритроцитов. Постоянный источник активных форм кислорода в эритроцитах - неферментативное окисление гемоглобина в метгемоглобин: Большое содержание кислорода в эритроцитах определяет высокую скорость образования супероксидного анион-радикала (О2-), пероксида водорода (Н2О2) и гидроксил радикала (ОН.). Эритроциты содержат ферментативную систему, предотвращающую токсическое действие активных форм кислорода и разрушение мембран эритроцитов. Постоянный источник активных форм кислорода в эритроцитах - неферментативное окисление гемоглобина в метгемоглобин: В течение суток до 3% гемоглобина может окисляться в метгемоглобин. Однако постоянно метгемоглобинредуктазная система восстанавливает метгемоглобин в гемоглобин. Метгемоглобинредуктазная система состоит из цитохрома B5 и флавопротеина цитохром B5 редуктазы, донором водорода для которой служит NADH, образующийся в глицеральдегиддегидрогеназной реакции гликолиза. Цитохром B5 восстанавливает Fe3+ метгемоглобина в Fe2+: Hb-Fe3+ + цит. b5 восст. → HbFe2+ + цит. b5 ок. . Окисленный цитохром B5 далее восстанавливается цитохром B5 редуктазой: Цит. B5 ок + NADH → цит. B5 восст. + NAD+. Супероксидный анион с помощью супероксидцисмутазы превращается в пероксид водорода: O2- + O2- + Н+ → H2О2 + O2 . Пероксид водорода разрушается каталазой и содержащим селен ферментом глутатионпероксидазой. Донором водорода в этой реакции служит глутатион - трипептид глутамилцистеинилглицин (GSH). Н2О2 → 2Н2О + О2; 2GSH + 2Н2О2 → GSSG + 2Н2О . Окисленный глутатион (GSSG) восстанавливается NADPH-зависимой глутатионредуктазой. Восстановление NADP для этой реакции обеспечивают окислительные реакции пентозофосфатного пути. О 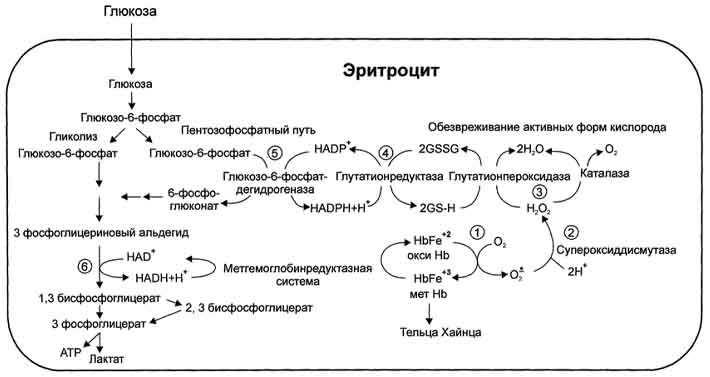 бразование и обезвреживание активных форм кислорода в эритроците: бразование и обезвреживание активных форм кислорода в эритроците:1 - спонтанное окисление Fe2+ в геме гемоглобина - источник супероксидного аниона в эритроцитах; 2 - Супероксиддисмутаза превращает супероксидный анион в пероксид водорода и воду: О2-+ О2- + 2Н+ → Н2О2 + О2; 3 - пероксид водорода расщепляется каталазой: 2 Н2О2 → 2 Н2О + О2 или глутатионпероксидазой: 2 GSH + Н2О2 → GSSG +2 Н2О; 4 - Глутатионредуктаза восстанавливает окисленный глутатион: GSSG + NADPH + Н+ → 2GSH + NADP+; 5 - NADPH, необходимый для восстановления глутатиона, образуется на окислительном этапе пентозофосфатного пути превращения глюкозы; 6 - NADH, необходимый для восстановления гемоглобина метгемоглобинредуктазной системой, образуется в глицеральдегидфосфатдегидрогеназной реакции гликолиза. Hарушения метаболизма эритроцитов Для эффективного обезвреживания активных форм кислорода, образующихся в эритроцитах, необходимы все перечисленные выше ферментативные системы защиты. Однако у людей обнаружено около 3000 генетических дефектов глюкозо-6-фосфатдегидрогеназы. Этот фермент катализирует скорость-лимитирующую реакцию пентозофосфатного пути окисления глюкозы, которая обеспечивает образование NADPH + Н+. От количества NADP + Н+ зависит активность глутатионредуктазы и глутатионпероксидазы - ферментов, разрушающих пероксид водорода. При приёме некоторых лекарств, являющихся сильными окислителями (антималярийного препарата примахина, сульфаниламидов), у пациентов, имеющих генетические дефекты глюкозо-6-фосфатдегидрогеназы или глутатионредуктазы, глутатионовой защиты может оказаться недостаточно. Активные формы кислорода вызывают образование гидроперекисей ненасыщенных жирных кислот фосфолипидов, входящих в состав клеточных мембран, их разрушение и гемолиз эритроцитов. Генетический дефект любого фермента гликолиза приводит к уменьшению образования АТФ и NADH + Н+ в этих клетках. Вследствие снижения скорости синтеза АТФ падает активность Nа+, К+-АТФ-азы, повышается осмотическое давление и возникает осмотический шок. Дефицит NADH + H+ приводит к накоплению метгемоглобина и увеличению образования активных форм кислорода, вызывающих окисление SH-групп в молекулах гемоглобина. Вопрос №152 Роль печени в обмене белков, жиров, углеводов. Самая крупная железа. Выполняет множество функций:
Вопрос №153 Метаболизм желчных пигментов. Виды желтух, причины возникновения. Механизм действия фенобарбитала для профилактики и лечения желтухи новорожденных. Нормальная концентрация билирубина в крови - 8-20 мкмоль/л. Это пигмент красно-коричневого цвета, образуется при распаде гемоглобина. Бывает прямой и непрямой билирубин. Гипербилирубинемию - повышение концентрации билирубина может вызвать:
Гем - простетическая группа гемоглобина. Эритроциты погибают и разрушаются через 20 дней. Освобожденный гемоглобин разрушается (в селезенке, печени, красном костном мозге). 1. Под действием гемоксигеназы разрушается связь между 1 и 2 кольцом гема. Образуется зеленый пигмент вердоглобин. 2. От него спонтанно отщепляется железо (с трансферрином поступает в печень, где депонируется и используется повторно) и белковая часть (расщепляется до аминокислот, которые используются повторно). Образуется желтый пигмент биливердин. 3. Биливердин восстанавливается биливердинредуктазой (кофермент НАДФН+Н+ из ПФП). 4. Образуется красно-коричневый билирубин. Он токсичный, нерастворимый, непрямой (НПБил). Он поступает в кровь, соединяется с альбумином (белок-переносчик) и поступает в печень. 5. Печень захватывает его с помощью белков лигандин (Л) и протеин Z (Z). Их деффект вызывает наследственную желтуху - синдром Жильбера (Ϯ). 6. В печени непрямой билирубин конъюгирует с 2 молекулами глюкуроновой кислоты под действием УДФ-глюкуронилтрансферазы. Образуется прямой, обезвреженный, растворимый билирубин (ПрБил). Дефект УДФ-глюкуронилтрансферазы вызывает синдром Криглера-Найяра (наследственная желтуха Ϯ). 7. Обезвреженный билирубин поступает в кишечник. 8. Под действием ферментов микрофлоры превращается там в бесцветный стеркобилиноген. 9. 95% его выводится с калом, где окисляется на воздухе, приобретая коричневый цвет, и называется стеркобилин. 10. 5% через геморроидальную вену поступает в почки и выводится с мочой. Окисляется на воздухе, приобретает желтый цвет и называется уробилиноген. Обезвреживание билирубина 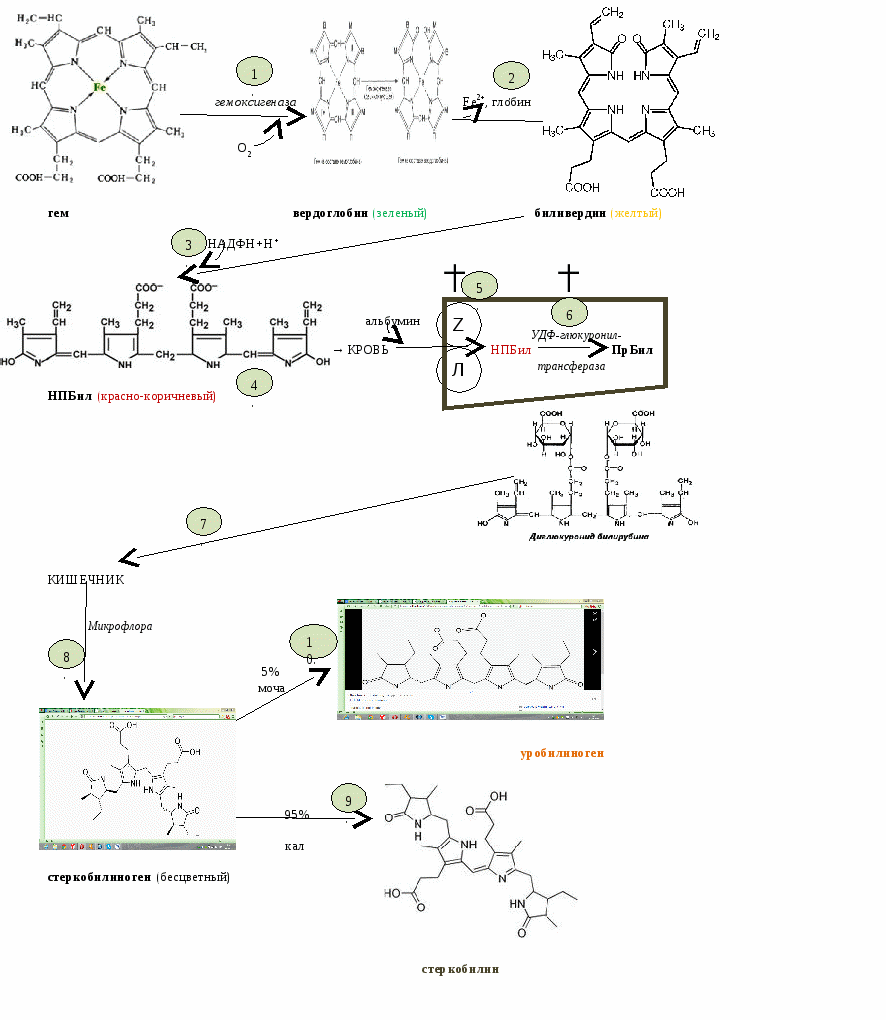 Желтуха При концентрации билирубина в крови выше 30 ммоль/л он может откладываться в слизистых и прадавать им желтый цвет. Желтуху диагностируют по крови, моче и калу. В зависимости от причин желтуха бывает: 1. Надпеченочная = гемолитическая. Причина - повышенный гемолиз эритроцитов (при переливании несовместимой группы крови или дефекте фермента ПФП глюкоза-6Ф-дегидрогеназа). Следовательно, печень функционирует нормально, но не успевает обезвреживать много непрямого билирубина. Поэтому диагностическая картина такова:
2. Печеночная Причина - поражение печени, ранушение функции, разрушение клеток (цирроз, гепатит, хронический алкоголизм). Следовательно, нарушается функция печени и она меньше обезвреживает непрямого билирубина. А т.к. клетки печени разрушены, то обезвреженный (прямой) билирубин поступает в кровь.
|
