Ответы к экзамену По биохимии 1 структура и функции белков 3 ферменты 10 нуклеиновые кислоты и нуклеотиды 21
 Скачать 29.52 Mb. Скачать 29.52 Mb.
|
|
Н  адеюсь, что это вообще когда-нибудь пригодится! адеюсь, что это вообще когда-нибудь пригодится!Ответы к экзамену По биохимии  1 СТРУКТУРА И ФУНКЦИИ БЕЛКОВ 3 ФЕРМЕНТЫ 10 НУКЛЕИНОВЫЕ КИСЛОТЫ И НУКЛЕОТИДЫ 21 ОБЩИЙ ПУТЬ КАТАБОЛИЗМА 32 ОБМЕН УГЛЕВОДОВ 46 ОБМЕН БЕЛКОВ 58 ОБМЕН ЛИПИДОВ 75 ОБМЕН НУКЛЕОТИДОВ 88 ВИТАМИНЫ 93 ОБЩИЕ ПРИНЦИПЫ РЕГУЛЯЦИИ МЕТАБОЛИЧЕСКИХ ПРОЦЕССОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА 95 БИОХИМИЯ ОРГАНОВ И ТКАНЕЙ 117 Сделано второкурсницей с красными глазами, ничего не соображающей в биохимии, Трубицыной Викторией Владимировной БелГУ июнь 2014 ВВЕДЕНИЕ В БИОХИМИЮ Вопрос №1 Предмет и задачи биологической и клинической химии. Биохимия – это наука о химическом составе живой материи, химических процессах, происходящих в живых организмах, а также связи этих превращений с деятельностью органов и тканей. Биохимия– это наука о молекулярных основах жизни.
Предмет - выяснение функционального, то есть биологического назначения всех химических веществ и физико-химических процессов в живом организме, а также механизм нарушения этих функций при разных заболеваниях. Современная биохимия решает следующие задачи: 1. Биотехнологическую, т.е. создание фармацевтических препаратов (гормонов, ферментов), регуляторов роста растений, средств борьбы с вредителями, пищевых добавок. 2. Проводит разработку новых методов и средств диагностики и лечения наследственных заболеваний, канцерогенеза, природы онкогенов и онкобелков. 3. Проводит разработку методов генной и клеточной инженерии для получения принципиально новых пород животных и форм растений с более ценными признаками. 4. Изучает молекулярные основы памяти, психики, биоэнергетики, питания и целый ряд других задач. Клиническая химия (также известна как клиническая биохимия или медицинская биохимия) - область клинической лабораторной диагностики, использующая методы аналитической химии для исследования биологических объектов на предмет содержания определенных химических веществ с целью диагностики заболеваний или патологических состояний организма. СТРУКТУРА И ФУНКЦИИ БЕЛКОВВопрос №4 Аминокислоты - структурные мономеры белков. Общая характеристика, классификация (полярные, неполярные, полярные незараженные). Особенности образования пептидной связи. Первичный уровень организации белка. Белки – это биополимеры, состоящие из α-аминокислотных остатков, соединенных пептидной связью.
Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы В белках обнаружено 20 АМК. П 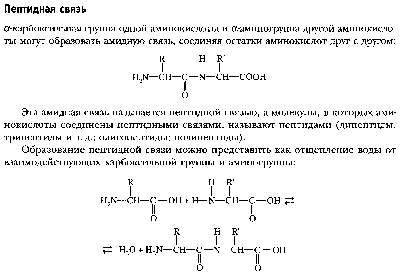 ри нейтральном рН - в виде биполярных ионов. ри нейтральном рН - в виде биполярных ионов.Классификация по заряду радикала:
  П 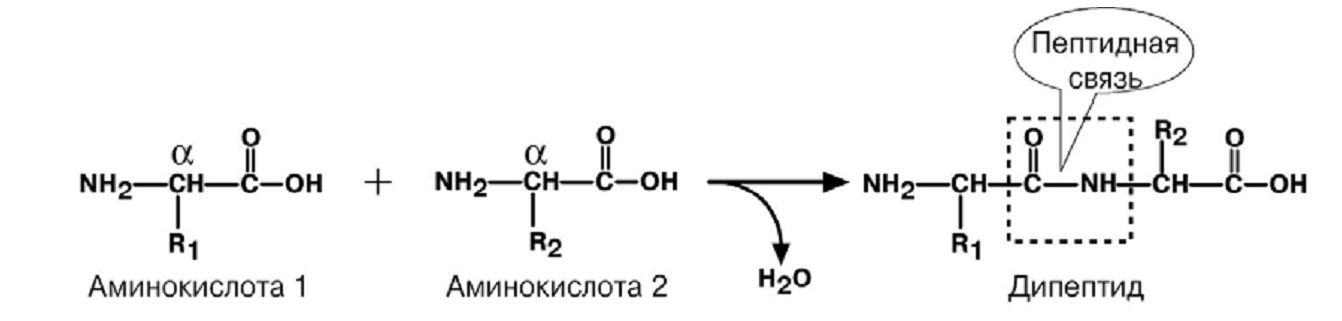 ервичная структура – последовательность аминокислотных остатков, соединенных пептидной связью. ервичная структура – последовательность аминокислотных остатков, соединенных пептидной связью.Н 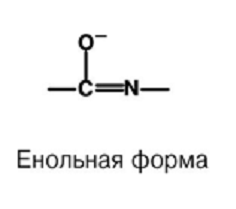 ачинается со свободной аминогруппы (N-конец), завершается свободной карбоксильной группой (С – конец). Нумерация с N-конца. Названия всех аминокислот с окончанием -ил, последней - как обычно. ачинается со свободной аминогруппы (N-конец), завершается свободной карбоксильной группой (С – конец). Нумерация с N-конца. Названия всех аминокислот с окончанием -ил, последней - как обычно.При рН > 7 (кровь) пептидная связь енолизируется. Наличие С = С придает пептидной связи планарный характер, т. е. вращение между N и О затруднено, что делает первичную структуру белков более жесткой. NB!: Первичная структура белка имеет важное значение для индивидуальных (нативных) свойств пептида, полипептида и белков, Т. Е. последовательность аминокислот в любом белке строго специфично и детерминирована генами. Такая последовательность аминокислот формирует уникальную для каждого белка вторичную, третичную и четвертичную структуру. К первичной структуре можно отнести дисульфидные мостики, образованные остатками цистеина. – S – S – Следовательно, первичная структура стабилизируется ковалентными связями между аминокислотными остатками. Вопрос №5 Вторичный уровень организации белка. Примеры. Связи, стабилизирующие структуру. Вторичная структура белков - пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова.
В 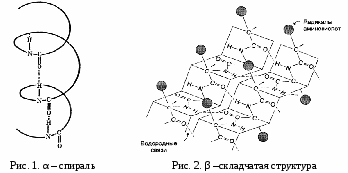 одородные связи играют роль во взаимодействии между молекулами Н2О, поддержании структуры белков, нуклеиновых кислот. Они всегда возникают между электроотрицательным атомом (N или О) и Н, который связан ковалентной связью с электроотрицательным атомом (через три на четвертый). одородные связи играют роль во взаимодействии между молекулами Н2О, поддержании структуры белков, нуклеиновых кислот. Они всегда возникают между электроотрицательным атомом (N или О) и Н, который связан ковалентной связью с электроотрицательным атомом (через три на четвертый). На один виток - 3,6 АМК-остатка, шаг -0,54 нм. Высокая степень α-спирализации характерная для миоглобина, гемоглобина. В чистом виде практически не встречается.
Вопрос №6 Третичная и четвертичная структуры белка. Связи, стабилизирующие белковую молекулу и определяющие ее конформацию. Третичная = глобула = субъединица = протомер - специфичная для каждого белка пространственная упаковка молекулы. Имеющие гидрофобный характер радикалы аминокислотных остатков ориентированы внутрь молекулы, а гидрофильные ( О+, NН3+, СОО- ) – на поверхности молекулы. Связи, стабилизирующие третичную структуру белка. В стабилизации третичной структуры играют роль связи между боковыми радикалами аминокислот:
Многочисленные связи между боковыми радикалами аминокислот определяют пространственную конфигурацию белковой молекулы. Четвертичная – нежесткое соединение отдельных третичных образований, которые называются субъединицами. Поддерживается водородными связями. Связи образуются в местах контакта глобул. Эти места должны обладать пространственным и электростатическим взаимодействием. Классический пример – гемоглобин, состоит из 4 субъединиц. В организме обнаружены более сложные структурные образования (некоторые ферментные комплексы, которые состоят из нескольких связанных четвертичных образований – пируватдекарбоксилазный комплекс). Вопрос №7 Денатруация и ренатурация белков Под денатурацией понимают утрату трехмерной конформации, присущей данной белковой молекуле. Это изменение может носить временный или постоянный характер, но и в том, и в другом случае аминокислотная последовательность белка остается неизменной. При денатурации молекула развертывается и теряет способность выполнять свою обычную биологическую функцию. Вызывать денатурацию белков могут разнообразные факторы. Нагревание или излучение белка, например инфракрасное или УФ. Кинетическая энергия, сообщаемая белку, вызывает вибрацию его атомов, вследствие чего слабые водородные и ионные связи разрываются,и белок свертывается (коагулирует). Сильные кислоты, щелочи, соли. Под действием этих реагентов ионные связи разрываются и белок коагулирует. Длительное воздействие реагента может вызвать разрыв и пептидных связей. Тяжелые металлы. Положительно заряженные ионы тяжелых металлов (катионы) образуют прочные связи с отрицательно заряженными карбоксил-анионами R-групп белка и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок. Органические растворители и детергенты. Эти реагенты нарушают гидрофобные взаимодействия и образуют связи с гидрофобными (неполярными) группами. В результате разрываются и внутримолекулярные водородные связи. Использование спирта в качестве дезинфицирующего средства основано именно на том, что он вызывает денатурацию белка любых присутствующих бактерий. Ренатурация белков Иногда денатурированный белок в подходящих условиях вновь спонтанно приобретает свою нативную структуру. Ренатурация убедительно показывает, что третичная структура белка полностью определяется его первичной структурой и что сборка биологических объектов может осуществляться на основе немногих общих принципов. Вопрос №8 Физико-химические свойства белков. Методы их выделения и очистки. Физико-химические свойства белков 1. Различия белков по форме молекул - делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки). 2. Различия белков по молекулярной массе. Белки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц). 3. Суммарный заряд белков. На N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apr и Гис. 4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков. На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде. 5. Растворимость. Зависит от всех перечисленных выше свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать выпадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков. Методы выделения и очистки белков Получение индивидуальных белков из биологического материала (тканей, органов, клеточных культур) требует проведения последовательных операций, включающих:
1. Методы разрушения тканей и экстракции белков: Гомогенизация биологического материала. Ткань, находящуюся в буферном растворе с определённым значением рН и концентрацией солей, помещают в стеклянный сосуд (гомогенизатор) с пестиком. Вращающийся пестик измельчает и растирает ткань о притёртые стенки сосуда. Метод замораживания и оттаивания ткани. В результате попеременного замораживания и оттаивания образующиеся кристаллы льда разрушают оболочки клеток. После разрушения ткани нерастворимые части осаждают центрифугированием. Последующее центрифугирование гомогената с разной скоростью позволяет получить отдельные фракции, содержащие клеточные ядра, митохондрии и другие органеллы, а также надосадочную жидкость, в которой находятся растворимые белки цитозоля. Искомый белок будет содержаться в одной из этих фракций. Экстракция белков, связанных с мембранами. Если искомый белок прочно связан с какими-либо структурами клетки, его необходимо перевести в раствор. Так, для разрушения гидрофобных взаимодействий между белками и липидами мембран в раствор добавляют детергенты; чаще всего используют тритон Х-100 или додецилсульфат натрия. При действии детергентов обычно разрушаются и гидрофобные взаимодействия между протомерами в олигомерных белках. Удаление из раствора небелковых веществ. Нуклеиновые кислоты, липиды и другие небелковые вещества можно удалить из раствора, используя их физико-химические свойства. Так, липиды легко удаляются из раствора добавлением органических растворителей, например ацетона. Однако воздействие должно быть кратковременным, так как ацетон вызывает денатурацию некоторых белков. Нуклеиновые кислоты осаждают добавлением в раствор стрептомицина. 2. Методы очистки белков. Наиболее трудоёмкий этап. Выделение и очистка белков происходят при низких температурах. На первых стадиях очистки белков целесообразно использовать методы, учитывающие какую-либо характерную особенность данного белка, например термостабильность или устойчивость в кислых растворах. Первыми методами очистки необходимо удалить из раствора основную массу балластных белков, которые значительно отличаются от выделяемого белка физико-химическими свойствами. Впоследствии применяют всё более тонкие методы очистки белка. Очистка белков избирательной денатурацией. Большинство белков денатурирует и выпадает в осадок уже при кратковременном нагревании раствора до 50-70 °С или подкислении раствора до рН 5. Если выделяемый белок выдерживает эти условия, то с помощью избирательной денатурации можно удалить большую часть посторонних белков, отфильтровав выпавшие в осадок-белки, или осадить их центрифугированием. Высаливание. Метод очистки белков, основанный на различиях в их растворимости при разной концентрации соли в растворе. Соли щелочных и щёлочно-земельных металлов вызывают обратимое осаждение белков, т.е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства. используют разные концентрации солей сульфата аммония - (NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима для его высаливания. Гель-фильтрация, или метод молекулярных сит. Вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества. В структуре полисахарида образуются поперечные связи и формируются гранулы с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор". Неподвижная фаза - жидкость внутри гранул, в которую способны проникать низкомолекулярные вещества и белки с небольшой молекулярной массой. Смесь белков, нанесённую на хроматографическую колонку, вымывают (элюируют), пропуская через колонку растворитель. Вместе с фронтом растворителя движутся и самые крупные молекулы. Более мелкие молекулы диффундируют внутрь гранул и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул. Ультрацентрифугирование. Скорость седиментации веществ в процессе вращения в ультрацентрифуге пропорциональна их молекулярной массе. На поверхность буферного раствора наносят тонкий слой смеси белков. При вращении в течение 10-12 ч более крупные молекулы (с большей молекулярной массой) оседают в буферном растворе с большей скоростью. В результате происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой. После расслоения белковых фракций дно кюветы прокаливают иглой и по каплям собирают содержимое небольшими порциями в пробирки. Электрофорез белков. Метод основан на том, что при определённом значении рН и ионной силы раствора белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки - к катоду (-). Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакриламидном геле. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду, в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам. Ионообменная хроматография. Так же как и электрофорез, метод основан на разделении белков, различающихся суммарным зарядом при определённых значениях рН и ионной силы раствора. При пропускании раствора белков через хроматографическую колонку, заполненную твёрдым пористым заряженным материалом, часть белков задерживается на нём в результате электростатических взаимодействий. В качестве неподвижной фазы используют ионообменники - полимерные органические вещества, содержащие заряженные функциональные группы. Различают положительно заряженные анионообменники, содержащие катионные группы, и отрицательно заряженные катионообменники, содержащие анионные группы. 3. Очистка белков от низкомолекулярных примесей. Диализ основан на том, что через полупроницаемую мембрану, пропускающую низкомолекулярные вещества, не проходят белки, имеющие более высокую молекулярную массу. В стакан большой ёмкости (около 1 л) с буферным раствором помещают полупроницаемый мешочек, заполненный раствором белка с солью. Скорость выхода соли из мешочка в буферный раствор пропорциональна градиенту его концентраций по обе стороны от мембраны. По мере выхода соли из мешочка буферный раствор в стакане меняют. Вопрос №9 Зависимость свойств белка от его конформации. Понятие об аллостерических белках. Аллостерические белки: аллостерические ферменты и регуляторные аллостерические белки. Последние лишены каталитической активности и регулируют синтез ферментов путём присоединения к бактериальной хромосоме вблизи соответствующих генов. Связывание регуляторных аллостерических белков с молекулами-эффекторами приводит к изменению скорости синтеза мРНК, кодируемых этими генами (регуляция на уровне синтеза ферментов). Для ключевых ферментов метаболизма, которые образуются вне зависимости от условий среды. Вопрос №10 Растворимость белка в воде. Реакции осаждения белка в водных растворах. Понятие об изоэлектрической точке.  О  саждение белков из растворов. При добавлении к водным растворам белков концентрированных растворов минеральных солей (например, (NH4)2SO4) белки осаждаются, аналогично действует на белок спирт, ацетон. Во всех этих случаях белки не изменяют своих свойств и при разбавлении водой вновь переходят в раствор. Этот процесс называется высаливанием. саждение белков из растворов. При добавлении к водным растворам белков концентрированных растворов минеральных солей (например, (NH4)2SO4) белки осаждаются, аналогично действует на белок спирт, ацетон. Во всех этих случаях белки не изменяют своих свойств и при разбавлении водой вновь переходят в раствор. Этот процесс называется высаливанием.1. Биуретовая реакция. При взаимодействии с солями меди (CuSO4) в щелочной среде все белки дают фиолетовое окрашивание. Эта реакция является качественной на пептидные связи и подтверждает наличие их в белках и полипептидах. Для различных полипептидов окраска, возникающая при взаимодействии с солями меди, неодинакова: дипептиды дают синюю окраску, трипептиды – фиолетовую, а более сложные полипептиды – красную. 2. Ксантопротеиновая реакция. При нагревании растворов белков с концентрированной азотной кислотой (HNO3) они окрашиваются в жёлтый цвет. Реакция объясняется наличием в белках аминокислот, содержащих ароматические углеводородные радикалы (С6Н5–), которые при взаимодействии с азотной кислотой образуют нитросоединения, окрашенные в жёлтый цвет. 3. Цистиновая реакция (сульфгидрильная). Если прокипятить раствор белка с избытком едкого натра и прибавить несколько капель раствора ацетата свинца Рb(СН3СОО)2, то появляется буро-чёрное окрашивание или осадок (PbS↓). Реакция подтверждает наличие слабо связанной серы в белках. Степень ионизации функциональных групп этих радикалов зависит от рН среды. При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. В щелочной среде связывание избытка ОН- с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков: -NH3+ +ОН- → -NH2 + H2O. Значение рН, при котором белок приобретает суммарный нулевой заряд, называют "изоэлектрическая точка" и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии. Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина. Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (- ). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле. Вопрос №13 Сложные белки. Липо- и фосфопротеины, структура и функции. Липопротеины (ЛП):
Белковая часть – апобелки. 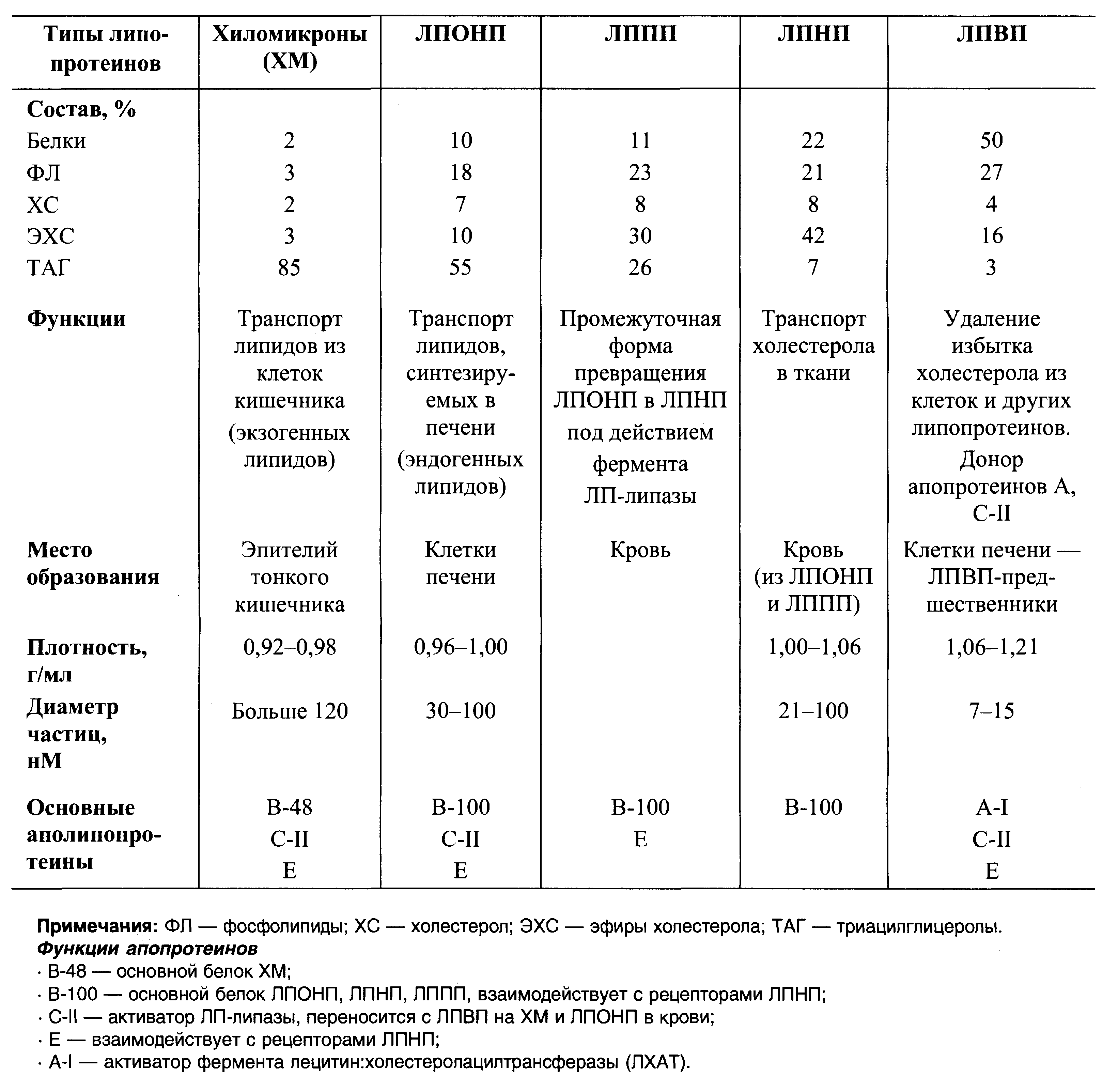 *: Гликопротеины, Нуклеопротеины, Хромопротеины, Фосфопротеины см. в распечатке по сложным белкам. |

 олярные - полярные положительно заряженные - Арг, Лиз, Гис. Наибольшая растворимость в воде.
олярные - полярные положительно заряженные - Арг, Лиз, Гис. Наибольшая растворимость в воде.