Ответы к экзамену По биохимии 1 структура и функции белков 3 ферменты 10 нуклеиновые кислоты и нуклеотиды 21
 Скачать 29.52 Mb. Скачать 29.52 Mb.
|
ОБМЕН ЛИПИДОВВопрос №81 Липиды. Классификация. Строение липидов мембран. Структурная организация мембран. Липиды – большая группа веществ, имеющих общее свойство – растворяются не в воде, а в органических растворителях. К липидам относятся:
Жирные кислоты (ЖК) – алифатические или линейные монокарбоновые кислоты (одна СООН-группа)
Функция:
Содержатся в жирах животного происхождения (твердые по консистенции) Например, пальмитиновая кислота -16 углеродных атомов:
Содержатся в жирах растительного происхождения (жидкие) Например, арахидоновая кислота (С20:4) – из нее синтезируются эйкозаноиды. Последний углеродный атом – ω (омега) ωСН3-…=…-αСООН По положению первой двойной связи от ω-конца существуют ω-6 (линолевая, арахидоновая и др.) и ω-3 (линоленовая) жирные кислоты. Линолевая, линоленовая, арахидоновая ЖК в организме не синтезируются, и должны поступать с пищей (эссенциальные ЖК). Триацилглицеролы (ТАГ) – сложные эфиры глицерола и жирных кислот. диацилглицеролы (ДАГ) моноацилгдлицеролы (МАГ) 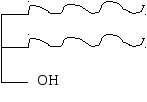 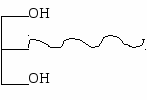 ДАГ и МАГ амфифильные (имеют гидрофобную и гидрофильную части). Функции:
Содержатся в сливочном масле, свином жире, растительном масле. Суточная потребность – 40-60 г/сут. Основу мембраны составляет липидный бислой – двойной слой молекул липидов, которые обладают свойствомамфифильности (содержат как гидрофильные, так и гидрофобные функциональные группы). В липидном бислое гидрофобные участки молекул взаимодействуют между собой, а гидрофильные участки обращены в окружающую водную среду. Все мембраны по своей организации и составу обнаруживают ряд общих свойств. Они:
Вопрос №82 Избирательная проницаемость мембран. Механизм переноса веществ через мембрану. скорость прохождения веществ меняется в зависимости от физиологического состояния клетки или органеллы. Благодаря избирательной проницаемости они регулируют транспорт веществ между наружной средой и клеткой, между органеллами цитоплазмой и т. д. Регулируя поступление веществ в клетку и их выведение, мембраны тем самым регулируют скорость и направление биохимических реакций, которые составляют основу обмена веществ организма. Сама избирательная проницаемость мембран зависит от обмена веществ в клетке. Мембраны регулируют обмен веществ и другим способом – изменяя активность ферментов. Некоторые ферменты активны только тогда, когда они прикреплены к мембране, другие, наоборот, в этом состоянии не проявляют активности и начинают действовать только после того, как мембрана выпустит их на «свободу». Изменение проницаемости мембраны может способствовать контакту фермента с субстратом, после чего начинается химическая реакция, которая сначала была невозможна. Мембранные ферменты работают хорошо только тогда, когда они находятся в контакте с липидами. В присутствии липидов может меняться форма молекул мембранных белков – ферментов, таким образом, что их активные центры становятся доступным для субстрата. Кроме того, локализация фермента на мембране определяет место данной реакции в клетке. Другой важной стороной ферментативной деятельности мембран является координация химических реакций, проходящих в клетках. Когда несколько ферментов катализируют цепь реакций, в которой продукт первой реакции служит субстратом для другой и т. д., то эти ферменты располагаются на мембране в определенной последовательности, образуя мультиферментную систему. Таких систем в мембране много, например цепь дыхательных ферментов. В этом случае ферменты располагаются в строгой последовательности с минимальным расстоянием между ними. Механизмы транспорта веществ через мембрану 1. Простая диффузия жирорастворимых (гидрофобных) веществ через жировой слой мембраны. Это пассивный процесс под действием градиента (перепада) концентрации вещества по разные стороны мембраны. 2. Неуправляемая диффузия (пассивный перенос) водорастворимых веществ через постоянно открытые ионные каналы мембраны. 3. Управляемая диффузия (управляемый пассивный перенос) водорастворимых веществ через управляемые ионные каналы мембраны. 4. Активный транспорт водорастворимых веществ с помощью специальных белковых транспортных структур (транспортёров) за счёт использования энергии расщепления АТФ. Вопрос №87 Переваривание и всасывание жиров. Ресинтез жиров. Особенность: все пищевые жиры депонируются в жировой ткани. Ассимиляция пищевых жиров.
2) всасывание 3) ресинтез 4) образование транспортных форм 5) транспорт кровью 6) депонирование в жировой ткани 7) утилизация транспортных форм (в печени) Жиры не перевариваются в ротовой полости и желудке, перевариваются в тонком кишечнике. 1) Переваривание. 1а) Кислое содержимое желудка попадает в кишечник и вызывает выделение клетками кишечника биологически активного вещества – холецистокинина. Он вызывает сокращение желчного пузыря и поступление желчи в кишечник. Желчь содержит желчные кислоты, фосфолипиды, холестерол, пигмент билирубин, белки, минеральные соли. Функция желчи:
Основной компонент желчи – желчные кислоты (ЖчК):
Все ЖчК амфифильные (гидрофобное кольцо и гидрофильные ОН-группы). ЖчК встраиваются в жировую каплю гидрофобным кольцом. ОН-группы остаются снаружи и снижают поверхностное натяжение жировой капли, которая распадается. Функция эмульгирования:
1б) гидролиз жиров под действием липазы (фермент поджелудочной железы). Липаза действует на эмульгированные жиры и образуется 3 продукта:
Образуется β-МАГ, т.к. в α- и γ-положениях ЖК отщепляются быстро, а в β- – медленно. 2 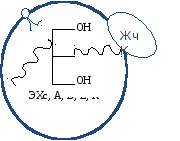 ) Всасывание продуктов гидролиза в виде смешанных мицелл, а глицерол всасывается самостоятельно (водорастворимый). ) Всасывание продуктов гидролиза в виде смешанных мицелл, а глицерол всасывается самостоятельно (водорастворимый).Смешанная мицелла – мельчайшая круглая частица, которая состоит из двух частей:
При нарушении переваривания (камни в желчном пузыре или панкреатит) жиры не усваиваются, а выделяется «жирный» кал. 3) Ресинтез – синтез жиров из компонентов, на которые он распался (ЖК и β-МАГ). Значение - в клетках кишечника образуются жиры, индивидуальные для каждого человека, т.к. используются свои ЖК. Механизм: в клетках кишечника смешанная мицелла распадается на:
Чтобы ЖК включить в β-МАГ, они должны быть активированы. А 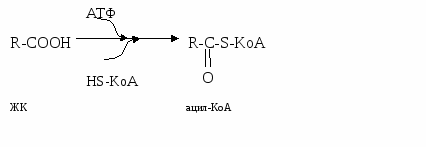 ктивация ЖК: ктивация ЖК:Вопрос №88 Образование в кишечнике транспортных форм липидов. Роль апобелков. Значение хиломикронов и ЛОНП в транспорте жира из кишечника. Гиперхиломикронемия. Ресинтезированные ТАГ, Эхс, A, D, E, K упаковываются в транспортную форму – липопротеин. Липопротеины (ЛП):
Белковая часть – апобелки. Функции апобелков:
4) Образование хиломикронов В клетках кишечника под действием апобелка В48 собирается крупная транспортная форма – ХМ. Функция ХМ:
ХМ имеет:
 5) Транспорт кровью Т.к. ХМ крупный, он попадает в кровь через лимфатическую систему. В крови от ЛВП он получает два апобелка - С-II и Е  7) Утилизация ХМ По апобелку Е Хмост. Узнается гепатоцитами и поглощается ими. Апобелок Е возращается на ЛВП. Хмост. Разрушается лизосомальными ферментами:
Жиры, синтезированные в печени, упаковываются в транспортную форму – ЛОНП. 1.Он состоит из двух частей:
 2. ЛОНП незр. поступает в кровь, где от ЛВП получает апобелки С-II и Е и становится зрелым. 3. ЛОНП зр. поступает к ЛП-липазе, которая узнает его по С-II и активируется. Она расщепляет 55% жиров на ЖК и глицерол.
4. Все, что остается от ЛОНП (без жиров)  ЛНП содержит >50% холестерола, который снабжает все органы и ткани. ЛНП – атерогенная частица, может внедряться в эндотелий, где разрушается, а Хс откладывается в виде атеросклеротических бляшек (снижается эластичность сосуда, уменьшается просвет). При хроническом алкоголизме наблюдается жировое перерождение печени, т.к. нарушается синтез ЛОНП и жиры не удаляются из печени. Вопрос №89 Депонирование и мобилизация жиров в жировой ткани, их горомнальная регуляция. Роль ЛП-, ТАГ-липаз. Ожирение. Вопрос №90. Биосинтез триглицеридов. Синтез жиров в жировой ткани, их горомнальная регуляция. Роль инсулина. 6) Депонирование На поверхности эпителия сосудов жировой ткани и мышц находится фермент ЛП-липаза. Ее синтез стимулируется инсулином, т.е. она активна в жировой ткани после приема пищи. ЛП-липаза узнает ХМзр. По С-II, активируется и расщепляет ТАГ на 2 продукта:
Все, что осталось от ХМ – ХМ остаточный. После этого С-II возвращается на ЛВП. При голодании или длительной физической нагрузке выделяется глюкагон или адреналин. Они активируют в жировой ткани ТАГ-липазу, которая находится в адипоцитах и называется тканевой липазой (гормончувствительная). Она расщепляет жиры в жировой ткани на глицерол и ЖК. Глицерол идет в печень на глюконеогенез. ЖК поступают в кровь, связываются с альбумином и поступают к органам и тканям, используются как источник энергии (всеми органами, кроме мозга, который использует глюкозу и кетоновые тела при голодании или длительной физической нагрузке). В организме могут синтезироваться эндогенные жиры. При большом поступлении углеводов и низких физических нагрузках избыток глюкозы → жиров. Жиры синтезируются в печени и жировой ткани. Жиры синтезируются из двух субстратов:
Глицерол-3Ф ← глицерол из ДАФ (промежуточный продукт гликолиза) Жирная кислота синтезируется из глюкозы. В печени глицерол-3Ф можно получить двумя путями. В жировой ткани – только из глюкозы. С 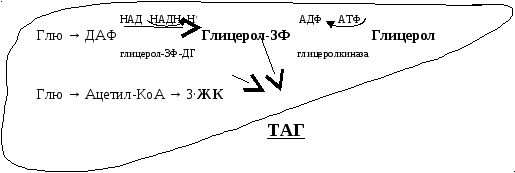 интез в печени интез в печениСинтез в жировой ткани После приема пищи уровень инсулина в крови повышается, он активирует ГЛЮТ-4, и глюкоза поступает в жировую ткань, где из нее синтезируются два субстрата синтеза жиров. 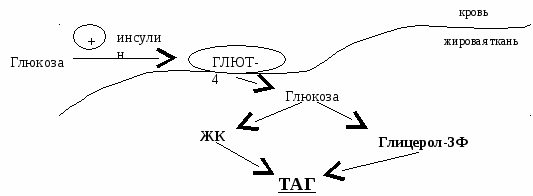 Таким образом, в жировой ткани депонируются жиры:
Вопрос №92 Окисление жирных кислот. Значение, сущность, последовательность реакций. Энергетика процессов. Регуляторная реакция. Связь с ЦПЭ и ЦТК. β-окисление – процесс расщепления ЖК с целью извлечения энергии.
окисление → гидратация → окисление → расщепление.
Механизм переноса ЖК из цитоплазмы в митохондрию. 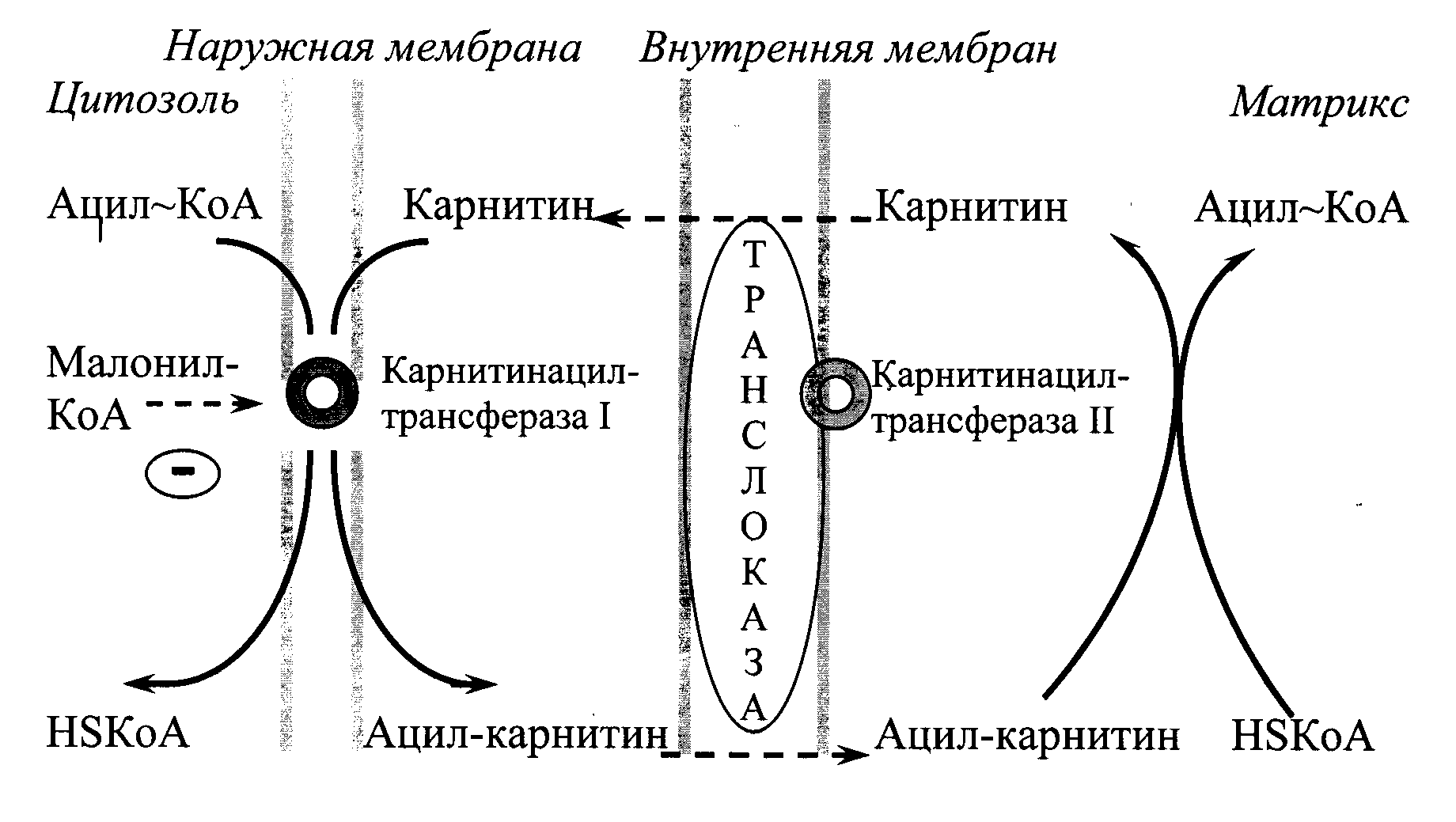
Только активированная ЖК = ацил-КоА может транспортироваться через двойную мембрану липидов. Переносчик – L-карнитин. Регуляторный фермент β-окисления – карнитинацилтрансфераза-I (KAT-I).
Образуется ацилкарнитин.
Карнитин возвращается обратно в межмембранное пространство. Реакции β-окисления
ФАД поступает в ЦПЭ (р/о=2)
Ацетил-КоА → ЦТК → 12 АТФ. Ацил-КоА (С-2) → следующий цикл β-окисления. Подсчет энергии при β-окислении На примере меристиновой кислоты (14С).
½ n = 7 → ЦТК (12АТФ) → 84 АТФ.
(1/2 n)-1=6·5(2 АТФ за 1 реакцию и 3 АТФ за 3 реакцию) = 30 АТФ
Итого – 113 АТФ. Вопрос №94 Кетоновые тела. Химическая природа, роль, синтез, диагностическое значение определения кетоновых тел в моче. Почти весь ацетил-КоА вступает в ЦТК. Небольшая часть используется для синтеза кетоновых тел. Кетоновые тела – ацетоацетат, β-гидроксибутират, ацетон (при патологии). Нормальная концентрация – 0,03-0,05 ммоль/л. С 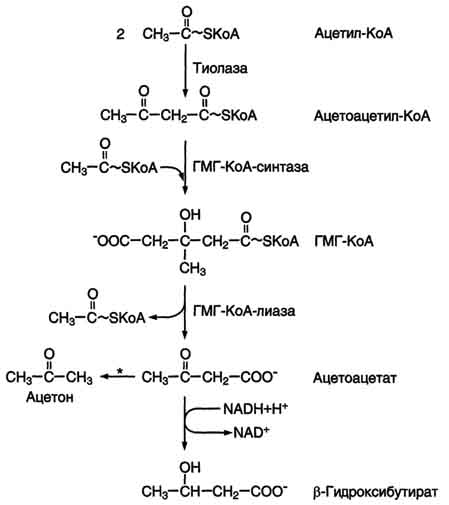 интезируются только в печени из ацетил-КоА, полученного при β-окислении. интезируются только в печени из ацетил-КоА, полученного при β-окислении.Используются как источник энергии всеми органами кроме печени (нет фермента). При длительном голодании или сахарном диабете концентрация кетоновых тел может увеличиваться в десятки раз, т.к. в этих условиях ЖК являются основным источником энергии. В этих условиях протекает интенсивное β-окисление, и весь ацетил-КоА не успевает утилизироваться в ЦТК, т.к.:
Следовательно, ацетил-КоА идет на синтез кетоновых тел. Т.к. кетоновые тела – кислоты, они вызывают сдвиг кислотно-щелочного равновесия. Возникает ацидоз (из-за кетонемии). Они не успевают утилизироваться и появляются в моче как патологический компонент → кетоурия. Также появляется запах ацетона изо рта. Это состояние называется кетоз. Вопрос №97 Биосинтез жирных кислот: последовательность реакций, локализация процесса, характристика ферментов, регуляция. Синтез пальмитиновой кислоты (С16) из Ацетил-КоА.
конденсация → восстановление → дегидратация → восстановление. В конце каждого цикла ЖК удлиняется на 2 углеродных атома. Донор 2С – малонил-КоА.
Остальные 4 циклических – на специальном пальмитатсинтазном комплексе (синтез только пальмитиновой кислоты)
Строение пальмитатсинтазного комплекса Пальмитатсинтаза – фермент, состоящий из 2 субъединиц. Каждая состоит из одной ппц, на которой есть 7 активных центров. Каждый активный центр катализирует свою реакцию. В каждой ппц находится ацилпереносящий белок (АПБ), на котором проходит синтез (содержит фосфопантетонат). В каждой субъединице есть HS-группа. В одной HS-группа принадлежит цистеину, в другой – фосфопантотеновой кислоте. 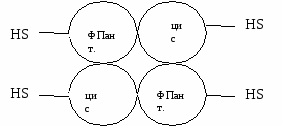 Механизм
Активирование фермента ацетил-КоА-карбоксилазы:
7) один ацетил КоА из цитоплазмы перемещается на HS-группу (от цистеина) пальмитат-синтазы; один малонил-КоА – на HS-группу второй субъединицы. Далее на пальмитат синтазе происходят: 8) их конденсация (ацетил КоА и малонил-КоА) 9) восстановление (донор – НАДФН+Н+ из ПФП) 10) дегидротация 11) восстановление (донор – НАДФН+Н+ от МАЛИК-фермента). В результате ацильный радикал увеличивается на 2 атома углерода. 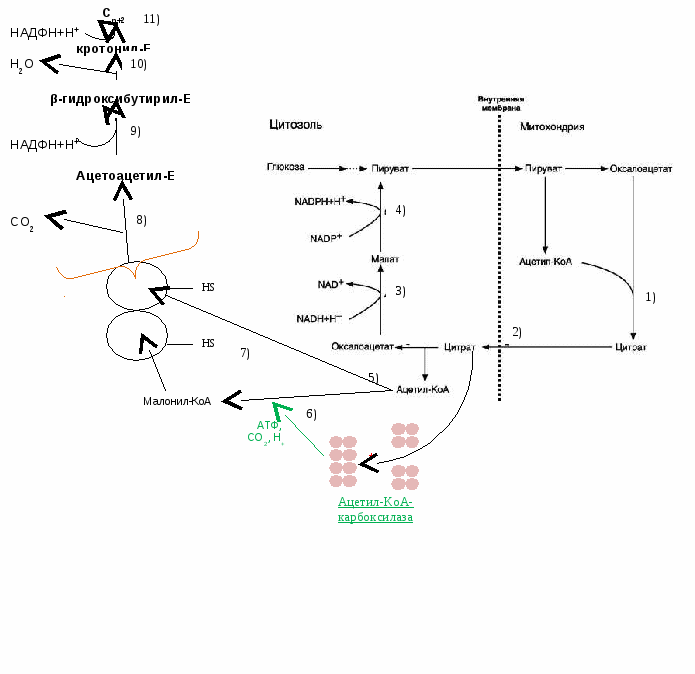 Вопрос № 98 Холестерин: синтез, биологическая роль, обмен. Холестерол (Хс) – одноатомный спирт, в основе которого лежит циклопентанпергидрофенантреновое кольцо. 27 углеродных атомов. Нормальная концентрация холестерола – 3,6-6,4 ммоль/л, допускается не выше 5. Функции:
В организме содержится около 140 г холестерола ( в основном, в печени и мозге). Суточная потребность – 0,5-1 г. Содержится только в продуктах животного происхождения (яйца, сливочном масле, сыр, печень). Хс не используется как источник энергии, т.к. его кольцо не расщепляется до СО2 и Н2О и не выделяется АТФ (нет фермента). Избыток Хс не выводится, не депонируется, откладывается в стенке крупных кровеносных сосудов в виде бляшек. В организме синтезируется 0,5-1 г Хс. Чем больше потребляется его с пищей, тем меньше синтезируется в организме (в норме). Хс в организме синтезируется в печени (80%), кишечнике (10%), коже (5%), надпочечниках, половых железах. Даже у вегетарианцев может быть повышен уровень холестерина, т.к. для его синтеза необходимы только углеводы. Биосинтез холестерола Протекает в 3 стадии:
Около 100 реакций. Регуляторный фермент – β-гидроксиметилглутарил-КоА-редуктаза (ГМГ-редуктаза). Статины, понижающие уровень холестерола, ингибируют этот фермент). Регуляция ГМГ-редуктазы:
Холестерол синтезируется из ацетил-КоА, полученного из углеводов (гликолиз → ОДПВК). Образовавшийся холестерол в печени упаковывается вместе с жиром в ЛОНП незр. ЛОНП имеет апобелок В100, поступает в кровь и после присоединения апобелков С-Iiи Е превращается в ЛОНП зрелый, который поступает к ЛП-липазе. ЛП-липаза удаляет из ЛОНП жиры (50%), остается ЛНП, состоящий на 50-70% из эфиров холестерола. ЛНП:
При сахарном диабете может происходить гликозилирование В100 (присоединение глюкозы). Следовательно, клетки не узнают ЛНП и возникает гиперхолестеролемия. ЛНП может проникать в сосуды (атерогенная частица). Более 50% ЛНП возвращаются в печень, где холестерол используется на синтез ЖчК и ингибирование собственного синтеза холестерола. Существует механизм защиты от гиперхолестеролемии:
ЛВП синтезируется в печени. Имеет дисковидную форму, содержит мало холестерола. Функции ЛВП:
Механизм функционирования ЛВП: ЛВП имеет апобелок А1 и ЛХАТ (фермент лецитинхолестеринацилтрансфераза). ЛВП выходит в кровь, и к нему подходит ЛНП. По А1 ЛНП узнаются, что в них много холестерола, и активируют ЛХАТ. ЛХАТ отщепляет ЖК от фосфолипидов ЛВП и переносит на холестерол. Образуются эфиры холестерола. Эфиры холестерола гидрофобны, поэтому переходят внутрь липопротеина Вопрос №100 Биосинтез желчных кислот. Желче-каменная болезнь. В печени 300-500 мг холестерола ежесуточно окисляется в желчные кислоты. Желчные кислоты выполняют следующие функции: • участвуют в переваривании и всасывании липидов; • являются конечными продуктами катаболизма холестерола, в виде которых он экскретируется с калом из организма; • являются компонентами желчи, удерживающими холестерол в растворенном состоянии. 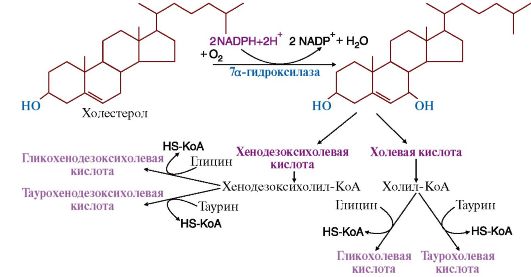 Синтез желчных кислот происходит в мембранах эндоплазматического ретикулума гепатоцитов под действием гидроксилаз (цитохромов, в состав которых входит цитохром Р450), катализирующих включение гидроксильных групп в положение 7α, 12α, с последующим укорочением бокового радикала в положении 17, с окислением его до карбоксильной группы, откуда и происходит название - желчные кислоты. Синтез желчных кислот происходит в мембранах эндоплазматического ретикулума гепатоцитов под действием гидроксилаз (цитохромов, в состав которых входит цитохром Р450), катализирующих включение гидроксильных групп в положение 7α, 12α, с последующим укорочением бокового радикала в положении 17, с окислением его до карбоксильной группы, откуда и происходит название - желчные кислоты. Регуляторный фермент синтеза желчных кислот 7а-гидроксилаза; его ингибитором являются желчные кислоты. Первичные желчные кислоты - холевая и хенодезоксихолевая - подвергаются реакции конъюгации - связыванию с глицином и таурином, в результате чего увеличиваются их эмульгирующие свойства Образующиеся в печени холевая и хенодезоксихолевая кислоты называются первичными желчными кислотами. Они этерифицируются глицином или таурином, давая парные (или конъюгированные) желчные кислоты, и в такой форме секретируются в желчь. В процесс конъюгации желчные кислоты вступают в активной форме в виде производных Холестерол индуцирует синтез этого фермента, но подавляет экспрессию гена ГМГ-КоА-редуктазы. Таким образом эти эффекты поддерживают необходимый уровень свободного холестерола в печени. Тиреоидные гормоны индуцируют синтез 7а-гидроксилазы, а эстрогены являются корепрессорами и подавляют транскрипцию гена этого фермента. Желчные кислоты, синтезированные в печени, секретируются в желчный пузырь и накапливаются в желчи. При приеме жирной пищи выделяется гормон холецистокинин, который стимулирует сокращение желчного пузыря, желчь изливается в тонкий кишечник, эмульгирует жиры и обеспечивает их переваривание и всасывание. Когда первичные желчные кислоты достигают нижних отделов тонкой кишки, они подвергаются действию ферментов бактерий, которые сначала отщепляют глицин и таурин, а затем удаляют 7а-гидроксильную группу. Так образуются вторичные желчные кислоты: дезоксихолевая и литохолевая кислоты. Около 95% желчных кислот всасывается в подвздошной кишке и возвращается в печень, где они опять конъюгируются с таурином и глицином и выделяются в желчь. В результате в желчи находятся и первичные и вторичные желчные кислоты. Весь этот путь желчных кислот называется энтерогепатическая циркуляция желчных кислот. В норме количество желчных кислот и холестерола, удаляющихся через кишечник, составляет 1,0-1,3 г за сутки, т.е. более 90% от количества холестерола, которое поступает с пищей и синтезируется в тканях. Так поддерживается гомеостаз этого стероида в организме человека. В составе желчи содержатся: холестерол, желчные кислоты, фосфатидилхолин и пигменты, образующиеся при распаде гема. Холестерол наименее полярное вещество и удерживается в растворенном состоянии только благодаря включению в мицеллы, образованные желчными кислотами и фосфатидилхолином. Если содержание холестерола в желчи увеличивается или уменьшается количество желчных кислот и фосфатидилхолина, то холестерол выпадает в осадок, образуя камни в желчном пузыре. Камни, состоящие из холестерола, - белые, если в них включаются продукты распада гема, то цвет камней может быть от коричневого до черного. |

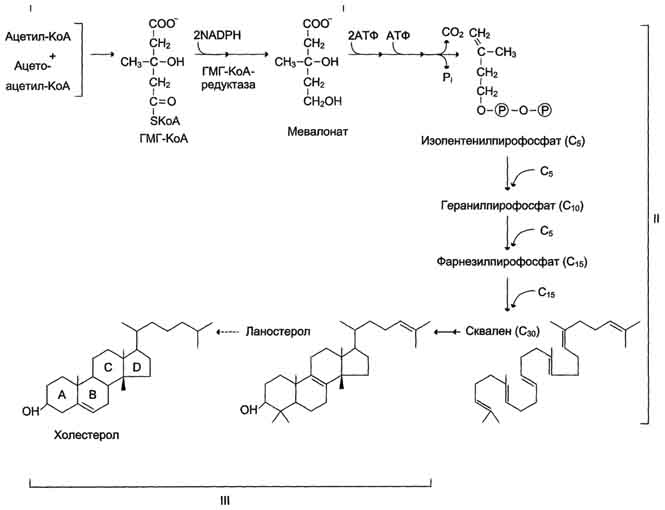 цитоплазме - до образования мевалоновой кислоты (похоже на синтез кетоновых тел)
цитоплазме - до образования мевалоновой кислоты (похоже на синтез кетоновых тел)