Ответы к экзамену По биохимии 1 структура и функции белков 3 ферменты 10 нуклеиновые кислоты и нуклеотиды 21
 Скачать 29.52 Mb. Скачать 29.52 Mb.
|
ФЕРМЕНТЫВопрос №17 Химическая структура и функции ферментов. Единицы ферментативной активности. Ферменты (Е) – биологически активные вещества, ускоряющие химические реакции в организме (в 1000 раз) за счет снижения энергии активации веществ. Энергия активации – энергия, которую необходимо придать веществу, чтобы оно вступило в реакцию. Свойства ферментов (отличие от неорганических катализаторов)
3) В ходе реакции не расходуются 4) Термолабильны (активность зависит от температуры) 5) Активность ферментов может регулироваться. Ингибиторы – вещества, подавляющие активность ферментов. Активаторы – вещества, повышающие активность ферментов.
Определение активности изоформ данного используется для диагностики заболеваний органов. З У Название ферментов Название субстрата + тип катализируемой реакции + -аза Например, пируват.декарбоксил.аза, малат.дегидроген.аза Вопрос №27 Изоферменты (определение понятия, строение и свойства на примере лактатдегидрогеназы или креатинкиназы). И
зоферменты – множественные формы фермента, которые катализируют одну и ту же реакцию, но в разных органах. Они отличаются по:
Например, ЛДГ (лактатдегидрогеназа) катализирует реакции ПВК ↔ лактат в разных органах. Ф  ермент состоит из 4 субъединиц двух типов: ермент состоит из 4 субъединиц двух типов: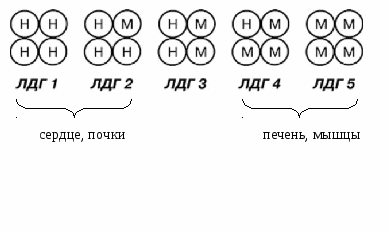 И существует 5 типов (изоформ) фермента Методом электрофореза установлено, что ЛДГ 1 и меньше ЛДГ 2 присутствуют в сердечной мышце, в почках. ЛДГ 4 и ЛДГ 5 – в печени и мышцах. Вопрос №18 Строение ферментов: активный и аллостерический центры. Понятие комплементарности между активным центром фермента и субстратом.
1 – АЦ имеют все ферменты Активный центр – небольшой участок фермента, который образован радикалами аминокислотных остатков, которые на уровне третичной структуры формируют центр взаимодействия с субстратом (центр, комплементарный субстрату). Комплементарность – геометрическое (пространственное) и электростатическое (по заряду) соответствие между активным центром и субстратом. Р  адикалы аминокислот, которые участвуют в образовании активного центра, могут находиться на расстоянии друг от друга в полипептидной цепи, но при формировании активного центра они сближаются. адикалы аминокислот, которые участвуют в образовании активного центра, могут находиться на расстоянии друг от друга в полипептидной цепи, но при формировании активного центра они сближаются.Активный центр состоит из двух участков:
В момент взаимодействия активного центра и субстрата между ними возникают слабые нековалентные связи. 2  - АлЦ – (есть не у всех ферментов) = регуляторный центр, т.к. к нему могут присоединяться активаторы и ингибиторы и регулировать активность ферментов. - АлЦ – (есть не у всех ферментов) = регуляторный центр, т.к. к нему могут присоединяться активаторы и ингибиторы и регулировать активность ферментов.АлЦ и АЦ должны быть пространственно разделены: АЦ в одной субъединице, АлЦ - в другой. Следовательно, аллостерические ферменты – олигомерные белки (четвертичная структура). Субъединица с АлЦ – регуляторная. Субъединица с АЦ – каталитическая. NB!: Аллостерические ферменты катализируют ключевые реакции метаболических путей. Вопрос №21 Общая характеритсика кофакторов и коферментов, их роль в катализе. Примеры. 3 – Кофакторы – вещества небелковой природы, необходимые для проявления активности ферментов (есть не у всех ферментов)
А) Ионы металлов:
Б) Коферменты
Е 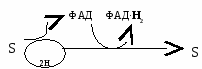 сли в реакции субстрат будет окисляться (т.е. от него отщепляется 2Н), то кофермент будет восстанавливаться. сли в реакции субстрат будет окисляться (т.е. от него отщепляется 2Н), то кофермент будет восстанавливаться.Вопрос №19 Классификация ферментов. Примеры для каждого класса ферментов В 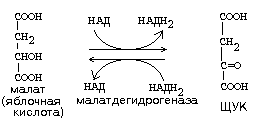 основе – тип катализируемой реакции (то, как фермент действует на субстрат). Выделяют 6 классов ферментов: основе – тип катализируемой реакции (то, как фермент действует на субстрат). Выделяют 6 классов ферментов:I класс – оксидоредуктазы: осуществляют ОВР, т.е. реакции с участием кислорода, отщеплением или присоединением 2Н с участием коферментов ФАД и НАД+, перемещающих электроны. II класс – трансферазы: осуществляют межмолекулярный перенос групп атомов (кроме 2Н) от одного субстрата к другому. Аминотрансферазы, ацилтрансферазы, метилтранс-феразы, гликозилтрансферазы, киназы (фосфо-трансферазы).  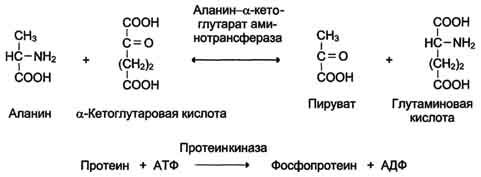 III класс – гидролазы: расщепляют связи в присутствии воды (ферменты ЖКТ).  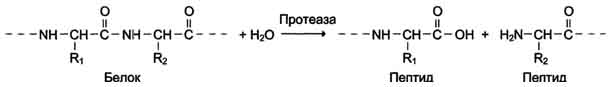 I 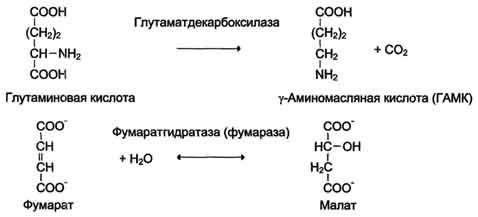 V класс – лиазы: отщепляют карбокси-, аминогруппы, воду (с образованием двойных связей) негидролитически. V класс – лиазы: отщепляют карбокси-, аминогруппы, воду (с образованием двойных связей) негидролитически. V класс – изомеразы: внутримолекулярный перенос групп атомов или превращение изомеров.   V 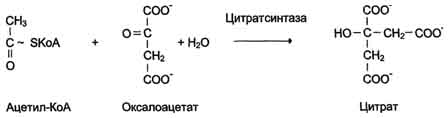 I класс – лигазы = синтетазы: участвуют в процессах синтеза с затратой АТФ и витамина Н (биотина). I класс – лигазы = синтетазы: участвуют в процессах синтеза с затратой АТФ и витамина Н (биотина).АТФ может участвовать в реакциях:
Вопрос №20 Механизм действия ферментов. Уравнение ферментативного катализа. Теории Кошланда и Фишера. Описывается уравнением ферментативного катализа E+S ↔ ES → ES* → EP → E+P
Количество фермента не меняется. С  уществует множество теорий ферментативного катализа. Основные: уществует множество теорий ферментативного катализа. Основные:
Противоречия: Нет соответствия в термодинамических расчетах (разница в расчетном количестве выделяемой энергии и практически выделяемом количестве энергии). По этой теории фермент может ошибаться и присоединять похожий субстрат. Субстраты часто низкомолекулярные вещества, а ферменты высокомолекулярные, содержащие большое число аминокислот. Теория не объясняла существование групповой специфичности.
Происходит подгонка. В субстрате происходит изменение связей. Наличие активных центров определяют специфичность.   Различают два главных вида специфичности ферментов: субстратную специфичность и специфичность действия. СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ. Это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента. Различают 3 типа субстратной специфичности: 1) АБСОЛЮТНАЯ субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата. 2) ОТНОСИТЕЛЬНАЯ субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов. 3) СТЕРЕОСПЕЦИФИЧНОСТЬ - способность фермента катализировать превращения определенных стереоизомеров. Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностью одновременно. СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ. Специфичность действия - это способность фермента катализировать только определенный тип химической реакции. В соответствии со специфичностью действия все ферменты делятся на 6 классов. Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре. Вопрос №22 Регуляция активности ферментов: фосфорилирование-дефосфорилирование, частичный протеолиз, отщепление-присоединение белков-ингибиторов. Аллостерическая регуляция. Примеры. В основе всех 4 типов регуляции лежит изменение конформации ферментов.
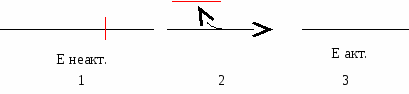
Так действуют ферменты, участвующие в переваривании. Например, неактивный трипсиноген (фермент поджелудочной железы) активируется путем отщепления шести аминокислотных остатков: 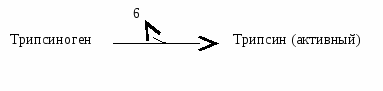
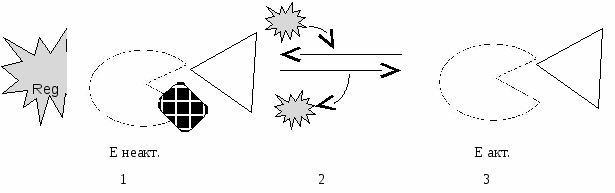
Н 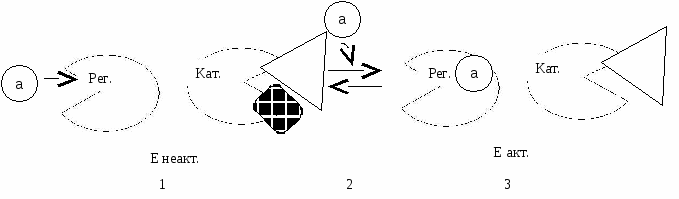 апример, к неактивному ферменту регуляторной субъединицы (с АлЦ) присоединяется активатор. апример, к неактивному ферменту регуляторной субъединицы (с АлЦ) присоединяется активатор.
Так же можно подавить активность фермента ингибитором. Вопрос №26 Значение ферментов в обмене веществ. Понятие о метаболических путях Например: В метаболических путях аллостерические ферменты катализируют ключевые реакции метаболизма и могут ингибироваться конечным продуктом метаболического пути. Такой вид ингибирования - обратная отрицательная связь = ретроингибирование. М 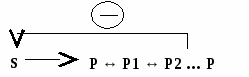 етаболический путь – цепь последовательных биохимических реакций, в которых продукт одной реакции является субстратом для следующей реакции. етаболический путь – цепь последовательных биохимических реакций, в которых продукт одной реакции является субстратом для следующей реакции.Аллостерические ферменты катализируют необратимые реакции и часто ингибируются конечным продуктом (ретроингибирование). Вопрос №23 Кинетические зависимости ферментативных реакций. Факторы, влияющие на кинетику: температура, рН среды, концентрация фермента и субстрата. Кинетика ферментативных реакций Изучает зависимость скорости ферментативных реакций от различных факторов (рН, температура, давление, концентрация фермента, субстрата, продукта и т.д.). Зависимость скорости реакции от рН: Изменение рН среды влияет на ионизацию групп в АЦ и субстрате. Может возникнуть денатурация. Денатурация – разрушение нативной (природной) конформации фермента с потерей биологических функций. Н 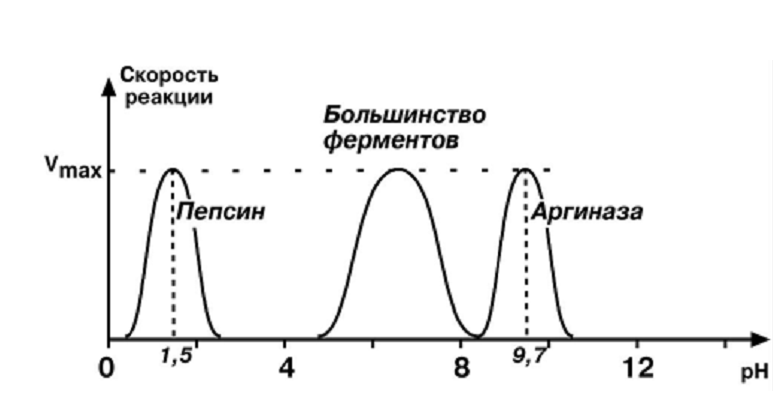 ативная конформация – конформация, в которой фермент (любой белок) проявляет свою активность. ативная конформация – конформация, в которой фермент (любой белок) проявляет свою активность. Большинство ферментов имеют наибольшую активность при рН 6,5 – 7. Исключения: пепсин – рН 1,5 – 2, щелочная фосфатаза – рН 9-10. Оптимальная рН – рН среды, при которой скорость реакции максимальна. Максимальная скорость реакции – это скорость, при которой весь фермент занят субстратом (весь фермент в ES-комплексе). Пример влияния рН среды на скорость реакции: П 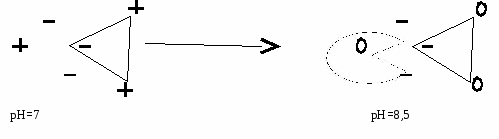  ри помещении фермента и субстрата в щелочную среду происходит изменение ионизации групп в АЦ и S, т.к. отрицательный заряд среды нейтрализует положительные заряды и усиливает отрицательные → нет соответствия по заряду → E и S не взаимодействуют → скорость реакции падает: ри помещении фермента и субстрата в щелочную среду происходит изменение ионизации групп в АЦ и S, т.к. отрицательный заряд среды нейтрализует положительные заряды и усиливает отрицательные → нет соответствия по заряду → E и S не взаимодействуют → скорость реакции падает:З 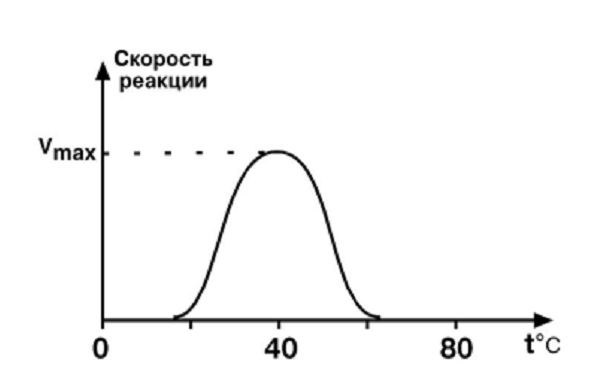 ависимость скорости реакции от температуры: ависимость скорости реакции от температуры: До оптимальной температуры (см. определение рН) 35-40°С зависимость скорости от температуры подчиняется правилу Вант-Гоффа: увеличение температуры на 10 °С ведет к увеличению скорости реакции в 2 раза. После достижения оптимальной температуры дальнейшее ее повышение приводит к снижению скорости реакции. При температуре выше 70°С реакция не идет, т. к. это связано с тепловой денатурацией фермента. З 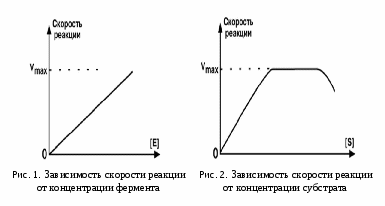 ависимость скорости реакции от концентрации фермента (рис. 1) – при условии, что субстрата много ([S]=∞). ависимость скорости реакции от концентрации фермента (рис. 1) – при условии, что субстрата много ([S]=∞).Зависимость скорости реакции от концентрации субстрата (рис.2) При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax. Вопрос №24 Сродство между субстратом и ферментом. Понятие о константе Михаэлиса. Уравнение Михаэлиса-Ментен. концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г. Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата. Если концентрация субстрата значительно больше Km (S >> Km), to увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax - величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата. Если концентрация субстрата значительно меньше Km(S << Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна концентрации субстрата (реакция имеет первый порядок). Vmах и Km - кинетические характеристики эффективности фермента. Vmax дает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т.е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата. Кm характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Чем меньше Кm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату. З 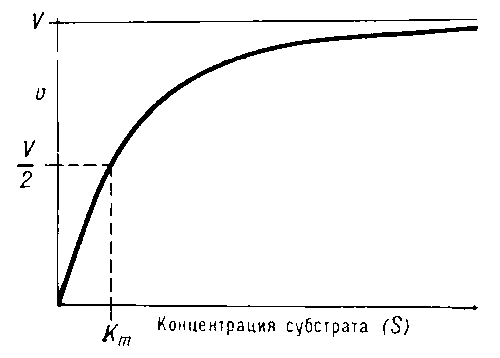 ависимость скорости реакции от концентрации субстрата описывается гиперболической кривой (уравнение Михаэлиса-Ментена). ависимость скорости реакции от концентрации субстрата описывается гиперболической кривой (уравнение Михаэлиса-Ментена).KМ — константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной Константа Михаэлиса характеризует сродство фермента к субстрату . Высокое сродство фермента к субстрату характеризуется низкой величиной km и наоборот. Вопрос №25 Ингибирование активности ферментов: обратимое и необратимое. Конкурентное и неконкурентное. Уравнение Лайунивера-Берка. Ингибиторы – низкомолекулярные вещества, уменьшающие активность ферментов. По степени связывания фермента и ингибитора:
Обратимое ингибирование – ингибитор непрочно связывается с ферментом (нековалентные связи) и после отделения ингибитора активность фермента восстанавливается.
Конкурентное – ингибитор похож на субстрат.
Н 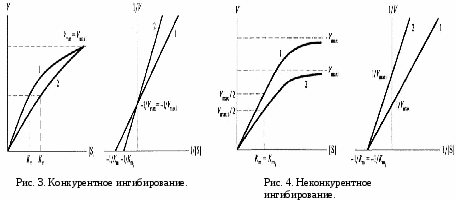 еконкурентное – ингибитор не похож на субстрат. еконкурентное – ингибитор не похож на субстрат.
Необратимое ингибирование – ингибитор связан с ферментом прочными ковалентными связями и необратимо выводит фермент из реакции.
Спецефическое – ингибитор связан со спецефической группой в активном центре (например, с SН-группой серина связываются многие токсические вещества – делициды, зорин и т. п.). Неспецифическое – ингибитор связан с ферментом вне АЦ (тяжелые металлы). Например, аспирин необратимо ингибирует фермент циклооксигеназу, которая образует медиаторы воспаления – простагландины. Следовательно, аспирин является противовоспалительным жаропонижающим средством. У 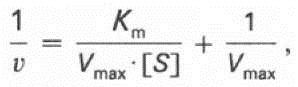 равнение Лайнуивера—Бэрка равнение Лайнуивера—БэркаЭ 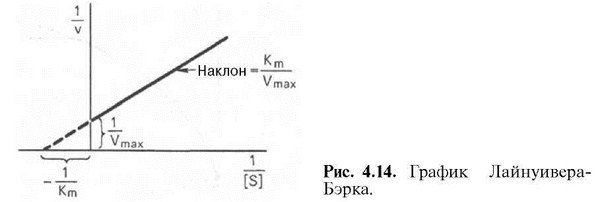 то уравнение прямой линии: у = ах + b. Если теперь в соответствии с этим уравнением построить график в координатах 1/v (y) от l/[£] (x), то получим прямую линию, тангенс угла наклона который будет равен величине Km/Vmax; отрезок, отсекаемый прямой от оси ординат, представляет собой l/Vmax (обратная величина максимальной скорости). Если продолжить прямую линию за ось ординат, тогда на абсциссе отсекается отрезок, соответствующий обратной величине константы Михаэлиса — 1/Кт. Таким образом, величину Km можно вычислить из данных наклона прямой и длины отрезка, отсекаемого от оси ординат, или из длины отрезка, отсекаемого от оси абсцисс в области отрицательных значений. то уравнение прямой линии: у = ах + b. Если теперь в соответствии с этим уравнением построить график в координатах 1/v (y) от l/[£] (x), то получим прямую линию, тангенс угла наклона который будет равен величине Km/Vmax; отрезок, отсекаемый прямой от оси ординат, представляет собой l/Vmax (обратная величина максимальной скорости). Если продолжить прямую линию за ось ординат, тогда на абсциссе отсекается отрезок, соответствующий обратной величине константы Михаэлиса — 1/Кт. Таким образом, величину Km можно вычислить из данных наклона прямой и длины отрезка, отсекаемого от оси ординат, или из длины отрезка, отсекаемого от оси абсцисс в области отрицательных значений.Следует подчеркнуть, что значения Vmax, как и величину Km, более точно, чем по графику, построенному в прямых координатах, можно определить по графику, построенному по методу двойных обратных величин. Поэтому данный метод нашел широкое применение в современной энзимологии. Предложены также аналогичные графические способы определения Km и Vmax в координатах зависимости v от v/[S] и [S]/v от [S]. Вопрос №28 Применение ферментов в медицине. Диагностическое значение определения активности ферментов. Аминотрансферазы, изоферменты лактатдегидрогеназы и креатинкиназы в диагностике патологии сердца. Ферментные препараты широко используют в медицине. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. В этом разделе мы остановимся на основных принципах энзимо-диагностики и энзимотерапии. Кроме того, ферменты используют в качестве специфических реактивов для определения ряда веществ. Так, глюкозооксидазу применяют для количественного определения глюкозы в моче и крови. Фермент уреазу используют для определения содержания количества мочевины в крови и моче. С помощью различных дегидрогеназ обнаруживают соответствующие субстраты, например пируват, лак-тат. Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей. Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифичес-ких изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани. Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет. Энзимодиагностика при инфаркте миокарда Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания. Поэтому необходимо проводить дополнительные методы исследования для подтверждения повреждения сердечной мышцы. 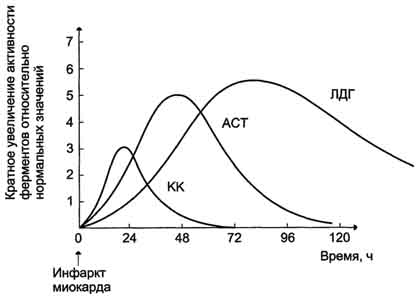 При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы - ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Типичную кривую изменения активности этих ферментов можно видеть на рис.. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови - основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен. При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы - ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Типичную кривую изменения активности этих ферментов можно видеть на рис.. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови - основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен. Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов ACT и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4-6 ч; максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы. |

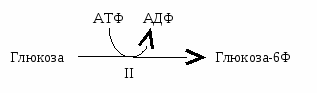 ак донор фосфора – трансферазы
ак донор фосфора – трансферазы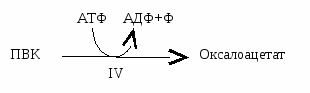 ак донор энергии – лигазы
ак донор энергии – лигазы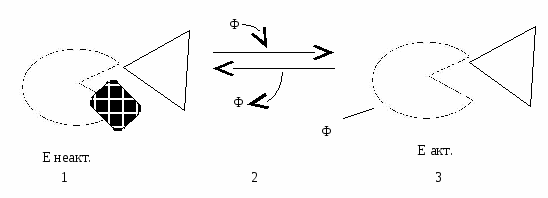
 онкурентное
онкурентное