Ответы к экзамену По биохимии 1 структура и функции белков 3 ферменты 10 нуклеиновые кислоты и нуклеотиды 21
 Скачать 29.52 Mb. Скачать 29.52 Mb.
|
ОБМЕН БЕЛКОВВопрос № 67 Белковое питание. Незаменимые аминокислоты, пищевая ценность белков. Источники и пути использования аминокислот в организме. Азотистый баланс. Белки – это высокомолекулярные соединения, состоящие из α-аминокислотных остатков, которые соединены между собой пептидными связями. Пептидные связи расположены между α-карбоксильной группой одной аминокислоты и аминогруппой другой, следующей за ней, α-аминокислоты. Функции белков (аминокислот):
 Белковое питание Снижают до минимума употребление продуктов, содержащих жиры и углеводы, а питаются только белковыми продуктами. Больше всего белка содержится в яйцах, мясе (говядина, свинина, баранина, кролик), птице (курица, индейка, утка, гусь, куропатки), нежирных сортах творога и сыра, соевом молоке, рыбе и морепродуктах. В грибах тоже содержится много белков, однако они плохо усваиваются организмом. Белковая диета также предусматривает употребление фруктов и овощей, хотя их количество должно быть сведено к минимуму. Методика белкового питания заключается в том, что организм начинает восполнять утраченную глюкозу, расщепляя углеводы, которые находятся в виде гликогена, и только после этого расходуется жировая клетчатка, которая идет на восстановление растраченного гликогена. Все это и приводит к снижению веса во время питания белковой пищей. Плюсы: быстрый процесс похудения. Во время употребления белковых продуктов вы не будете страдать от изнурительного чувства голода, которое сопровождает многие строгие диеты. Но самое главное вы будете употреблять любые мясные продукты. Хотя мясо тоже важно правильно приготовить. Мясо, рыбу и птицу лучше варить, тушить или готовить на пару. Кроме того, на белковом питании можно продержаться долго и радоваться достигнутым результатам в похудении. Стоит отметить, что белки практически не участвуют в образовании жировой клетчатки, так что общая доля жира в вашем организме во время белковой диеты будет только уменьшаться. Минусы: Во-первых, такое питание не является сбалансированным, а значит, в ваш организм не будут поступать все необходимые полезные вещества и микроэлементы. Со временем вы станете замечать, что волосы станут блеклыми, ногти ломкими, появится бледность лица и патологическая усталость. Во-вторых, чрезмерное употребление белковых продуктов дает сильную нагрузку на почки. Сей факт и объясняет потерю жидкости в период белкового питания. Может развиться протеинурия, когда вместе с мочой выводится и белок. Поэтому если вы страдаете какими-либо заболеваниями почек, то следует воздержаться от такой диеты. Т.к. белки пищи – основной источник аминокислот, то говорят о «полноценности белкового питания». Все аминокислоты делятся на:
В связи с этим выделяются белки:
Питательная ценность белка зависит от его аминокислотного состава и способности усваиваться организмом. Белки значительно различаются по аминокислотному составу. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка условно принимается за 100, и он считается полноценным. К таким относят белки яиц и молока. Белки мяса говядины имеют биологическую ценность 98. Растительные белки по биологической ценности уступают животным, так как труднее перевариваются и бедны лизином, метионином и триптофаном. Азотистый баланс Т.к. 95% всего азота организма принадлежит аминокислотам, то о их обмене можно судить по азотистому балансу – соотношение поступающего азота и выделенного с мочой.
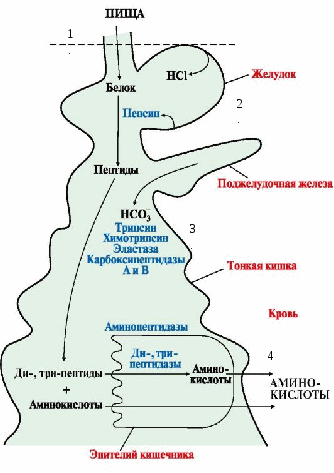
Вопрос №68 Основные этапы переваривания белков в ЖКТ. Значение секреции протеаз в виде проферментов. Механизм их активации Особенности:
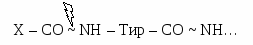 Пепсин вырабатывается главными клетками в виде неактивного пепсиногена. Обкладочные клетки вырабатывают соляную кислоту. Функции HCl:
Активация пепсиногена: 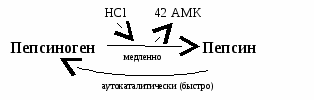 Пепсиноген под действием HCl превращается в активный пепсин путем отщепления 42 аминокислот медленно. Затем активный пепсин быстро активирует пепсиноген (аутокаталитически). Пепсиноген под действием HCl превращается в активный пепсин путем отщепления 42 аминокислот медленно. Затем активный пепсин быстро активирует пепсиноген (аутокаталитически).Таким образом, в желудке белки расщепляются на короткие пептиды, которые поступают в кишечник.
Активация трипсиногена, химотрипсиногена, проэластазы, прокарбоксипептидазы В кишечнике под действием энтеропептидазы активируется трипсиноген. Затем активированный из него трипсин активирует все остальные ферменты путем частичного протеолиза (химотрипсиноген → химотрипсин, проэластаза → эластаза, прокарбоксипептидаза → карбоксипептидаза). 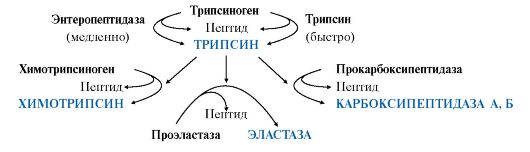 Трипсин расщепляет связи, образованные карбоксильными группами Лиз или Арг. 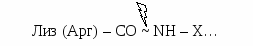 Х 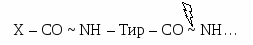 имотрипсин – между карбоксильными группами ароматических аминокислот. имотрипсин – между карбоксильными группами ароматических аминокислот.Эластаза - связи, образованные карбоксильными группами Ала или Гли. Карбоксипептидаза расщепляет карбоксильные связи с С-конца. Таким образом, в кишечнике образуются короткие ди-, трипептиды.
Ферменты – ди-, три-, аминопептидазы. Они не обладают видовой специфичностью. Образовавшиеся свободные аминокислоты всасываются вторично активным транспортом с Na+ (против градиента концентрации). ЗАЩИТА КЛЕТОК ОТ ДЕЙСТВИЯ ПРОТЕАЗ Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что: • эти ферменты образуются в виде неактивных предшественников в клетках поджелудочной железы и активируются только после секреции в просвет кишечника. Таким образом, место синтеза и место действия этих ферментов пространственно разделены. • в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с активной формой фермента (в случае преждевременной активации) прочный комплекс. В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия. Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Однако начальные механизмы возникновения язвы ещё мало изучены. Вопрос №71 Гниение белков в толстом кишечнике. Обезвреживание в печени токсичных продуктов гниения тирозина и триптофана путем конъюгации с глюкуроновой и серной кислотами. Гниение – ферментативный процесс расщепления аминокислот до малотоксичных продуктов с выделением газов (NH3, СН4, СО2, меркаптан). Значение: для поддержания жизнедеятельности микрофлоры кишечника (при гниении Тир образует токсичные продукты фенол и крезол, Тпф – индол и скотол). Токсичные продукты поступают в печень и обезвреживаются. Усилению процессов гниения аминокислот могут способствовать:
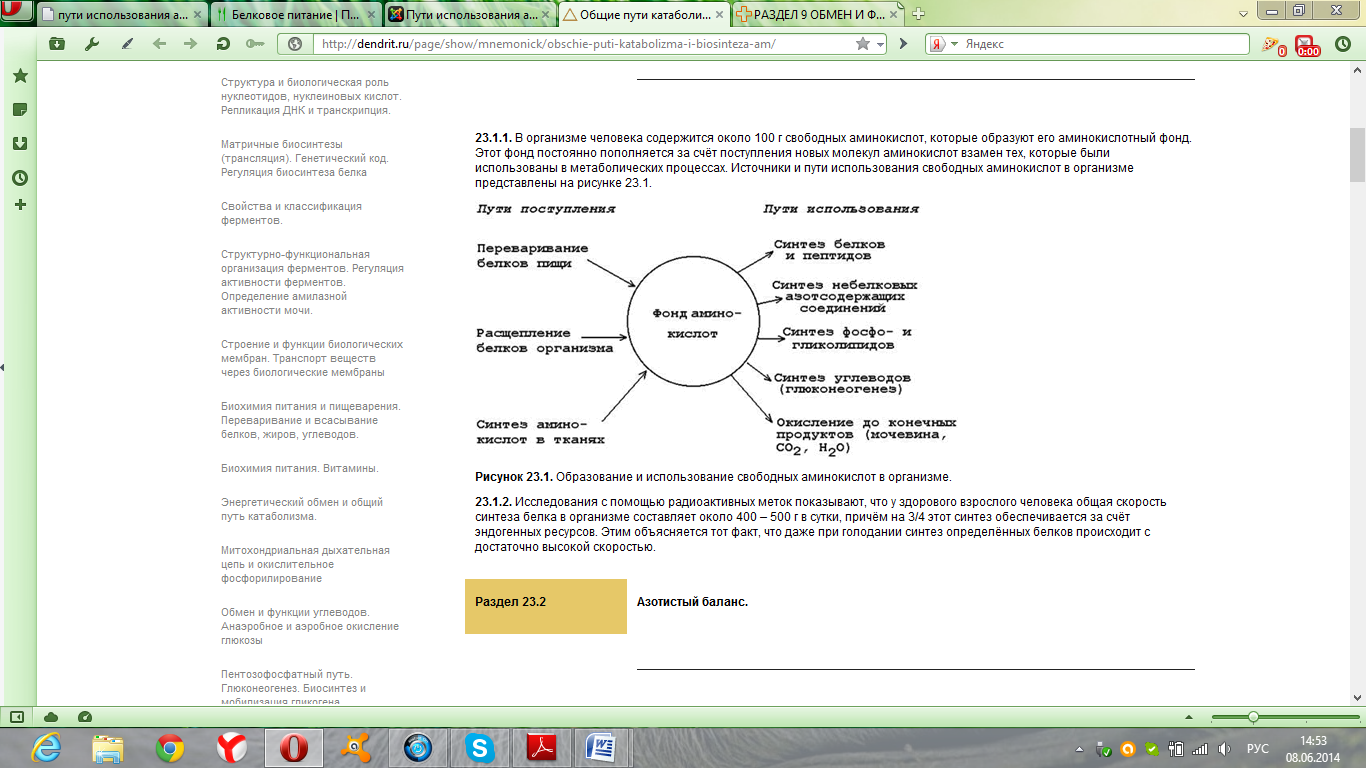
Продукты гниения аминокислот являются ксенобиотиками – веществами, чужеродными для организма человека и должны быть обезврежены (инактивированы). Обезвреживание продуктов гниения аминокислот происходит в клетках печени после поступления веществ из кишечника с кровью воротной вены. Продукты обезвреживания хорошо растворяются в воде и поэтому легко выводятся из организма. Процесс обезвреживания включает, как правило, две фазы (стадии): фазу модификации и фазу конъюгации. В фазе модификации вещества вступают в реакции микросомального окисления, в результате которого образуются полярные группы —ОН или —СООН. Если такие группы уже имеются, то обезвреживание может происходить непосредственно путём конъюгации. Реакции конъюгации заключаются в том, что к указанным группам присоединяется определённое соединение (глюкуроновая кислота, серная кислота, глицин и некоторые другие). Активной формой глюкуроновой кислоты является уридиндифосфоглюкуроновая кислота (УДФГК), активной формой серной кислоты - 3'-фосфоаденозин-5'-фосфосульфат (ФАФС). С  катол и индол обезвреживаются в печени в два этапа. Сначала в результате микросомального окисления они приобретают гидроксильную группу. Так, индол переходит в индоксил, а затем вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индикана катол и индол обезвреживаются в печени в два этапа. Сначала в результате микросомального окисления они приобретают гидроксильную группу. Так, индол переходит в индоксил, а затем вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индиканаУ 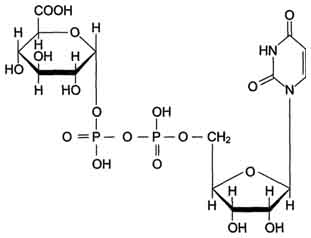 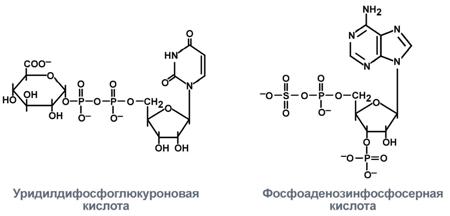 ДФ-глюкуронат ДФ-глюкуронатФ 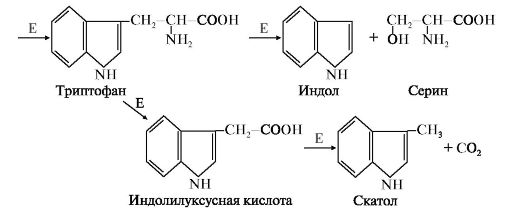 АФС АФСК 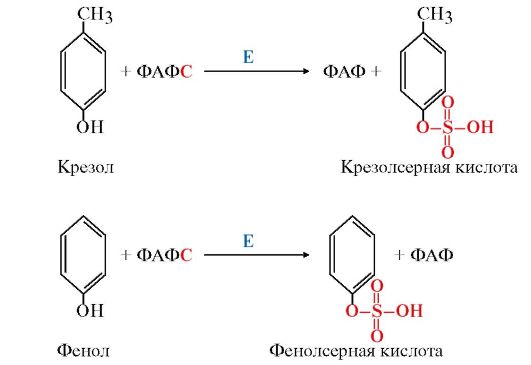 онъюгация фенола и крезола с ФАФС: онъюгация фенола и крезола с ФАФС: Е - сульфотрансфераза Конъюгация фенола и крезола с глюкуроновой кислотой происходит при участии фермента УДФ-глюкуронилтрансферазы. Продукты конъюгации - фенолглюкуронат и крезолглюкуронат хорошо растворимы в воде и выводятся с мочой. Повышение количества конъюгатов глюкуроновой кислоты с фенолом и крезолом в моче обнаруживается при усилении гниения белков в кишечнике. Вопрос №72 Общие пути обмена аминокислот. Дезаминирование, трансаминирование и его значение. Использование определения активности трансаминаз в клинической практике. Т 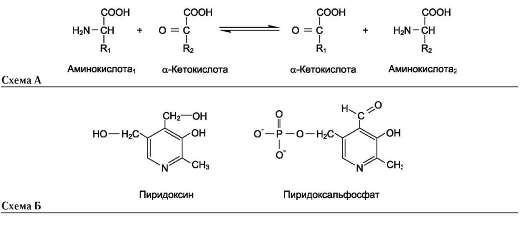 рансаминирование – ферментативный перенос аминогруппы с аминокислоты на α-кетокислоту (почти всегда α-кетоглутарат). рансаминирование – ферментативный перенос аминогруппы с аминокислоты на α-кетокислоту (почти всегда α-кетоглутарат).В результате образуется Глу, которая идет на процесс дезаминирования, и какая-то другая кетокислота. Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариотов. Причём митохондриальные и цитоплазматичес-кие формы ферментов различаются по физико-химическим свойствам. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина. Ферменты – аланинаминотрансфераза (АЛТ), аспартатаминотрасфераза (АСТ). Кофермент – пиридоксальфосфат ← вит. В6. Д 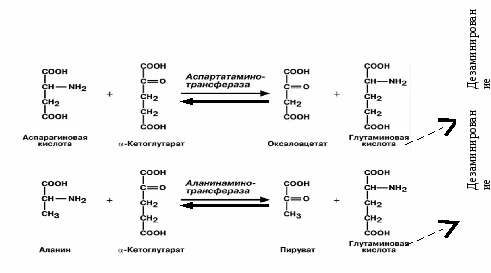 ля определения активности АЛТ и АСТ в клинике для диагностики заболеваний сердца и печени измеряют коэффициент де Ритиса: ля определения активности АЛТ и АСТ в клинике для диагностики заболеваний сердца и печени измеряют коэффициент де Ритиса:При 0,6 – гепатит, 1 – цирроз, 10 – инфаркт миокарда. Функции трансаминирования:
Основной путь – дезаминирование – ферментативный процесс отщепления аминогруппы в виде аммиака и образования безазотистой кетокислоты.
Окислительное дезаминирование (основное) А) Прямое – только для Глу, т.к. для всех остальных ферменты неактивны. Протекает в 2 стадии:
В итоге образуется аммиак и α-кетоглутарат. 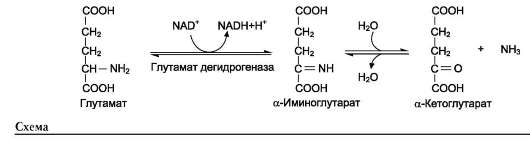 Б) Непрямое – для всех остальных аминокислот (16). Цель – получить Глу. Протекает через трансаминирование. Вопрос №73 Декарбоксилирование аминокислот. Биогенные амины, роль в организме, нарушение синтеза и их обезвреживание. Декарбоксилирование аминокислот – ферментативный процесс отщепления карбоксильной группы в виде СО2 от аминокислот. В результате образуются биологически активные вещества – биогенные амины. Ферменты – декарбоксилазы. Кофермент – пиридоксальфосфат ← вит. В6.
После оказания действия биогенные амины обезвреживаются 2 путями:
 Вопрос №74 Источники образования и механизмы обезвреживания аммиака в организме В результате дезаминирования аминокислот освобождается большое количество аммиака. Значительно меньше его образуются при дезаминировании биогенных аминов и нуклеотидов. Ч 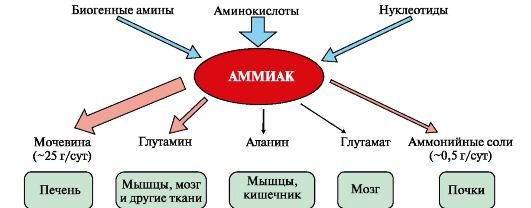 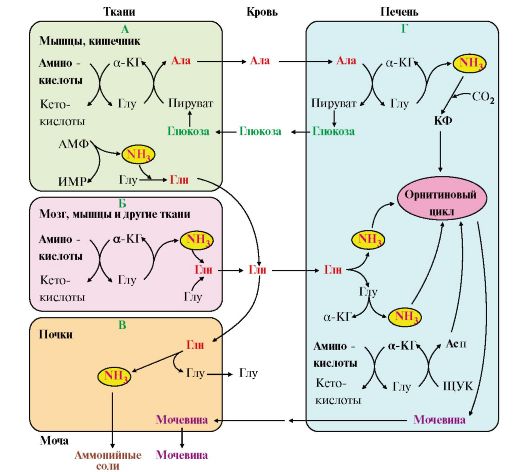 асть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Катаболизм аминокислот и образование аммиака происходит во всех тканях организма. Однако концентрация аммиака в крови очень мала, так как он быстро связывается в клетках с образованием нетоксичных продуктов. Содержание аммиака в крови в норме составляет всего 0,4-0,7 мг/л (25-40 мкмоль/л). В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония - NH4+, количество неионизированного NH3 невелико ( 1%). асть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Катаболизм аминокислот и образование аммиака происходит во всех тканях организма. Однако концентрация аммиака в крови очень мала, так как он быстро связывается в клетках с образованием нетоксичных продуктов. Содержание аммиака в крови в норме составляет всего 0,4-0,7 мг/л (25-40 мкмоль/л). В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония - NH4+, количество неионизированного NH3 невелико ( 1%).Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Так, повышение концентрации аммиака в мозге до 0,6 ммоль вызывает судороги. К симптомам гипераммониемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжёлых случаях развивается кома с летальным исходом. СВЯЗЫВАНИЕ (ОБЕЗВРЕЖИВАНИЕ) АММИАКА. О 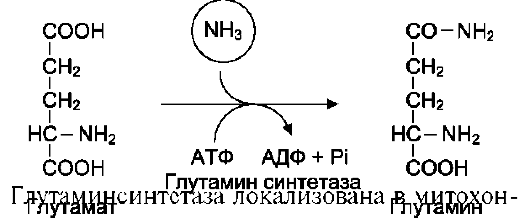 сновной реакцией обезвреживания аммиака почти во всех тканях является синтез глутамина под действием глутаминсинтетазы: сновной реакцией обезвреживания аммиака почти во всех тканях является синтез глутамина под действием глутаминсинтетазы:Глутаминсинтетаза обладает высоким сродством к аммиаку и благодаря этой реакции в крови и тканях поддерживается низкая концентрация NH3. Глутамин можно считать транспортной формой аммиака, он является нейтральной аминокислотой и способен легко проникать через клеточные мембраны путем облегченной диффузии (в отличие от глутамата, требующего механизмов активного транспорта). Глутамин поступает в кровь в наибольшем количестве - из мышц и мозга. Из тканей глутамин транспортируется в почки и кишечник. В клетках кишечника под действием фермента глутаминазы происходит отщепление амидной группы в виде NH3 а образовавшийся глутамат с помощью АЛТ превращается в аланин. Таким образом, в энтероцитах амидная группа глутамина превращается в аммиак, а аминогруппа глутамина - включается в состав аланина. Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные 90% выводятся почками. В почках глутамин также подвергается действию фермента глутаминазы и расщепляется на глутамат, который реабсорбируется и возвращается в клетки тканей, и аммиак . Глутаминаза почек активируется при ацидозе; образовавшийся аммиак используется для нейтрализации кислых продуктов и образования аммонийных солей [в основном, NH4Cl, (NH4)2SO4], которые экскретируются с мочой. Экскреция солей аммония в норме составляет -0,5 г/сут, при ацидозе выведение аммонийных солей может увеличиться до 10 г/сут. Этот путь выведения аммиака: • 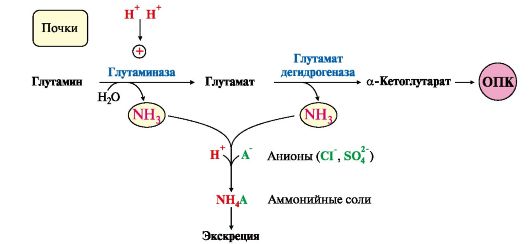 поддерживает кислотно-щелочной баланс в норме; поддерживает кислотно-щелочной баланс в норме;• защищает организм от потери с мочой ионов Na+ и К+, которые также могут использоваться для выведения избытка анионов. 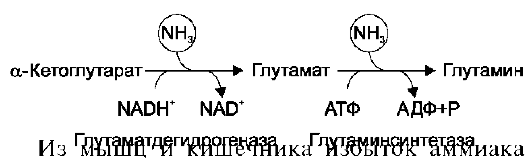 В мозге и некоторых других органах для обезвреживания аммиака используется реакция восстановительного аминирования α-кетоглутарата под действием глутаматдегидрогеназы, которая катализирует реакцию, обратную окислительному дезаминированию глутамата. Однако этот путь в тканях используется слабо. Хотя, если учитывать возможность последующего образования глутамина, он является выгодным для клеток, так как способствует обезвреживанию сразу двух молекул NH3. В мозге и некоторых других органах для обезвреживания аммиака используется реакция восстановительного аминирования α-кетоглутарата под действием глутаматдегидрогеназы, которая катализирует реакцию, обратную окислительному дезаминированию глутамата. Однако этот путь в тканях используется слабо. Хотя, если учитывать возможность последующего образования глутамина, он является выгодным для клеток, так как способствует обезвреживанию сразу двух молекул NH3.И  з мышц, клеток кишечника и некоторых других тканей избыток азота выводится в кровь в виде аланина. Образование аланина в этих органах можно представить следующей схемой: з мышц, клеток кишечника и некоторых других тканей избыток азота выводится в кровь в виде аланина. Образование аланина в этих органах можно представить следующей схемой:А 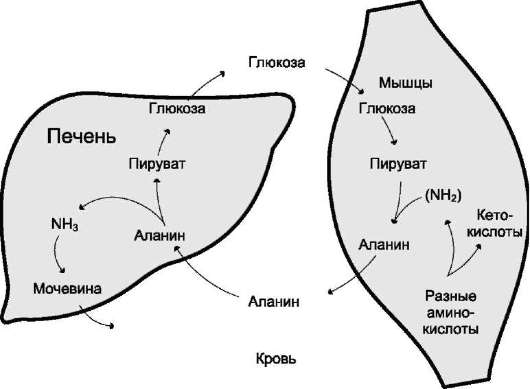 миногруппы разных аминокислот в ходе реакций трансаминирования переносятся на пируват, источником которого служат глюкоза и безазотистые остатки аминокислот. Особенно много аланина выделяют мышцы в силу их большой массы, а также потому, что работающие мышцы часть энергии получают за счет распада аминокислот. Аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается в процессе синтеза мочевины, а пируват включается в глюконеогенез или ОПК. Глюкоза из печени поступает в ткани и в процессе гликолиза окисляется до пирувата. Образование аланина в мышцах, его перенос в печень и перенос глюкозы в обратном направлении составляют глюкозоаланиновый цикл. миногруппы разных аминокислот в ходе реакций трансаминирования переносятся на пируват, источником которого служат глюкоза и безазотистые остатки аминокислот. Особенно много аланина выделяют мышцы в силу их большой массы, а также потому, что работающие мышцы часть энергии получают за счет распада аминокислот. Аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается в процессе синтеза мочевины, а пируват включается в глюконеогенез или ОПК. Глюкоза из печени поступает в ткани и в процессе гликолиза окисляется до пирувата. Образование аланина в мышцах, его перенос в печень и перенос глюкозы в обратном направлении составляют глюкозоаланиновый цикл.В печени аммиак обезвреживается путем связывания с СО2 и образования карбамоилфосфата. Реакцию катализирует карбамоилфосфатсинтетаза I, которая использует 2 моль АТФ. Фермент локализован в митохондриях гепатоцитов. Продукт реакции - карбамоилфосфат - включается затем в орнитиновый цикл Кребса-Гензелейта для синтеза мочевины. Вопрос №75 Орнитиновый цикл синтеза мочевины, его роль и связь с другими метаболическими путями. Мочевина - конечный продукт азотистого обмена, в составе которого из организма выводится избыток аммиака. Экскреция мочевины в норме составляет -25 г/сут. Синтез мочевины происходит только в печени (Орнитиновый цикл Кребса-Гензелейта). 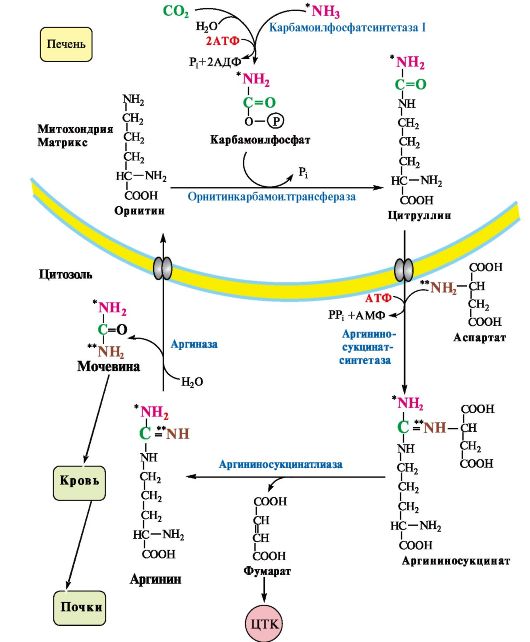 Содержание мочевины в сыворотке крови в норме составляет 2,5-8,4 мМ/л (15-50 мг/дл). Катаболизм аминокислот и образование аммиака происходит во многих тканях. Азот из тканей транспортируется в печень в составе трех соединений: глутамина, аланина и аммиака. Полный набор ферментов цикла синтеза мочевины есть только в гепатоцитах. Первые две реакции протекают в митохондриях, а последующие три - в цитозоле. Молекула мочевины содержит два атома азота: • первая аминогруппа включается в цикл в виде аммиака, образующегося в митохондриях гепатоцитов при дезаминировании аминокислот или поступающего из крови. Реакцию катализирует митохондриальная карбамоилфосфатсинтетаза I (цитоплазматическая карбамоилфосфатсинтетаза II участвует в синтезе пиримидиновых нуклеотидов); • вторая аминогруппа вводится в молекулу мочевины из аспартата. 2. Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень, главным образом, из кишечника с кровью воротной вены. Роль других источников, в том числе окислительного дезаминирования глутамата и гидролиза глутамина в печени, существенно меньше. Ферменты орнитинового цикла локализованы в митохондриях и цитозоле гепатоцитов. В цикле происходит трансмембранный перенос цитруллина и орнитина. На схеме показаны пути включения двух атомов азота из разных аминокислот в молекулу мочевины: - азот одной аминогруппы - в виде аммиака в матриксе митохондрии (*N); - азот второй аминогруппы поставляется в составе аспартата в цитозоле (**N) Аспартат, необходимый для синтеза аргининосукцината, образуется в печени: • преимущественно с использованием аминогруппы аланина, который поступает из мышц и клеток кишечника; • 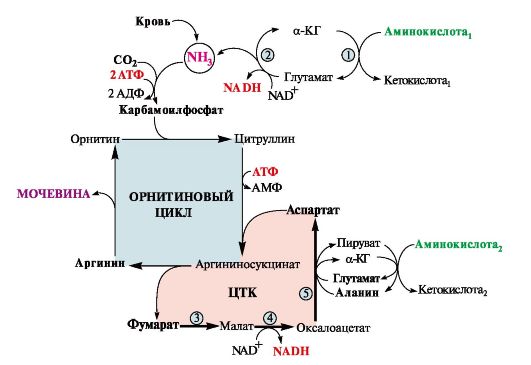 путем трансаминирования глутамата с оксалоацетатом. Образующийся в орнитиновом цикле фумарат включается в реакции путем трансаминирования глутамата с оксалоацетатом. Образующийся в орнитиновом цикле фумарат включается в реакциицитратного цикла и превращается в оксалоацетат, который путем трансаминирования снова образует аспартата. Таким образом, с орнитиновым циклом сопряжен цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле, используется в ОПК или для глюконеогенеза. Ферменты, катализирующие реакции: 1 - аминотрансфераза; 2 - глутаматдегидрогеназа; 3 - фумараза; 4 - малатдегидрогеназа; 5 - аминотрансфераза В орнитиновом цикле расходуется энергия четырех макроэргических связей трех молекул АТФ на синтез одной молекулы мочевины. Затраты энергии происходят также при трансмембранном переносе компонентов цикла (цитруллина, орнитина, мочевины). В почках перенос мочевины из крови в мочу происходит за счет градиента ионов натрия, создаваемого К, Na-АТФазой, которая потребляет АТФ. Процесс синтеза мочевины имеет возможность компенсации энергозатрат: • при регенерации аспартата из фумарата на стадии дегидрирования малата образуется NADH, который может обеспечить синтез трех молекул АТФ; • при окислительном дезаминировании глутамата в разных органах также образуется NADH, соответственно - еще три молекулы АТФ. Орнитиновый цикл в печени выполняет две функции: • превращение азота аминокислот в мочевину, которая экскретируется и помогает избежать накопления аммиака в организме; • синтез аргинина и пополнение его фонда в организме. Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Такой запас мощности необходим для предотвращения гипераммониемии при изменениях количества белка в пище. Р 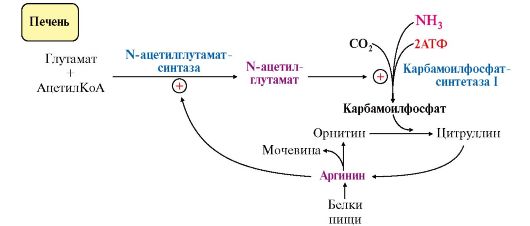 егуляторными реакциями являются синтез карбамоилфосфата, цитруллина и заключительная реакция, катализируемая аргиназой. Основным регуляторным фактором является содержание субстратов, прежде всего аммиака. Высокий уровень NH3 вызывает повышение уровня образования мочевины. Кроме того, скорость орнитинового цикла регулируется с помощью двух механизмов: егуляторными реакциями являются синтез карбамоилфосфата, цитруллина и заключительная реакция, катализируемая аргиназой. Основным регуляторным фактором является содержание субстратов, прежде всего аммиака. Высокий уровень NH3 вызывает повышение уровня образования мочевины. Кроме того, скорость орнитинового цикла регулируется с помощью двух механизмов:• аллостерическая активация карбамоилфосфатсинтетазы I N-ацетил- глутаматом (N-АГ); • индукция синтеза ферментов карбамоилфосфатсинтетазы I, орнитинкарбамоилтрансферазы и аргиназы кортизолом. N-ацетилглутамат является активатором карбамоилфосфатсинтетазы I. Образуется в матриксе митохондрий гепатоцитов из глутамата и ацетил-КоА специфической синтазой, которая активируется при повышении содержания аргинина в печени. Индукция синтеза ферментов орнитинового цикла происходит в ответ на повышение скорости распада белков при голодании, длительной физической работе и при высокобелковой диете. В этих случаях углерод аминокислот превращается в глюкозу, а азот включается в молекулу мочевины. Индукция происходит параллельно с индукцией ферментов глюконеогенеза, АЛТ и глутамат-ДГ. Заболевания, характеризующиеся интенсивным распадом белков тканей сопровождаются активацией орнитинового цикла. Вопрос №77 Специфический обмен аминокислот: глицина, серина. Роль Н4-фолата и его производных в обмене аминокислот и нуклеотидов. Серин - заменимая аминокислота, синтезируется из промежуточного продукта гликолиза - 3-фосфоглицерата, а аминогруппу получает от глутаминовой кислоты. Г 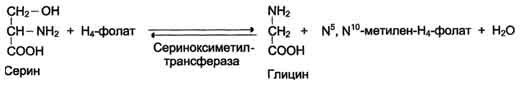 лицин - также заменимая аминокислота, основным источником которой служит серии. Реакцию синтеза глицина из серина катализирует фермент серин-оксиметилтрансфераза, кофермен-том которой является Н4-фолат. лицин - также заменимая аминокислота, основным источником которой служит серии. Реакцию синтеза глицина из серина катализирует фермент серин-оксиметилтрансфераза, кофермен-том которой является Н4-фолат.Р 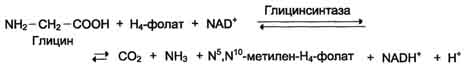 еакция превращения серина в глицин легко обратима. Основной путь катаболизма глицина у человека и других позвоночных также связан с использованием Н4-фолата. еакция превращения серина в глицин легко обратима. Основной путь катаболизма глицина у человека и других позвоночных также связан с использованием Н4-фолата. Эта реакция обратима и катализируется глицинсинтазой - ферментным комплексом, похожим на пируватдегидрогеназный комплекс, и локализованным в митохондриях клеток печени. По последним данным глицинрасщепляющая ферментная система несколько отличается от глицинсинтазы и содержит 4 белка: Р-белок, включающий кофермент ПФ, Н-белок, содержащий липоевую кислоту, Т-белок с коферментом Н4-фолат, L-белок, являющийся дигидролипоилдегидрогеназой с коферментом NAD+. 1. Пути метаболизма серина и глицина. О 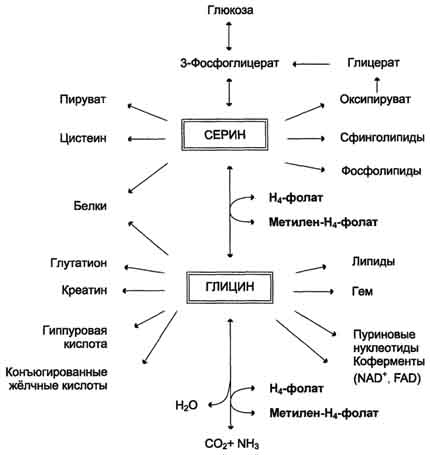 бе аминокислоты необходимы не только для синтеза белков и глюкозы (при её недостатке в клетках), но и нукле-отидов, коферментов, тема, сложных липидов, креатина и других соединений. Многие из этих реакций представлены в соответствующих разделах учебника. бе аминокислоты необходимы не только для синтеза белков и глюкозы (при её недостатке в клетках), но и нукле-отидов, коферментов, тема, сложных липидов, креатина и других соединений. Многие из этих реакций представлены в соответствующих разделах учебника.Роль фолиевой кислоты в обмене В превращениях серина и глицина главную роль играют ферменты, коферментами которых служат производные фолиевой кислоты. Этот витамин широко распространён в животных и растительных пищевых продуктах. Молекула фолиевой кислоты (фолата) состоит из 3 частей: птеринового производного, парааминобензойной и глутаминовой кислот. Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (ТГФК или Н4-фолат). Ф 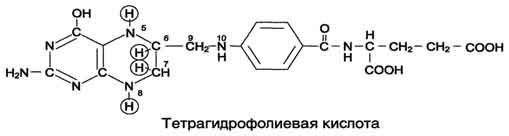 олиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH. олиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH. Н4-фолат - акцептор β-углеродного атома серина. При этом образуется метиленовый мостик между атомами азота в молекуле Н4-фолата в положениях 5 и 10, образуя метилен-Н4-фолат Дефицита фолиевой - мегалобластная анемия-уменьшением количества эритроцитов, снижением гемоглобина, увеличение размера эритроцитов. Причина - нарушение синтеза ДНК и РНК из-за недостатка предшественников - тимидиловой кислоты и пуриновых нуклеотидов вследствие дефицита производных Н4-фолата. Вопрос №78 Основные пути превращения метионина в организме; значение реакций трансметилирования. Синтез креатина. М 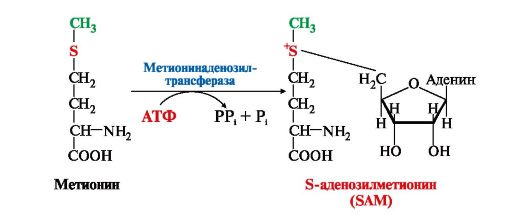 етионин - незаменимая аминокислота, необходимая для синтеза белков. Мет-тРНКмет участвует в инициации процесса трансляции каждого белка. Как и многие другие аминокислоты, метионин подвергается транс- и дезаминированию. Особая роль метионина заключается в том, что метильная группа этой аминокислоты используется для синтеза целого ряда соединений в реакциях трансметилирования. Основным донором метильной группы является S-аденозилметионин (SAM) - активная форма метионина, который присутствует во всех типах клеток и синтезируется из метионина и АТФ под действием фермента метионин-аденозилтрансферазы. етионин - незаменимая аминокислота, необходимая для синтеза белков. Мет-тРНКмет участвует в инициации процесса трансляции каждого белка. Как и многие другие аминокислоты, метионин подвергается транс- и дезаминированию. Особая роль метионина заключается в том, что метильная группа этой аминокислоты используется для синтеза целого ряда соединений в реакциях трансметилирования. Основным донором метильной группы является S-аденозилметионин (SAM) - активная форма метионина, который присутствует во всех типах клеток и синтезируется из метионина и АТФ под действием фермента метионин-аденозилтрансферазы.Структура -S+-CH3 в SAM является нестабильной, метильная группа легко отщепляется, что определяет высокую способность ее к переносу на другие соединения в реакциях трансметилирования. В 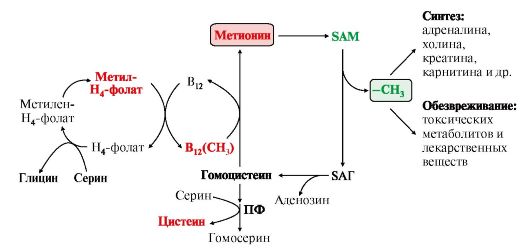 реакциях трансметилирования SAM превращается в S-аденозилгомо- цистеин (SAr), который гидролитически расщепляется с образованием аденозина и гомоцистеина. Последний может снова превращаться в метионин с участием метил-Н4-фолата и витамина В12. Регенерация метионина тесно связана с обменом серина и глицина и взаимопревращениями производных Н4-фолата. реакциях трансметилирования SAM превращается в S-аденозилгомо- цистеин (SAr), который гидролитически расщепляется с образованием аденозина и гомоцистеина. Последний может снова превращаться в метионин с участием метил-Н4-фолата и витамина В12. Регенерация метионина тесно связана с обменом серина и глицина и взаимопревращениями производных Н4-фолата.Метионин и серин необходимы для синтеза условно заменимой аминокислоты цистеина, причем в этом процессе метионин является донором атома серы. Цистеин образуется непосредственно из гомоцистеина в ходе двух реакций, которые происходят с участием пиридоксальфосфата. Генетический дефект этих ферментов приводит к нарушению использования гомоцистеина в организме и превращению его в гомоцистин, который может накапливаться в крови и тканях, выделяться с мочой, вызывая гомоцистинурию. Заболевание сопровождается эктопией хрусталика глаза, катарактой, остеопорозом, умственной отсталостью. С 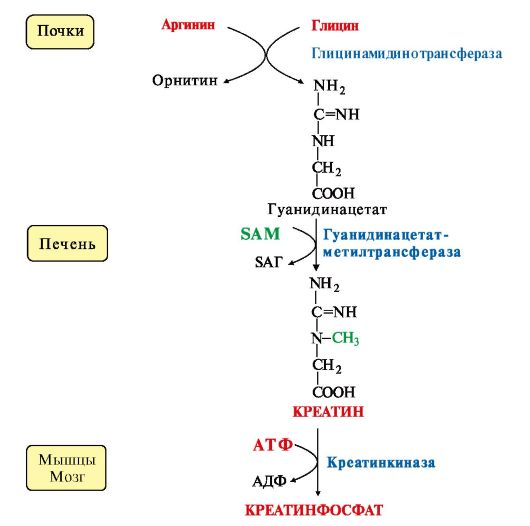 интез креатина происходит с использованием трех аминокислот: аргинина, глицина и метионина. Процесс начинается в почках, в реакцию вступают аргинин и глицин. Образующийся гуанидинацетат поступает в печень, где подвергается метилированию с участием SAM и превращается в креатин. Из печени креатин транспортируется в мышцы и головной мозг. Креатин в клетках превращается в креатинфосфат - макроэргическое соединение, являющееся резервной формой энергии в мышечной и нервной тканях. Содержание креатинфосфата в покоящейся мышце в восемь раз выше, чем АТФ. Эту реакцию катализирует фермент креатинкиназа. интез креатина происходит с использованием трех аминокислот: аргинина, глицина и метионина. Процесс начинается в почках, в реакцию вступают аргинин и глицин. Образующийся гуанидинацетат поступает в печень, где подвергается метилированию с участием SAM и превращается в креатин. Из печени креатин транспортируется в мышцы и головной мозг. Креатин в клетках превращается в креатинфосфат - макроэргическое соединение, являющееся резервной формой энергии в мышечной и нервной тканях. Содержание креатинфосфата в покоящейся мышце в восемь раз выше, чем АТФ. Эту реакцию катализирует фермент креатинкиназа. Креатинфосфат играет важную роль в обеспечении работающей мышцы энергией в начальный период физической работы. В работающей мышце концентрация АТФ некоторое время остается постоянной, а концентрация креатинфосфата быстро снижается. Часть образовавшегося креатина и креатинфосфата с постоянной скоростью превращается в креатинин, который выводится с мочой (норма - 1-2 г/сут, или 8,8-17,6 ммоль/л). При уменьшении массы мышц вследствие длительного отрицательного азотистого баланса, при состояниях, ведущих к атрофии мышц, выделение креатинина снижается (голодание, острые инфекции, сахарный диабет, гипертиреоз). Вопрос №79 Основные пути превращения фенилаланина, тирозина и триптофана и их значение в синтезе биологически активных веществ. Нарушение обмена (алкаптонурия, альбинизм, фенилкетонурия). Ф 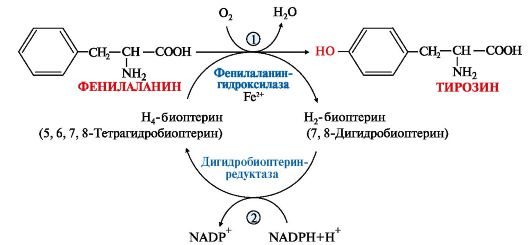 енилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется ароматическое кольцо. Основная часть поступающего с пищей фенилаланина используется в синтезе тканевых белков, превращение остальной части начинается с его гидроксилирования, в результате чего образуется тирозин. Реакция катализируется специфической монооксигеназой - фенилаланингидроксилазой, коферментом которой является тетрагидробиоптерин (Н4-БП). енилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется ароматическое кольцо. Основная часть поступающего с пищей фенилаланина используется в синтезе тканевых белков, превращение остальной части начинается с его гидроксилирования, в результате чего образуется тирозин. Реакция катализируется специфической монооксигеназой - фенилаланингидроксилазой, коферментом которой является тетрагидробиоптерин (Н4-БП).1. Реакцию катализирует фенилаланингидроксилаза (1), коферментом которой является Н4БП. Кофактором являются ионы Fe2+. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). 2. Регенерация дигидробиоптерина (2) происходит при участии дигидробиоптеринредуктазы с использованием NADPH. Тирозин - условно заменимая аминокислота. Синтезируется только из фенилаланина. К 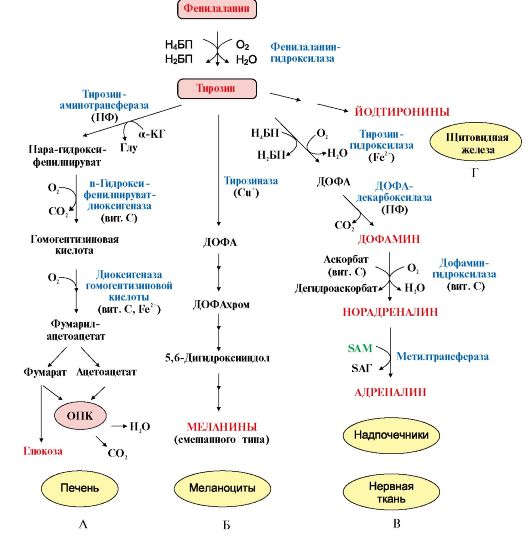 атаболизм Фен и Тир происходит в печени. В результате ряда реакций образуется фумарат и ацетоацетат. Фумарат используется для синтеза глюкозы (глюконеогенез) или окисляется до СО2 и Н2О. Ацетоацетат - кетоновое тело, окисляется в тканях с выделением энергии. Таким образом, Фен и Тир относятся к смешанным аминокислотам по использованию безазотистого остатка. атаболизм Фен и Тир происходит в печени. В результате ряда реакций образуется фумарат и ацетоацетат. Фумарат используется для синтеза глюкозы (глюконеогенез) или окисляется до СО2 и Н2О. Ацетоацетат - кетоновое тело, окисляется в тканях с выделением энергии. Таким образом, Фен и Тир относятся к смешанным аминокислотам по использованию безазотистого остатка. Превращение промежуточного продукта катаболизма Тир - гомогентизиновой кислоты - в фумарилацетоацетат сопровождается расщеплением ароматического кольца. Процессы расщепления ароматических колец в биологических системах катализируются ферментами диоксигеназами. Для катализа диоксигеназам необходимы кофакторы - Fe2+ или гем (для некоторых - Сu+), а также - витамин С. В мозговом веществе надпочечников и нервной ткани из тирозина синтезируются катехоламины (дофамин, норадреналин, адреналин). Тирозин под действием специфической монооксигеназы - тирозингидроксилазы превращается в ДОФА. Катехоламины выполняют очень важные функции в организме. Дофамин является медиатором среднего отдела мозга. Норадреналин - тормозный медиатор синаптической нервной системы и разных отделов головного мозга, но может выполнять функцию возбуждающего медиатора в гипоталамусе. Адреналин - гормон интенсивной физической работы, который синтезируется при стрессе и регулирует основной обмен, а также усиливает сокращение сердечной мышцы. В щитовидной железе тирозин используется для синтеза гормонов иодтиронинов (тироксина и трииодтиронина). В меланоцитах - пигментных клетках кожи, сетчатки глаз тирозин является предшественником пигментов меланинов. Частично заменимая аминокислота гистидин синтезируется из глутамата. О 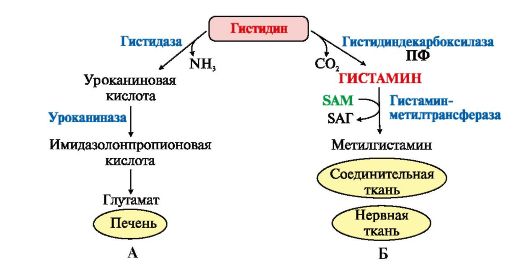 бмен гистидина включает синтез гистамина в соединительной ткани, а также путь катаболизма, который происходит в печени и, частично, в коже человека. бмен гистидина включает синтез гистамина в соединительной ткани, а также путь катаболизма, который происходит в печени и, частично, в коже человека.В печени и коже дезаминирование гистидина катализирует фермент гистидаза. Образующийся уроканат только в печени способен превращаться через ряд стадий в глутамат. Наследственный дефект гистидазы вызывает накопление гистидина в организме и развитие гистидинемии, которая проявляется задержкой в умственном и физическом развитии детей. Ферменты гистидаза и уроканиназа являются гепатоспецифическими, поэтому их определение используется в клинике для диагностики поражений печени. Метаболизм фенилаланина, тирозина и гистидина в разных тканях приводит к образованию различных биологически активных соединений. Дефекты ферментов обмена этих аминокислот проявляются как наследственные заболевания (энзимопатии). 1. В печени фенилаланин метаболизируется двумя путями. Большая часть не использованного для синтеза белков Фен (до 80%) превращается в тирозин под действием фермента фенилаланингидроксилазы при участии кофермента тетрагидробиоптерина. Небольшое его количество включается в альтернативный путь. Конъюгат фенилацетата с глутамином выводится с мочой. При нормальной активности фенилаланингидроксилазы этот путь не имеет большого значения, но становится главным при нарушении превращения фенилаланина в тирозин. Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурии (ФКУ): • классическая - наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы. Наиболее тяжелое проявление - нарушение умственного и физического развития, судорожный синдром; • вариантная (биоптеринзависимая гиперфенилаланинемия) - следствие мутаций в генах, контролирующих метаболизм тетрагидробиоптерина. Клинические проявления - близкие, но не совпадающие с классической ФКУ. Тяжелые проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации Фен ограничивают транспорт Тир и Три через гематоэнцефалический барьер и тормозят синтез нейромедиаторов. Тетрагидробиоптерин (Н4БП) необходим для реакций гидроксилирования не только Фен, но также Тир и Три, поэтому при недостатке этого кофермента нарушается метаболизм всех трех аминокислот, в том числе синтез нейромедиаторов - катехоламинов и серотонина. Заболевание характеризуется тяжелыми неврологическими нарушениями и ранней смертью (злокачественная ФКУ). 2. Нарушение катаболизма Тир в печени на стадии расщепления гомогентизиновой кислоты приводит к алкаптонурии («черная моча»). Для этого заболевания характерно выделение с мочой гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует черные пигменты - алкаптоны. Алкаптоны способны откладываться в хрящевой ткани и суставах, что вызывает артриты и охроноз (черные пятна). Болезнь врожденная, связана с дефектом фермента диоксигеназы гомогентизиновой кислоты. 3. Наследственный дефект тирозиназы - фермента, катализирующего в меланоцитах превращение тирозина в ДОФА, вызывает нарушение синтеза темных пигментов меланинов, которое приводит к альбинизму. Основным клиническим проявлением альбинизма являются отсутствие пигментации кожи и волос. У больных часто снижается острота зрения и появляется светобоязнь. Длительная инсоляция таких больных приводит к ожогам и раку кожи. Вопрос №80 Пути обмена безазотистого остатка аминокислот: окислительное расщепление аминокислот, глюконеогенез из аминокислот. Гликогенные и кетогенные аминокислоты. Примеры. Биосинтез заменимых аминокислот. 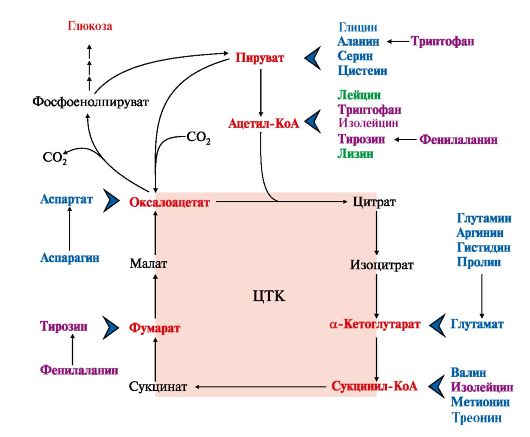 Катаболизм всех аминокислот сводится к образованию шести соединений, являющихся метаболитами ОПК: • пируват, • ацетил-КоА, • α-кетоглутарат, • сукцинил-КоА, • фумарат, • оксалоацетат. Полное окисление безазотистых остатков аминокислот до углекислого газа и воды реального энергетического значения не имеет. Основной путь их использования - включение в глюконеогенез. Этот процесс усиливается при голодании и сахарном диабете. Б 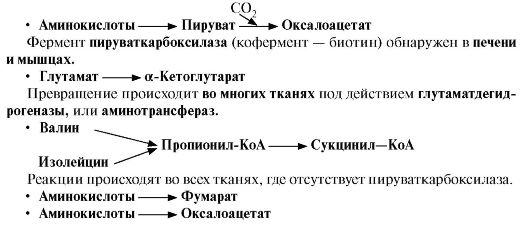 езазотистые остатки аминокислот используются для восполнения количества метаболитов ОПК, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеротическими. Можно выделить пять анаплеротических реакций: езазотистые остатки аминокислот используются для восполнения количества метаболитов ОПК, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеротическими. Можно выделить пять анаплеротических реакций:Последние две реакции происходят в печени. Первые две реакции являются основными анаплеротическими реакциями. Гликогенные аминокислоты - АмК, которые превращаются в ПВК и промежуточные продукты ЦТК (а-КГ, сукцинил-КоА, фумарат, ЩУК). Они через ЩУК, используются в глюконеогенезе (ала, асн, асп, гли, глу, глн, про, сер, цис, арг, гис, вал, мет, тре). Кетогенные аминокислоты – АмК, которые в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Смешанные (глико-кетогенными) аминокислоты – АК, при катаболизме которых образуются метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Эти АК используются для синтеза глюкозы и кетоновых тел. |

 екоторые аминокислоты подвергаются гниению в толстом кишечнике
екоторые аминокислоты подвергаются гниению в толстом кишечнике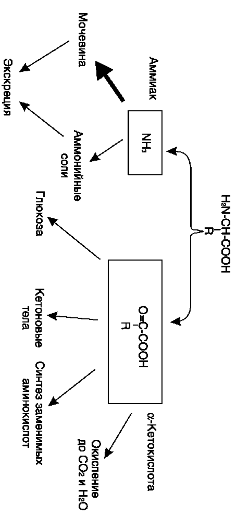 ля перераспределения азота в организме;
ля перераспределения азота в организме;