|
|
Ответы к экзамену По биохимии 1 структура и функции белков 3 ферменты 10 нуклеиновые кислоты и нуклеотиды 21
Вопрос №38
Макроэргические соединения, их химическое строение, образование и функции. Аденозинтрифосфорная кислота. Два пути синтеза АТФ в организме.
Макроэргические соединения — группа природных веществ, молекулы которых содержат богатые энергией, или макроэргические, связи; присутствуют во всех живых клетках и участвуют в накоплении и превращении энергии. Разрыв макроэргических связей сопровождается выделением энергии, используемой для биосинтеза и транспорта веществ, мышечного сокращения, пищеварения и других процессов жизнедеятельности организма. Все известные М.с. содержат фосфорильную или ацильную группы.
Важной группой соединений, в которую входят М.с., являются аденозинфосфорные, или адениловые, кислоты — нуклеозиды, содержащие аденин, рибозу и остатки фосфорной кислоты
В клетке существуют и другие макроэргические соединения. Большинство из них, также как и АТФ, содержат высокоэнергетическую фосфатную связь. К этой группе соединений относятся и другие нуклеозидтрифосфаты, ацилфосфаты, фосфоенолпируват, креатинфосфат и другие молекулы. Кроме того, в живых организмах присутствуют молекулы с высокоэнергетической тиоэфирной связью, ацилтиоэфиры.
Наиболее значительное из них — аденозинтрифосфорная кислота (аденозинтрифосфат, АТФ).
АТФ представляет собой аденозинфосфорную кислоту, содержащую 3 остатка фосфорной кислоты (или фосфатных остатка), служит универсальным переносчиком и основным аккумулятором химической энергии в живых клетках, кофермент многих ферментов. АТФ не единственное биологически активное соединение, содержащее пирофосфатные связи.
А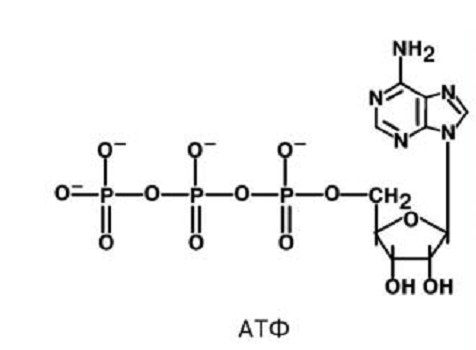 ТФ – производное нуклеотида, у которого в 5’-положении находятся 3 остатка фосфорной кислоты, две концевые связаны макроэргическими связями. При их расщеплении выделяется энергия. ТФ – производное нуклеотида, у которого в 5’-положении находятся 3 остатка фосфорной кислоты, две концевые связаны макроэргическими связями. При их расщеплении выделяется энергия.
Функции:
Донор энергии для биосинтеза веществ
Мышечное сокращение
Транспорт веществ через мембрану
Работа ионных насосов
Поддержание температуры тела
За сутки вырабатывается около 60 кг АТФ, но они не накапливаются, а сразу используются по мере необходимости.
Время жизни одной молекулы АТФ – 1 минута, т.е. в организме постоянно происходит синтез АТФ.
Синтез АТФ можно представить как фосфорилирование АДФ - АДФ + Фн → АТФ
Пути синтеза АТФ:
Субстратное фосфорилирование
Может протекать в цитоплазме (гликолиз) или митохондриях (ЦТК).
Протекает на уровне субстрата (без участия цепи переноса электронов) за счет энергии, которая выделяется при разрыве макроэргических связей в субстрате.
Ферментативный перенос фосфатной группы на молекулы АДФ с образованием АТФ, происходящий в цитоплазме. При субстратном фосфорилировании в результате определенных окислительно-восстановительных реакций образуются богатые энергией нестабильные молекулы, фосфатная группа которых с помощью соответствующих ферментов переносится на АДФ с образованием АТФ. Реакции субстратного фосфорилирования протекают в цитоплазме и катализируются растворимыми ферментами.
Окислительное фосфорилирование
Протекает только в митохондриях.
Протекает с окислением субстратов, с участием цепи переноса электронов за счет энергии протонного градиента.
Окисление субстрата – отщепление от него электронов и протонов, т.е. атомов водорода.
Ферменты – дегидрогеназы (I класс). Участие коферментов НАД+ и ФАД.
Окисление субстрата и синтез АТФ протекают с участием кислорода (его требуется до 500 л в сутки).
Тканевое дыхание – окисление веществ с участием кислорода до конечных продуктов (СО2 и Н2О). Всегда сопровождается синтезом АТФ путем ОФ.
Вопрос №39
Понятие о метаболизме, анаболизме, катаболизме, конечных продуктах катаболизма.
Цикл АтФ-АДФ. Окислительное и субстратное фосфорилирование.
Обмен веществ включает стадии:
Поступление пищевых веществ в организм и их расщепление в ЖКТ
Метаболизм
Выделение конечных продуктов обмена из организма
Метаболизм – это совокупность химических реакций, протекающих в организме:
Катаболизм – расщепление сложных пищевых веществ до конечных продуктов – СО2, Н2О, мочевина. В результате катаболизма энергия, заключенная в пищевых веществах, трансформируется в энергию АТФ. Катаболизм сопровождается синтезом АТФ.
Конечные продукты – вещества, которые не подвергаются превращению в организме и выводятся из него.
А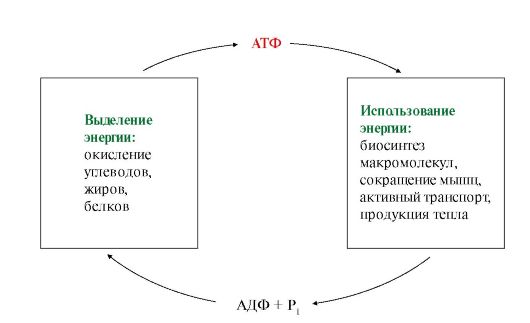 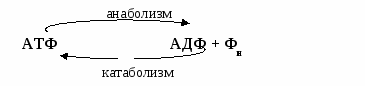 наболизм – синтез сложных веществ из простых с затратой АТФ, полученной при катаболизме. Следовательно, энергетический обмен тесно связан с метаболизмом и представляет собой цикл. наболизм – синтез сложных веществ из простых с затратой АТФ, полученной при катаболизме. Следовательно, энергетический обмен тесно связан с метаболизмом и представляет собой цикл.
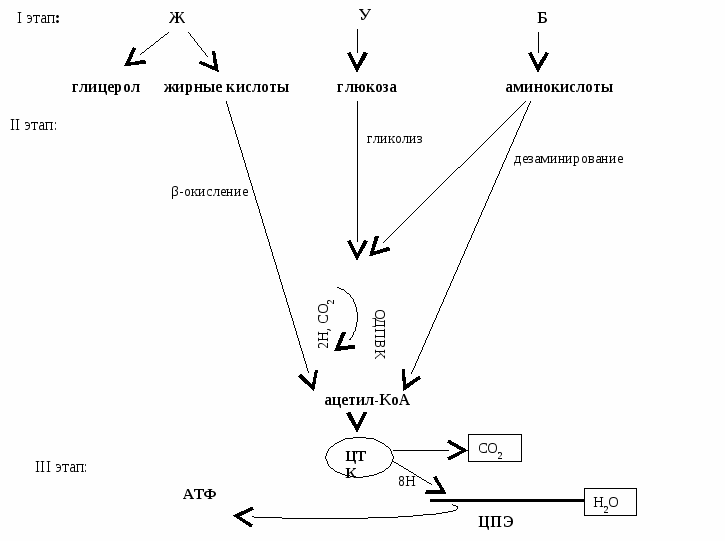
Вопрос №40
Строение субстратов, последовательность реакций, ферменты и их значение в реакциях общего пути катаболизма - цикла трикарбоновых кислот (цикл Кребса). Связь с ЦПЭ.
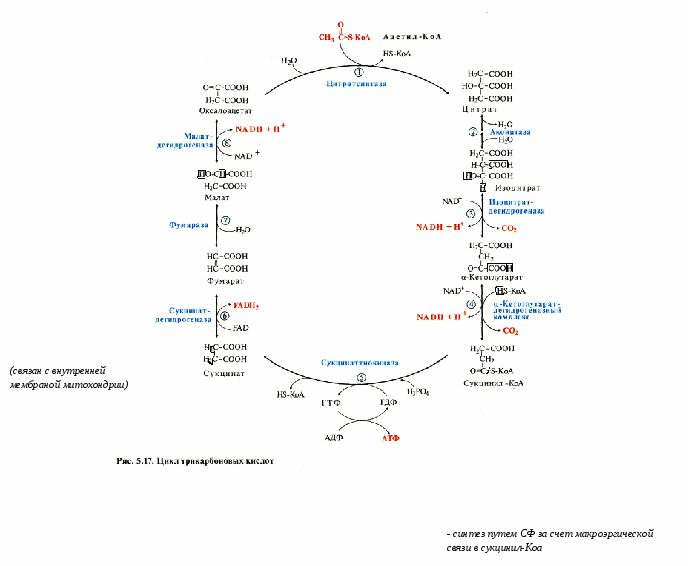
ЦТК = цикл лимонной кислоты = цитратный цикл = цикл Кребса – открыт в 1937 г.
ЦТК – общий конечный путь катаболизма Б, Ж, У.
Функции ЦТК:
общий конечный путь катаболизма Б, Ж, У
основной, но не единственный поставщик атомов Н в ЦПЭ
анаболическая функция (синтетическая) – из промежуточных продуктов образуются аминокислоты, глюкоза, гем.
Протекает в матриксе митохондрий.
Все ферменты функционируют в матриксе, кроме сукцинатдегидрогеназы (связан с внутренней мембраной митохондрии).
Существует 3 регуляторных реакции, т.е. регуляторных фермента:
цитратсинтаза
изоцитратдегидрогеназа (самая медленная реакция, определяет скорость)
α-Кетоглутаратдегидрогеназный комплекс (похож на ПДК)
В цикле 8 реакций, 4 из них – реакции окисления (ферменты – дегидрогеназы, использующие НАД+ и ФАД).
В цикл вступает двухуглеродная молекула ацетил-КоА, соединяющаяся с четырехуглеродным оксалоацетатом (ЩУК). Образуется шестиуглеродный цитрат.
Далее – 4 реакции оксиления и 2 реакции декарбоксилирования.
И оксалоацетат регенерирует.
Таким образом, в результате 4 реакций окисления в ЦТК и одной в ОДПВК отщепляются атомы Н (8 в ЦТК и 2 в ОДПВК). Эти Н поступают в ЦПЭ, где утилизируются с образованием конечного продукта – воды (метаболическая вода 400-500 мл).
Последовательность реакций:
Образование цитрата - углеродный атом метильной труппы ацетил-КоА связывается с карбонильной группой оксалоацетата; одновременно расщепляется тиоэфирная связь и освобождается коэнзим A. Реакция сопровождается потерей большого количества энергии в виде теплоты. Катализирует реакцию цитратсинтаза, фермент, локализованный в матриксе митохондрий.
Превращение цитрата в изоцитрат - Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цисаконитовой кислоте, которая предположительно образуется в реакции. Однако это соединение не обнаруживается в свободном виде, так как не отделяется от активного центра фермента до завершения реакции.
Окислительное декарбоксилирование изоцитрата - катализирует изоцитратдегидрогеназа. Реакция, катализируемая NAD-зависимой изоцитратдегидрогеназой, - самая медленная реакция цитратного цикла. АДФ - аллостерический активатор фермента.
Окислительное декарбоксилирование α-кетоглутарата - с образованием в качестве конечных продуктов сукцинил-КоА, СО2 и NADH + Н+. Реакцию катализирует α-кетоглутаратдегидрогеназный комплекс, который по структуре и функциям сходен с пируватдегидрогеназным комплексом (ПДК) и состоит из 3 ферментов: α-кетоглутаратдекарбоксилазы, дигидролипоилтранссукцинилазы и дигидролипоилдегидрогеназы.
Превращение сукцинил-КоА в сукцинат - катализирует сукцинаттиокиназа. Промежуточный этап реакции - фосфорилирование молекулы фермента по одному из гистидиновых остатков активного центра. Затем остаток фосфорной кислоты присоединяется к ГДФ с образованием ГТФ. С ГТФ концевая фосфатная группа может переноситься на АДФ с образованием АТФ; эту обратимую реакцию катализирует нуклеозид-дифосфаткиназа.
Дегидрирование сукцината - Образовавшийся на предьщущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы. Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железосерные центры, где атомы железа меняют свою валентность, участвуя в транспорте электронов.
О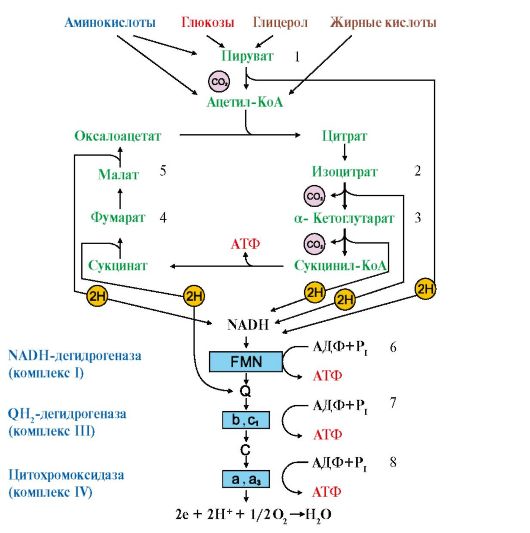 бразование малата из фумарата - Образование малата происходит при участии фермента фумаратгидратазы. Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только трансформы фумарата. бразование малата из фумарата - Образование малата происходит при участии фермента фумаратгидратазы. Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только трансформы фумарата.
Дегидрирование малата - В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоацетата. Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий.
Связь реакций общего пути катаболизма с ЦПЭ:
1-5 - первичные доноры водорода для ЦПЭ; 1, 2, 3, 5 - субстраты NAD-зависимых дегидрогеназ; 4 - субстрат FAD-зависимой сукцинатдегидрогеназы; 6, 7, 8 - этапы сопряжения дыхания и окислительного фосфорилирования
Вопрос №41
Общий путь катаболизма - окислительное декарбоксилирование α-кетокислот. Механизм и регуляция окислительного декарбоксилирования пировиноградной кислоты. Роль витаминов.
Декарбоксилирование a-кетокислот осуществляется под влиянием декарбоксилаз, коферментом которых является тиаминпирофосфат.
ОДПВК – ферментативный процесс превращения ПВК в ацетил-КоА.
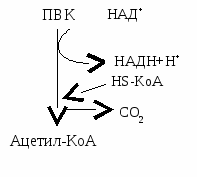
Общая характеристика:
Протекает в митохондриях
Под действием мультиферментного комплекса, связанного с внутренней мембраной
С участием трех ферментов
Е1 – пируватдекарбоксилаза
Е2 – дигидролипоилацетилтрансфераза (ацетилтрансфераза дигидролипоевой кислоты)
Е3 – дигидролипоилдгидрогеназа
Участвуют 5 коферментов (следовательно, 5 витаминов)
Кофермент
|
Витамин
|
ЛК (липоевая кислота)
|
ЛК (липоевая кислота)
|
ТДФ (тиаминдифосфат)
|
В1 (тиамин)
|
ФАД
|
В2 (рибофлавин)
|
НАД+
|
РР (никотиновая кислота)
|
HS-KoA (кофермент А)
|
Пантотеновая кислота
|
Особенность: 3 фермента очень прочно связаны с коферментами и представляют собой сложные белки
Е1 связан с ТДФ, Е2 – с ЛК, Е3 – с ФАД
Комплекс трех ферментов = ПДК (пируватдегидрогеназный комплекс).
Все 3 фермента функционируют вместе, а ЛК-Е2 может перемещаться к АЦ Е1 и Е3, поэтому промежуточные продукты не поступают в матрикс.
С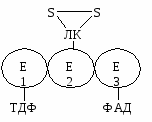 хема ПДК: хема ПДК:
ОДПВК – циклический процесс. Проходит следующие этапы:
С участием двух субстратов (ПВК и ЛК-Е2)
Под действием Е1 с участие ТДФ от ПВК отщепляется СО2, а ацетильный остаток (СН3СО-) переносится на ЛК-Е2.
Образуется ацетиллипоат-Е2
Катализируется Е2
Протекает с участием кофермента А (т.е. Е2 будет превращать свой собственный кофермент).
Под действием Е2 ацетильный остаток от ЛП переносится на КоА.
Образуется дигидролипоат-Е2 и ацетил-КоА.
Под действием Е3 происходит окисление дигидролипоевой кислоты с участием ФАД (промежуточный переносчик Н) и НАД+.
В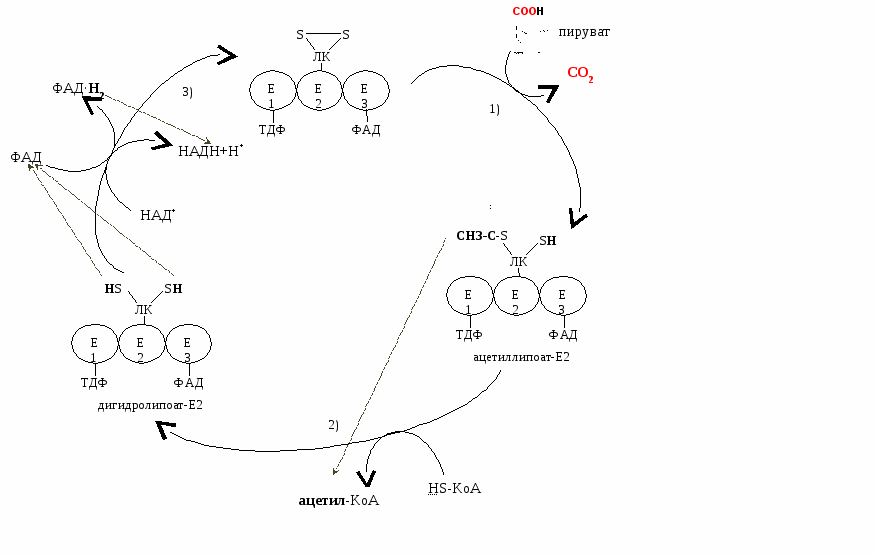 результате ПДК приходит в исходное состояние. результате ПДК приходит в исходное состояние.
2.ЦТК
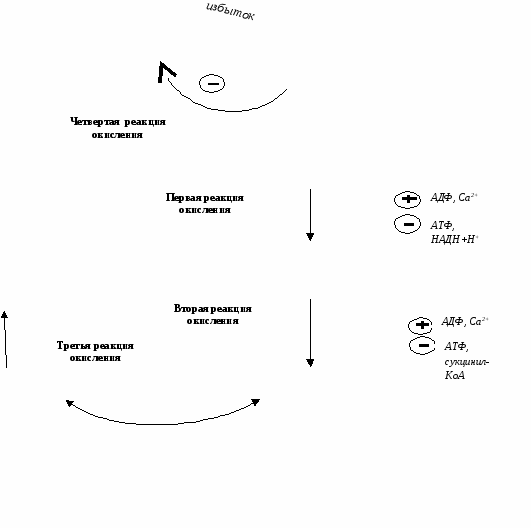
Регулируемым ферментом ПВК-дегидрогеназного комплекса является первый фермент –пируватдегидрогеназа (Е1). Два вспомогательных фермента – киназаи фосфатаза обеспечивают регуляцию активности пируватдегидрогеназы путем ее фосфорилированияи дефосфорилирования.
Вспомогательный фермент киназаактивируется при избытке конечного продукта биологического окисленияАТФи продуктов ПВК-дегидрогеназного комплекса – НАДНи ацетил-S-КоА. Активная киназа фосфорилирует пируватдегидрогеназу, инактивируя ее, в результате первая реакция процесса останавливается.
Фермент фосфатаза, активируясь ионами кальцияили инсулином, отщепляет фосфат и активирует пируватдегидрогеназу.
Вопрос № 42
НАД-зависимые дегидрогеназы и их субстраты. Строение окисленной и восстановленной форм НАД. Путь электронов в дыхательной цепи от субстратов, окисляемых НАД-зависимыми дегидрогеназами. Коэффициент Р/О.
Д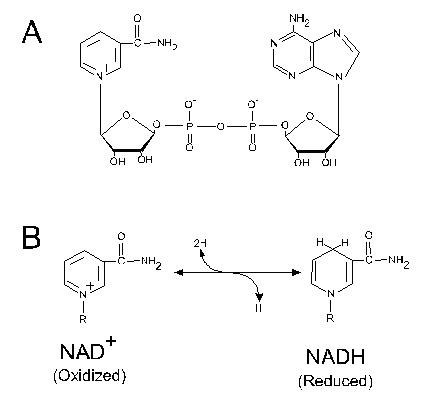 егидрогеназы окисляют субстрат путем отнятия водорода. Со-ферментная часть дегидрогеназ представлена пиридиновыми нуклеотидами (НАД). Пиридиновые дегидрогеназы являются анаэробными ферментами, они не способны к последующей передаче восстановительного эквивалента на кислород. К НАД-зависимым дегидрогеназам относят лактатдегидрогеназу, малатдегидрогеназу, изоцитратдегидрогеназу, к НАДФ-зависимым глюкозо-6-фосфатдегидрогеназу, 6-фосфоглюконатдегидрогеназу. егидрогеназы окисляют субстрат путем отнятия водорода. Со-ферментная часть дегидрогеназ представлена пиридиновыми нуклеотидами (НАД). Пиридиновые дегидрогеназы являются анаэробными ферментами, они не способны к последующей передаче восстановительного эквивалента на кислород. К НАД-зависимым дегидрогеназам относят лактатдегидрогеназу, малатдегидрогеназу, изоцитратдегидрогеназу, к НАДФ-зависимым глюкозо-6-фосфатдегидрогеназу, 6-фосфоглюконатдегидрогеназу.
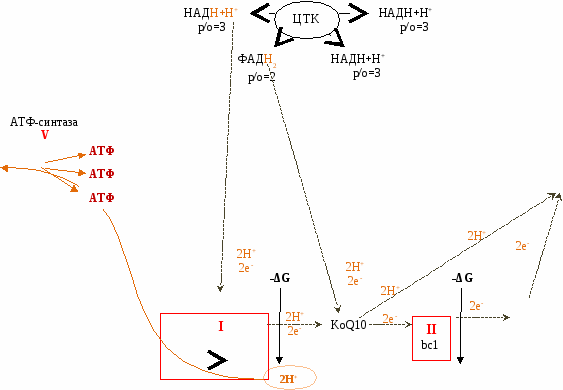
НАД-зависимые субстраты тканевого дыхания – субстраты цикла Кребса изоцитрат, α-кетоглутарат и малат. Это также пируват, гидроксибутират и β–гидрокси-ацилКоА, глутамат и некоторые другие аминокислоты. Водород от НАД-зависимых субстратов c помощью НАД-зависимых дегидрогеназ передаётся на I-й комплекс дыхательной цепи.
Механизм переноса электронов и образования воды
Электроны могут поступать в ЦПЭ от НАДН+Н+ и ФАД∙Н2.
От НАДН+Н+ - в начало цепи.
НАДН+Н+ отделяется от фермента и поступает к внутренне мембране митохондрий.
Отделяется 2Н (в виде 2е- и 2Н+) и пуступает к первому участку дыхательной цепи – к НАДН-ДГ (сначала на ФМН, потом на FeS).
От I ФК е- и Н+ передаются на Q10. Он становится QH2.
От QH2 по системе цитохромов передаются только электроны, а протоны поступают матрикс и идут на восстановление воды.
На этом тканевое дыхание заканчивается.
Р
НАДН-ДГ
ФМН
FeS
 оль передачи электронов в синтезе АТФ оль передачи электронов в синтезе АТФ
В начало цепи поступают электронов, богатые энергией.
В процессе переноса из-за разности ОВ-потенциала они теряют эту энергию на каждом участке (около 200 кДж). Этого хватило бы на синтез 4 молекул АТФ, но синтезируется всего 3. Остальная энергия рассеивается для поддержания температуры тела.
Больше всего свободной энергии выделяется в трех участках. Они называются участками сопряженного синтеза АТФ (I, III, IV ФК).
Свободная энергия Гиббса, которая выделяется при переносе электронов в трех участках. Направлена на выталкивание протонов из матрикса в межмембранное пространство.
В результате наружная сторона внутренне мембраны заряжается положительно, а внутренняя – отрицательно.
Создается трансмембранный электрохимический протонный градиент. Он необходим для последующего синтеза АТФ.
Протоны по своему градиенту стремятся вернуться назад в матрикс. Но внутренняя мембрана для них не проницаема, и они возвращаются в матрикс через специфический F1-комплекс (АТФ-синтаза, V ФК).
F1-комплекс состоит из двух частей:
F0 – канал в мембране (из 6 субъединиц)
F1 = фермент АТФ-синтаза – синтез АТФ при прохождении протонов (6 субъединиц).
Каждая пара протонов, проходящая через F1-комплекс, активирует АТФ-синтазу, которая синтезирует 1 молекулу АТФ.
Таким образом, если е- и Н+ поступают в начало цепи (от НАДН+Н+), то в процессе сопряженного синтеза образуется 3 АТФ.
Следовательно, за счет 4 реакций ЦТК синтезируется 11 АТФ (3х3+1х2).
Коэффициент фосфорилирования (р/о) - количество АТФ, которое образуется при переносе электронов к одному атому кислорода. Он может быть равен 3, 2, 1.
Вопрос № 43
ФАД-зависимые дегидрогеназы и их субстраты. Строение окисленной и восстановленной форм ФАД. Путь электронов в дыхательной цепи от субстратов, окисляемых ФАД-зависимыми дегидрогеназами. Коэффициент Р/О.
Д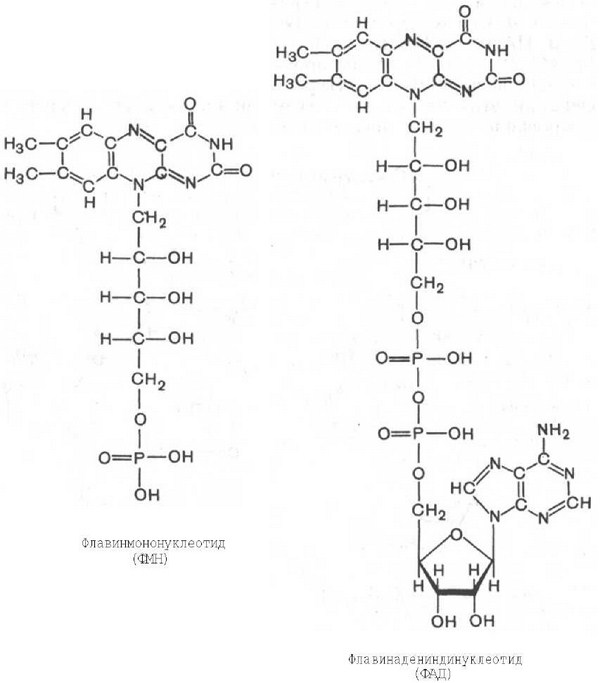 егидрогеназы окисляют субстрат путем отнятия водорода. Со-ферментная часть дегидрогеназ представлена флавиновыми нуклеотидами (ФМН, ФАД). Флавиновые дегидрогеназы могут быть и анаэробными, и аэробными. Окисление с участием флавиновых дегидрогеназ аэробного типа, как правило, ведет к образованию пероксида водорода. Эти дегидрогеназы могут быть названы и оксидазами из-за их взаимодействия с кислородом. Флавиновые дегидрогеназы отличются большим разнообразием окислительно-восстановительного потенциала, они нередко содержат металлы - медь, молибден, железо. егидрогеназы окисляют субстрат путем отнятия водорода. Со-ферментная часть дегидрогеназ представлена флавиновыми нуклеотидами (ФМН, ФАД). Флавиновые дегидрогеназы могут быть и анаэробными, и аэробными. Окисление с участием флавиновых дегидрогеназ аэробного типа, как правило, ведет к образованию пероксида водорода. Эти дегидрогеназы могут быть названы и оксидазами из-за их взаимодействия с кислородом. Флавиновые дегидрогеназы отличются большим разнообразием окислительно-восстановительного потенциала, они нередко содержат металлы - медь, молибден, железо.
Ф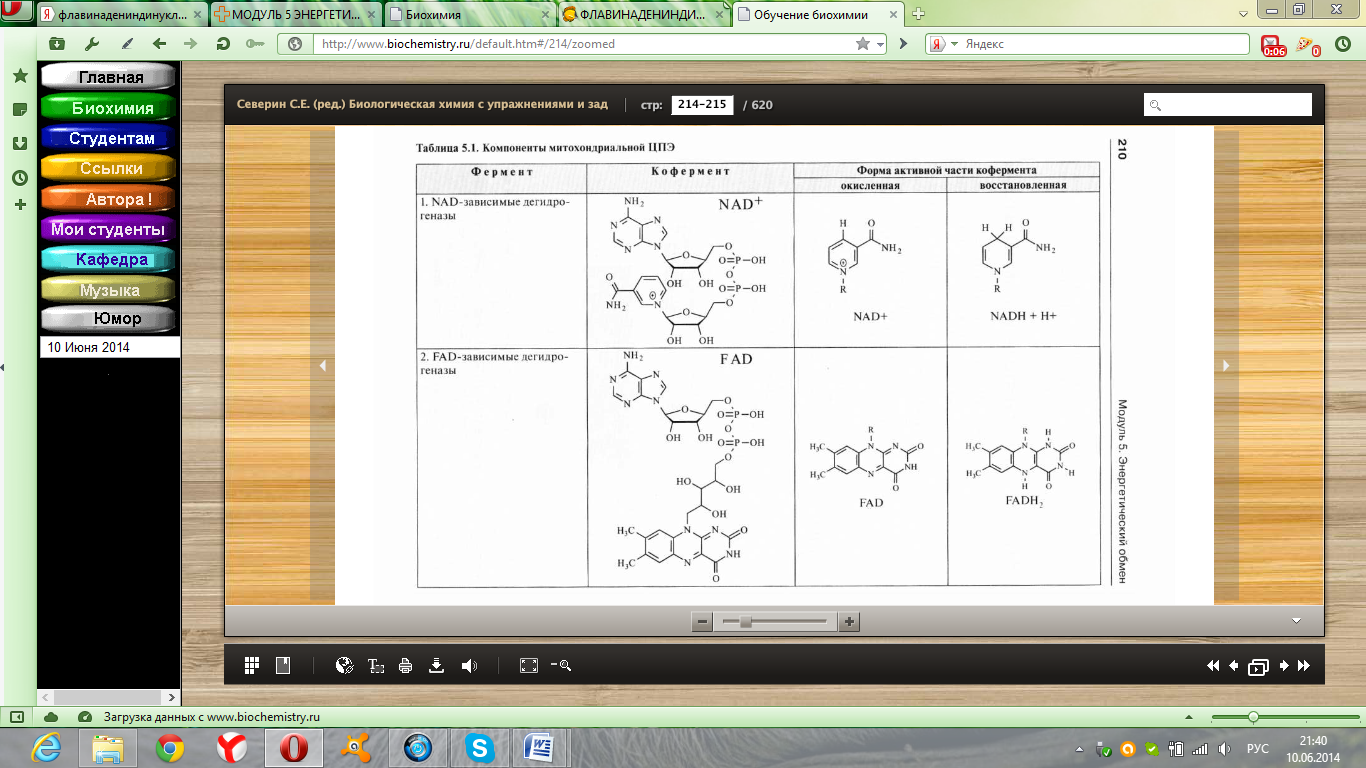 АД-зависимые субстраты тканевого дыхания – сукцинат, глицерол-3-фосфат, ацил АД-зависимые субстраты тканевого дыхания – сукцинат, глицерол-3-фосфат, ацил
КоА и некоторые другие. Водород от ФАД-зависимых субстратов передаётся на II-й комплекс дыхательной цепи.
Механизм переноса электронов и образования воды
Электроны могут поступать в ЦПЭ от НАДН+Н+ и ФАД∙Н2.
От ФАД∙Н2 – на Q10.
Он становится QH2.
От QH2 по системе цитохромов передаются только электроны, а протоны поступают матрикс и идут на восстановление воды.
На этом тканевое дыхание заканчивается.


НАДН-ДГ
ФМН
FeS

Роль передачи электронов в синтезе АТФ
В начало цепи поступают электронов, богатые энергией.
В процессе переноса из-за разности ОВ-потенциала они теряют эту энергию на каждом участке (около 200 кДж). Этого хватило бы на синтез 4 молекул АТФ, но синтезируется всего 3. Остальная энергия рассеивается для поддержания температуры тела.
Больше всего свободной энергии выделяется в трех участках. Они называются участками сопряженного синтеза АТФ (I, III, IV ФК).
Свободная энергия Гиббса, которая выделяется при переносе электронов в трех участках. Направлена на выталкивание протонов из матрикса в межмембранное пространство.
В результате наружная сторона внутренне мембраны заряжается положительно, а внутренняя – отрицательно.
Создается трансмембранный электрохимический протонный градиент. Он необходим для последующего синтеза АТФ.
Протоны по своему градиенту стремятся вернуться назад в матрикс. Но внутренняя мембрана для них не проницаема, и они возвращаются в матрикс через специфический F1-комплекс (АТФ-синтаза, V ФК).
F1-комплекс состоит из двух частей:
F0 – канал в мембране (из 6 субъединиц)
F1 = фермент АТФ-синтаза – синтез АТФ при прохождении протонов (6 субъединиц).
Каждая пара протонов, проходящая через F1-комплекс, активирует АТФ-синтазу, которая синтезирует 1 молекулу АТФ.
Таким образом, если е- и Н+ поступают в начало цепи (от ФАД∙Н2), то в процессе сопряженного синтеза образуется 2 АТФ.
Следовательно, за счет 4 реакций ЦТК синтезируется 11 АТФ (3х3+1х2).
Коэффициент фосфорилирования (р/о) - количество АТФ, которое образуется при переносе электронов к одному атому кислорода. Он может быть равен 3, 2, 1.
Вопрос №44
Современные представления о механизме окислительного фосфорилирования. Хемоосмотическая теория Митчелла.
Теорию создания протонного градиента и его роль в синтезе АТФ создал Митчелл (хеми-осмотическая теория):
«Компоненты дыхательной цепи расположены строго определенным образом так, что при передаче пары электронов по ЦПЭ энергия, вылеляющаяся в трех участках, направлена на выталкивание протонов в межмембранное пространство. В результате создается трансмембранный электрохимический протонный градиент – движущая сила синтеза АТФ» (путем окислительного фосфорилирования).
Вопрос №45
Современные представления о механизме тканевого дыхания.
Дыхательная цепь, ее надмолекулярная организация, функции.
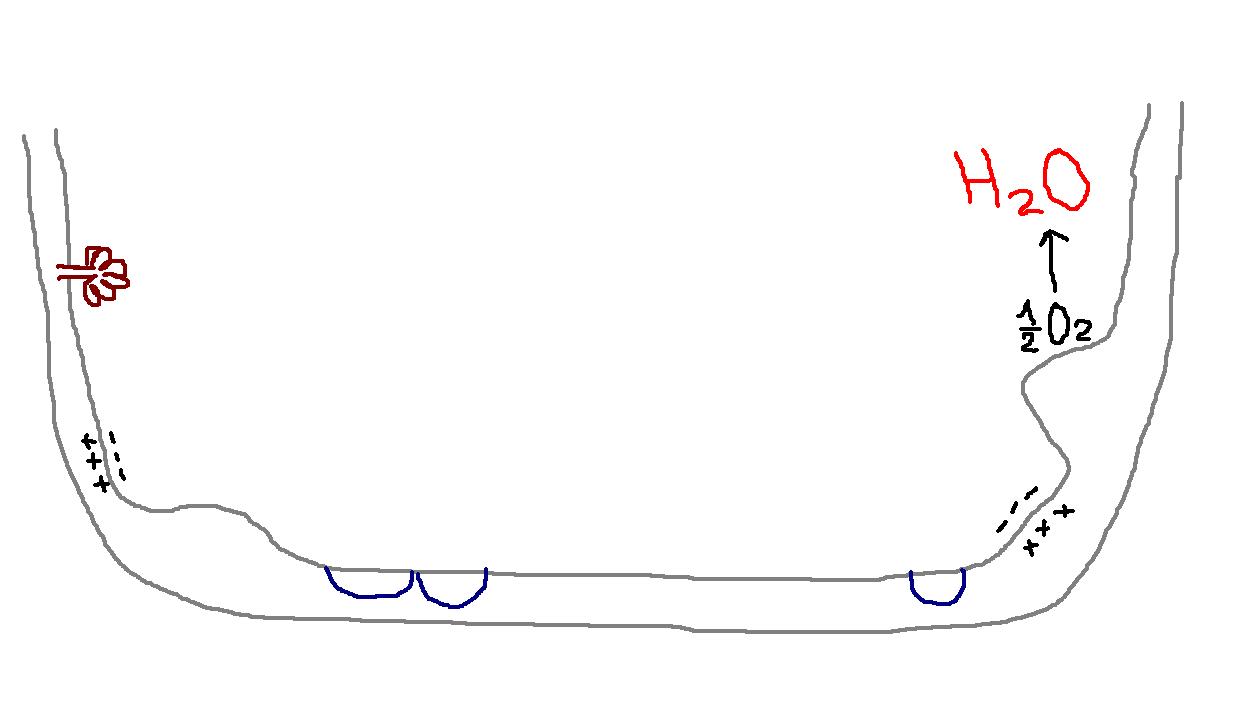
Дыхательная цепь – последовательная цепь ферментов, осуществляющая перенос ионов водорода и электронов от окисляемых субстратов к молекулярному кислороду – конечному акцептору водорода. В ходе этих реакций выделение энергии происходит постепенно, небольшими порциями, и она может быть аккумулирована в форме АТФ. Локализация ферментов дыхательной цепи – внутренняя митохондриальная мембрана.
Строение митохондриальной ЦПЭ
протекает на внутренней мембране митохондрий
функционируют 3 ферментных комплекса (I, III, IV)
компоненты располагаются в порядке возрастания окислительно-восстановительного потенциала, т.е. окислительные свойства (способность забирать электроны) возрастает от начала цепи; самый сильный – кислород.
В ЦПЭ существуют подвижные и неподвижные компоненты.
а) НАДН-ДГ (-дегидрогенеза) – неподвижный компонент.
Это первый ферментный комплекс.
Его называют первым участком сопряженного синтеза АТФ.
Имеет кофермент ФМН (флавинмононуклеотид) и FeS.
Принимает электроны и протоны от НАДН+Н+.
б) Кофермент Q10 (убихинон) – подвижный компонент.
Синтезируется из промежуточных продуктов биосинтеза холестерола.
Принимает электроны и протоны и от первого компонента ЦПЭ, и от второго (ФАД∙Н2).
в) Система цитохромов – сложные белки гемопротеины
Имеют в составе Fe, который может менять валентность при переносе электронов (2+ → 3+).
Цитохромы переносят только электроны.
bc1 – неподвижный компонент
Третий ферментный комплекс (QН2-ДГ).
Второй участок сопряженного синтеза АТФ.
с – подвижный компонент
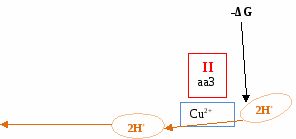
аа3 – неподвижный компонент
Четвертый ферментный комплекс (цитохромоксидаза – передает электроны на кислород).
Третий участок сопряженного синтеза АТФ.
Содержит Cu2+
Таким образом, все ферментные комплексы – неподвижные компоненты.
Существует пятый ферментный комплекс – АТФ-синтаза – осуществляет синтез АТФ.
Функция дыхательной цепи – утилизация восстановленных дыхательных переносчиков, образующихся в реакциях метаболического окисления субстратов (главным образом в цикле трикарбоновых кислот). Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соответственно своим окислительно-восстановительным потенциалам эти соединения в восстановленной форме подключаются к дыхательной цепи (см. рис. 9.7). В дыхательной цепи происходит дискриминация протонов и электронов: в то время как протоны переносятся через мембрану, создавая ΔрН, электроны движутся по цепи переносчиков от убихинола к цитохромоксидазе, генерируя разность электрических потенциалов, необходимую для образования АТФ протонной АТФ-синтазой. Таким образом, тканевое дыхание «заряжает» митохондриальную мембрану, а окислительное фосфорилирование «разряжает» ее. Разность электрических потенциалов на митохондриальной мембране, создаваемая дыхательной цепью, которая выступает в качестве молекулярного проводника электронов, является движущей силой для образования АТФ и других видов полезной биологической энергии
Все ферментные комплексы ЦПЭ (места сопряженного синтеза) были изучены с помощью ингибиторов ЦПЭ - веществ, блокирующих процесс переноса электронов по ЦПЭ:
I ФК блокируется ядом ротеноном и аминобарбиталом
III ФК – антибиотиком антимицином-Д
IV ФК – цианидами, угарным газом
V ФК – антибиотиком олигомицином.
Вопрос №46
Сопряжение окисления с фосфорилированием АДФ. Дыхательный контроль.
Разобщение дыхания и фосфорилирования.
Механизм сопряжения дыхания с фосфорилированием АДФ. Транспорт протонов и электронов от восстановленного НАД к молекулярному кислороду представляет собой экзергонический процесс:
НАДН + Н+ + ½О2 → НАД+ + Н2О + энергия
Если еще упростить запись этого процесса, то получим уравнение реакции горения водорода в кислороде, которое известно всем со школьной скамьи:
Н2 + ½О2 → Н2О + энергия
Разница состоит лишь в том, что при реакции горения энергия освобождается сразу полностью, а в цепи дыхания, благодаря тому что она разбита на несколько окислительно-восстановительных реакций, происходит поэтапное освобождение энергии. Эта энергия аккумулируется в фосфатных связях АТФ и используется для жизнедеятельности клеток.
Первым результатом работы электронотранспортной цепи является образование эндогенной воды, в молекуле которой атомы водорода являются водородами, снятыми с субстратов соответствующими дегидрогеназами, а атом кислорода - терминальным акцептором электронов (см. рис. 23). Приняв на себя 2 электрона, он превращается в реакционноспособный анион (О2-), который сразу же взаимодействует с протонами водорода, "выброшенными" коферментом Q. Образование эндогенной воды происходит в матриксе митохондрий.
Механизм сопряжения дыхания с фосфорилированием АДФ был разработан английским биохимиком П. Митчеллом, гипотеза которого получила название протондвижущей или хемиосмотической. В нашей стране гипотеза П. Митчелла была развита в работах В.П. Скулачева.
Согласно хемиосмотической гипотезе энергия переноса протонов и электронов вдоль дыхательной цепи первоначально сосредоточивается в виде протонного потенциала, создающегося движением через мембрану заряженных протонов водорода. Транспорт протонов обратно через мембрану сопряжен с фосфорилированием АДФ, которое осуществляется протонзависимой АТФсинтазой (Н+ = АТФаза).
Дыхательный контроль . Если в организме количество АДФ увеличено, то активируется все тканевое дыхание, окисление субстратов и синтез АТФ. И наоборот.
Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз.
Существуют вещества, которые (как и ингибиторы дыхательной цепи) снижают синтез АТФ. Это разобщители окислительного фосфорилирования.
Они легко проникают через внутреннюю мембрану митохондрий, связывают Н+ (протонофоры) или другие положительно заряженные ионы (ионофоры) и переносят их назад в матрикс.
Следовательно, протонный градиент не создается, АТФ не синтезируется.
Этими веществами являются 2,4 – динитрофенол, жирные кислоты, тироксин в избытке.
Вопрос №47
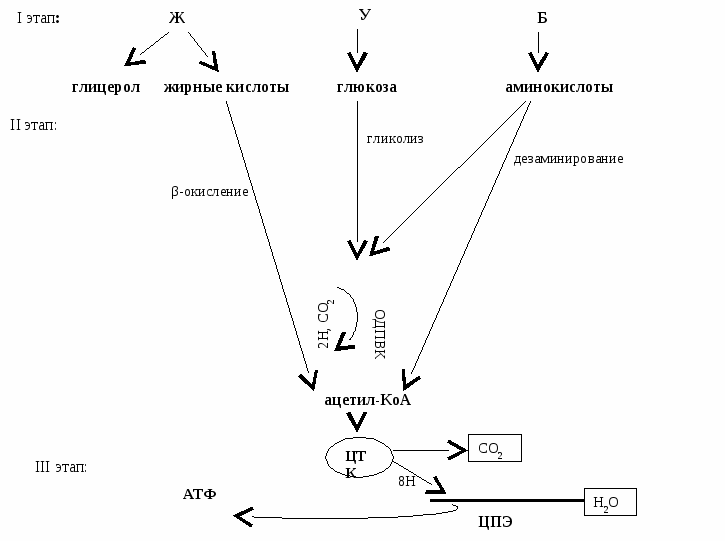
Специфический и общий пути катаболизма углеводов, жиров и белков. Общий путь катаболизма как основной источник дегидрируемых субстратов для ЦПЭ.
Пищевые вещества (Б,Ж,У) подвергаются расщеплению в организме в 3 стадии:
I и II стадии – специфические, III – общий путь катаболизма (ОПК), т.к. он одинаков для Б,Ж,У.
ПВК
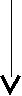
I стадия – специфическая – идет в ЖКТ.
Пищевые вещества расщепляются до мономеров (У,Б) или до составляющих частей (Ж).
Белки → аминокислоты
Углеводы → глюкоза (в основном)
Жиры → глицерол и жирные кислоты
II стадия – специфическая – протекает внутриклеточно (или в цитоплазме, или в митохондриях)
Заканчивается образованием двух продуктов: ПВК и ацетил-КоА
III стадия – ОПК в митохондриях
Включает 2 процесса:
Окислительное декарбоксилирование ПВК (ОДПВК) – ферментативное превращение ПВК в ацетил-КоА
ЦТК – общий конечный путь катаболизма Б, Ж, У
ОПК тесно связан с цепью переноса электронов (ЦПЭ).
В результате функционирования ЦПЭ сопряжено синтезируется АТФ путем ОФ.
Таким образом, все пищевые вещества расщепляются до СО2 и Н2О с выделение АТФ.
|
|
|
 Скачать 29.52 Mb.
Скачать 29.52 Mb. ТФ – производное нуклеотида, у которого в 5’-положении находятся 3 остатка фосфорной кислоты, две концевые связаны макроэргическими связями. При их расщеплении выделяется энергия.
ТФ – производное нуклеотида, у которого в 5’-положении находятся 3 остатка фосфорной кислоты, две концевые связаны макроэргическими связями. При их расщеплении выделяется энергия. 


 бразование малата из фумарата - Образование малата происходит при участии фермента фумаратгидратазы. Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только трансформы фумарата.
бразование малата из фумарата - Образование малата происходит при участии фермента фумаратгидратазы. Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только трансформы фумарата. 
 хема ПДК:
хема ПДК: результате ПДК приходит в исходное состояние.
результате ПДК приходит в исходное состояние. егидрогеназы окисляют субстрат путем отнятия водорода. Со-ферментная часть дегидрогеназ представлена пиридиновыми нуклеотидами (НАД). Пиридиновые дегидрогеназы являются анаэробными ферментами, они не способны к последующей передаче восстановительного эквивалента на кислород. К НАД-зависимым дегидрогеназам относят лактатдегидрогеназу, малатдегидрогеназу, изоцитратдегидрогеназу, к НАДФ-зависимым глюкозо-6-фосфатдегидрогеназу, 6-фосфоглюконатдегидрогеназу.
егидрогеназы окисляют субстрат путем отнятия водорода. Со-ферментная часть дегидрогеназ представлена пиридиновыми нуклеотидами (НАД). Пиридиновые дегидрогеназы являются анаэробными ферментами, они не способны к последующей передаче восстановительного эквивалента на кислород. К НАД-зависимым дегидрогеназам относят лактатдегидрогеназу, малатдегидрогеназу, изоцитратдегидрогеназу, к НАДФ-зависимым глюкозо-6-фосфатдегидрогеназу, 6-фосфоглюконатдегидрогеназу.

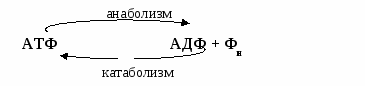 наболизм
наболизм

 оль передачи электронов в синтезе АТФ
оль передачи электронов в синтезе АТФ  егидрогеназы окисляют субстрат путем отнятия водорода. Со-ферментная часть дегидрогеназ представлена флавиновыми нуклеотидами (ФМН, ФАД).
егидрогеназы окисляют субстрат путем отнятия водорода. Со-ферментная часть дегидрогеназ представлена флавиновыми нуклеотидами (ФМН, ФАД).  АД-зависимые субстраты тканевого дыхания – сукцинат, глицерол-3-фосфат, ацил
АД-зависимые субстраты тканевого дыхания – сукцинат, глицерол-3-фосфат, ацил