Ответы к экзамену По биохимии 1 структура и функции белков 3 ферменты 10 нуклеиновые кислоты и нуклеотиды 21
 Скачать 29.52 Mb. Скачать 29.52 Mb.
|
|
Вопрос №161 Структурно-функциональная организация саркомера мышечной клетки. Белковый состав скелетной мышцы. Внутреннее пространство мышечного волокна заполнено внутриклеточной жидкостью – саркоплазмой. Около 80% объема волокна занимают длинные сократительные нити – миофибриллы. М 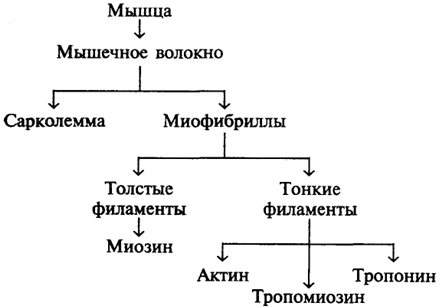 иофибриллы – это сократительные элементы мышечного волокна, количество которых может достигать нескольких тысяч. Под микроскопом миофибриллы имеют поперечную исчерченность в виде повторяющихся темных и светлых участков или дисков. Темные участки, или А-диски в центре имеют более светлую Н-зону, посредине которой проходит темная М-линия. Светлые участки, или I-диски в центре пересекаются узкой Z-линией (Z-мембраной). иофибриллы – это сократительные элементы мышечного волокна, количество которых может достигать нескольких тысяч. Под микроскопом миофибриллы имеют поперечную исчерченность в виде повторяющихся темных и светлых участков или дисков. Темные участки, или А-диски в центре имеют более светлую Н-зону, посредине которой проходит темная М-линия. Светлые участки, или I-диски в центре пересекаются узкой Z-линией (Z-мембраной). Участок миофибриллы между двумя Z-мембранами называется саркомером. Это наименьшая сократительная единица мышцы. В миофибрилле может находиться несколько сотен саркомеров. От их длины и количества в миофибрилле зависят скорость и сила сокращения мышцы. Исчерченность мышц, видимая под световым микроскопом, – результат высокой их организации, когда большинство мышечных клеток выстраивается таким образом, что их саркомеры располагаются параллельно друг другу. Исследования поперечных срезов миофибрилл под электронным микроскопом показали, что каждая мио-фибрилла состоит из многочисленных параллельных толстых и тонких мышечных нитей, или филаментов, которые придают мышцам продольную исчерченность. Толстые нити находятся в А-дисках и состоят из белка миозина. Тонкие нити находятся в I-дисках и содержат белки актин, тропомиозин и тропонин. Располагаются тонкие нити вокруг толстого (миозинового) филамента по углам шестигранника таким образом, что каждая тонкая нить занимает симметричное положение между тремя толстыми нитями, а каждая толстая нить симметрично окружена шестью тонкими нитями. Толстые и тонкие нити миофибрилл взаимодействуют между собой посредством поперечных мостиков, расположенных вдоль толстой миозиновой нити. Среди белков мышечной ткани выделяют три основные группы: саркоплазматические белки, на долю которых приходится около 35%, миофибриллярные белки, составляющие около 45%, и белки стромы, количество которых достигает 20%. Саркоплазматические белки растворимы в воде и слабых солевых растворах. Основную массу их составляют белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы окислительного фосфорилирования, а также многие ферменты гликолиза, азотистого и липидного обменов, находящиеся в саркоплазме. К этой группе относится также белок миоглобин, который связывает кислород с большим сродством, чем гемоглобин, и депонирует молекулярный кислород в мышцах. Миофибриллярные белки включают сократительные белки миозин, актин и актомиозин, а также регуляторные белки тропомиозин, тропонин, α- и β-актинины. Миофибриллярные белки обеспечивают сократительную функцию мышц. Миозин - 55%, актин - 25%, тропомиозин - 15%, тропонин - 5%. Вопрос №162 С 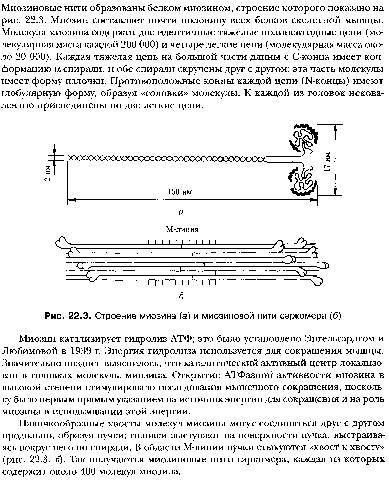  труктурно-функциональная организация актинового и миозинового миофиламентов. труктурно-функциональная организация актинового и миозинового миофиламентов.Вопрос №163 Теория скользящих нитей как модель механизма мышечного сокращения. Энергия сокращения. Во время сокращения (укорочения) саркомера длина тонкого и толстого филаментов не меняется. Поступление электрического импульса приводит к выделению значительного количества ионов Са2+ в саркоплазму. После этого ионы Са2+ связываются с тропонином, который начинает процесс сокращения, «поднимая» молекулы тропомиозина с активных участков актиновых филаментов. Миозин в покое неактивен, так как на его головке находится отрицательно заряженный комплекс Mg, ATФ, не позволяющий белку проявлять АТФ-азные свойства. После поступления ионов Са2+ происходит нейтрализация заряда на головке, что приводит миозин в возбужденное состояние. После этого миозиновые головки начинают прикрепляться к активным участкам актинового филамента. Когда миозиновая головка толстого филамента прикрепляется к тонкому филаменту, между толстым и тонким филаментами образуется поперечный мостик. При взаимодействии с актином каждая миозиновая молекула ежесекундно гидролизует до 10 молекул АТФ. За счет энергии, высвобождающейся при расщеплении АТФ, миозиновая головка поворачивается, что приводит к скольжению толстого и тонкого филаментов относительно друг друга. В конце гребка (поворота) к миозиновой головке присоединяется новая молекула АТФ, что приводит к отделению головки от актина и присоединению к новому активному участку тонкого филамента до тех пор, пока миозиновые головки не достигнут Z-диска. Так как при сокращении саркомера расстояние между Z-дисками уменьшается, происходит уменьшение его длины. Одновременное сокращение всех саркомеров приводит к уменьшению длины миофибриллы и мышечного волокна. Ввиду того, что саркомер представляет собой не плоскую, а объемную структуру, при его сокращении происходит не только уменьшение его длины, но и увеличение его поперечного сечения (когда тонкие нити втягиваются в толстые), поперечного сечения мышечных волокон и всей мышцы. Прекращение нервного импульса приводит к расщеплению ацетилхолина и разрыву поперечных мостиков между актином и миозином. Благодаря действию «кальциевого насоса» ионы Са2+ возвращаются в саркоплазматический ретикулум, актин и миозин инактивируются, длина саркомера возвращается к исходному значению. Мышца расслабляется. Мышечное сокращение может продолжаться до тех пор, пока не истощатся запасы ионов кальция. Затем они снова перекачиваются в саркоплазматический ретикулум посредством активной системы «кальциевого насоса». Следует отметить, что для осуществления этого процесса необходима энергия АТФ. Кроме участка для прикрепления к тонкому филаменту, миозиновая головка содержит участок, в котором локализуется АТФ. Освобождающая вследствие реакции гидролиза (расщепления АТФ) энергия используется для прикрепления миозиновой головки к тонкому филаменту, а после осуществления поворота головки – для отделения миозиновой головки от тонкого филамента. Источники энергии следующие. 1. Специальные реакции субстратного фосфорилирования. 2. Гликолиз, гликогенолиз. 3. Окислительное фосфорилирование. Вопрос №166 Биохимия межклеточного матрикса. Структура и функции, биосинтез коллагена. Типы коллагенов. Структура и функции эластина. Соединительные ткани - ткани, у которых мало клеток и много межклеточного вещества = межклеточного матрикса. Они составляют около 50% всех тканей. Клетки: фибробласты, остеобласты, хондробласты... Межклеточный матрикс (состоит из четырех компонентов):
Коллаген - основной белок соединительной ткани (КГБ - коллагеновый белок) Функция:
Функция:
Функция:
Функции межклеточного матрикса:
Коллаген - 30% от всех белков организма. Существует 19 типов коллагена в зависимости от тканей:
Коллагеновое волокно состоит из фибрилл. Фибрилла - из микрофибрилл. Микрофибрилла - из тропоколлагенов, которые соединены друг за другом на расстоянии 34 нм, а в соседних участках смещены на 1/4. Это придает коллагеновому волокну прочность на разрыв. Тропоколлаген состоит из трех ппц - α1 и α2 четырех типов. Каждая цепь закручена влево, а потом между собой закручена в правую суперспираль. Это придает нерастяжимость. С   ледовательно, тропоколлаген - структурная единица коллагенового волокна. ледовательно, тропоколлаген - структурная единица коллагенового волокна.Состав коллагенового волокна:
Биосинтез коллагена осуществляется в основном фибробластами. Проходит в 4 этапа:
1) Синтез препро-α-цепей 1. На рибосомах синтезируются препро-α-цепи. Одновременно происходит гидроксилирование пролина и лизина. Ферменты: пролин- и лизингидроксилаза. Участвует Fе2+ и витамин С. При недостатке витамина С нарушается первый этап синтеза коллагена и, следовательно, нарушается структура соединительной ткани. 2. При помощи сигнального пептида (который отщепляется при этом) про-α-цепи попадают в эндоплазматический ретикулум. 2) Внутриклеточные модификации 3. Под действием ферментов гликозилтрансфераз к некоторым остаткам гидроксилизина присоединяются остатки глюкозы и глюкозы+галактозы. При сахарном диабете, когда глюкоза не поступает в инсулинзависимые ткани, гликозилирование нарушается и, следовательно, нарушается синтез коллагена. 4. Под действием N-концевого пептида формируется тройная суперспираль протропоколлагена. При этом между гидроксилизинами образуются водородные связи, которые ее стабилизируют. 5. Протропоколлаген поступает в аппарат Гольджи, где упаковывается в секреторные гранулы. 3) Секреция 6. В межклеточном матриксе отщепляются N- и С-концевые пептиды. Образуется тропоколлаген. 4) Внеклеточные модификации 7. Под действием лизилоксидазы (витамин В6, Сu2+) между лизинами тропоколлагена соседних участков образуются прочные связи. Образовалась микрофибрилла → фибрилла → коллагеновое волокно. 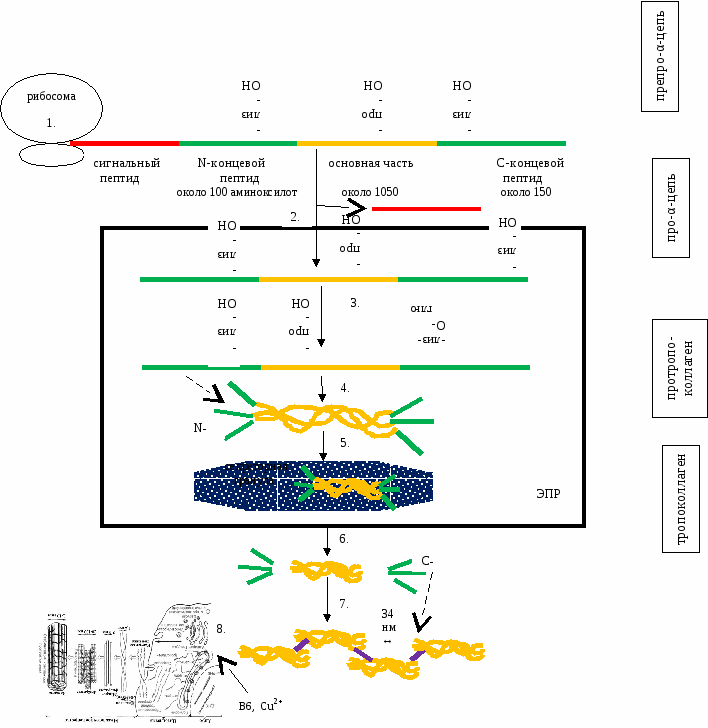 Синтез коллагена повышается при заживлении ран, понижается с возрастом. Нарушение синтеза коллагена может быть связано с различными причинами (чаще генетическими) - коллагенозы. Разрушение коллагена Время полужизни - несколько недель. Разрушается при помощи коллагеназ. Они используют Zn2+ и, следовательно, являются матриксными металлопротеазами (ММП). Они расщепляют тройную спираль. Эластин - белок соединительной ткани, который придает ей растяжимость. Период жизни - 75 лет. Функция:
Эластин - основной структурный компонент волокон, которые содержатся в тканях, обладающих значительной эластичностью (кровеносные сосуды, связки, легкие). Содержит около 800 аминокислотных остатков, из них примерно 70% - гидрофобные с небольшими радикалами (глицин, валин, аланин, лейцин, пролин); гидроксипролина мало; гидроксилизина нет. Также отсутствует цистеин, метионин, триптофан. В состав эластина входит лейциннорлейцин (образован двумя остатками лейцина) и десмозин (4 остатка лейцина). Эти структуры связывают молекулы между собой. Вопрос №167. Неколлагеновые структурные гликопротеины. Химическая природа и особенности строения фибронектина. Его роль в обеспечении межклеточного взаимодействия. Неколлагеновые белки гликопротеиновой природы (НКБ)  Фибронектин - состоит из 2 ппц, соединенных фисульфидными связями. Каждая цепь состоит из 7-8 участков (домены). В каждом домене находится фермент трансглутаминаза, при помощи которой фибронектин связывает компоненты межклеточного матрикса. Фибронектин - состоит из 2 ппц, соединенных фисульфидными связями. Каждая цепь состоит из 7-8 участков (домены). В каждом домене находится фермент трансглутаминаза, при помощи которой фибронектин связывает компоненты межклеточного матрикса.Интегрин - состоит из 2 ппц (α и β), которые пронизывают мембрану клетки 1 раз. Выполняют рецепторную функцию, передают информацию от межклеточного матрикса в клетки. Следовательно, выполняют адгезивную функцию, т.к. соединяют клетку с компонентами межклеточного матрикса. Вопрос №169 Протеогликаны - основа межклеточного матрикса. Гликозаминогликаны: структура, функции. 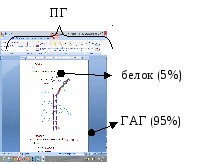 ПГ - основное вещество межклеточного матрикса, которое состоит из 5% белков и 95% углеводов. ПГ - основное вещество межклеточного матрикса, которое состоит из 5% белков и 95% углеводов.Углеводная часть = ГАГ = гетерополисахарид = мукополисахарид. Функция:
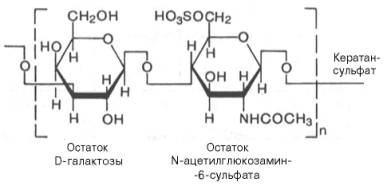
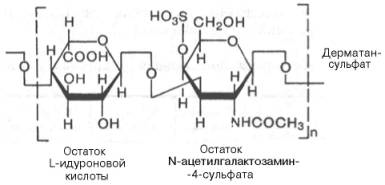
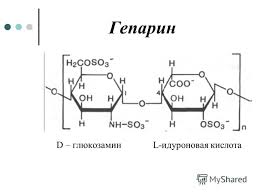
Биосинтез протеогликанов ПГ синтезируются на рибосомах ЭПР. Сначала синтезируется белковая часть, и к ней по ОН-группе серина сначала присоединяется линкерный участок (инициирующий, затравка), который состоит из ксилозы-галактозы-галактозы. К нему присоединяются по очереди моносахара (доноры моносахаридов - УДФ-производные (глюкоза_УДФ-глюкуронат)). Одновременно происходит сульфатирование углеводов (присоединение серной кислоты). По окончанию сульфатирования синтез прекращается. Синтезированные ГАГ поступают в аппарат Гольджи, где упаковываются в секреторные гранулы и поступают в межклеточный матрикс. ГАГ делятся на 5 групп:
Линейный полисахарид, повторяется последовательность глюкуроновой кислоты с N-ацетилгликозамином. 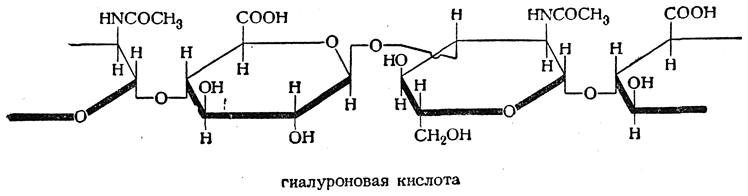
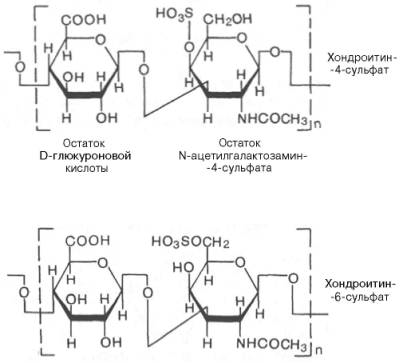 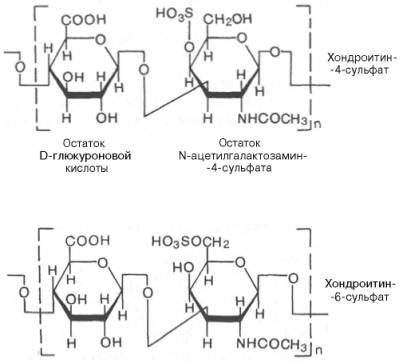
 |

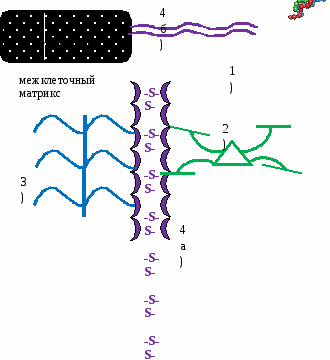 оллагеновые волокна
оллагеновые волокна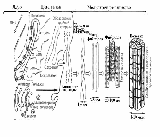
 идроксилизин - участвует в образовании прочной ковалентной связи между отдельными тропоколлагенами → дополнительная прочность и нерастяжимость.
идроксилизин - участвует в образовании прочной ковалентной связи между отдельными тропоколлагенами → дополнительная прочность и нерастяжимость.