Ответы к экзамену По биохимии 1 структура и функции белков 3 ферменты 10 нуклеиновые кислоты и нуклеотиды 21
 Скачать 29.52 Mb. Скачать 29.52 Mb.
|
НУКЛЕИНОВЫЕ КИСЛОТЫ И НУКЛЕОТИДЫВопрос №29 Биохимия пуриновых и пиримидиновых нуклеотидов: нумерация атомов в азотистых основаниях, связь в нуклеотиде, цис- и антиконформеры. Циклические нуклеотиды. Распределение в клетке и биологическая функция. Нуклеиновая кислота — биополимер, образованный остатками нуклеотидов. Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу) и остаток фосфорной кислоты. В зависимости от числа имеющихся в молекуле остатков фосфорной кислоты различают нуклеозидмонофосфаты (НМФ), нуклеозиддифосфаты (НДФ), нуклео-зидтрифосфаты (НТФ). В 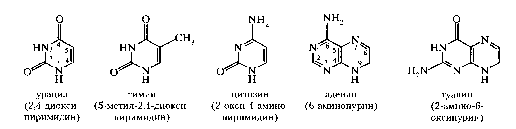 состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). П 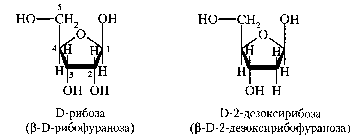 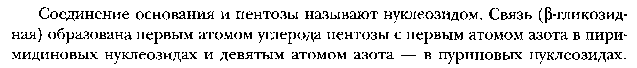 ентозы в нуклеотидах представлены либо рибозой (в составе РНК), либо дезоксирибозой (в составе ДНК). Чтобы отличить номера атомов в пентозах от нумерации атомов в основаниях, запись производят с внешней стороны цикла и к цифре добавляют штрих (') - 1', 2', 3', 4' и 5'. ентозы в нуклеотидах представлены либо рибозой (в составе РНК), либо дезоксирибозой (в составе ДНК). Чтобы отличить номера атомов в пентозах от нумерации атомов в основаниях, запись производят с внешней стороны цикла и к цифре добавляют штрих (') - 1', 2', 3', 4' и 5'.Г 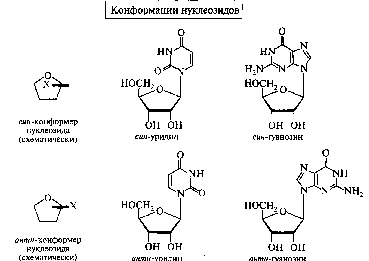 етероциклическое основание может вращаться вокруг гликозидной связи. Поскольку это вращение заторможено, имеют значение наиболее устойчивые конформации - син- и анти-конформеры. Они различаются положением атома кислорода оксогруппы пиримидинового основания или атома N-3 пуринового цикла относительно пентозного цикла: в син-коформере он повернут "внутрь" пентозного цикла, в анти - наружу. етероциклическое основание может вращаться вокруг гликозидной связи. Поскольку это вращение заторможено, имеют значение наиболее устойчивые конформации - син- и анти-конформеры. Они различаются положением атома кислорода оксогруппы пиримидинового основания или атома N-3 пуринового цикла относительно пентозного цикла: в син-коформере он повернут "внутрь" пентозного цикла, в анти - наружу. В кристаллическом состоянии нуклеозиды имеют антиконформацию, в растворе: пиримидиновые - анти, пуриновые - анти и син. В макромолекулах ДНК и РНК нуклеозиды находятся в анти. 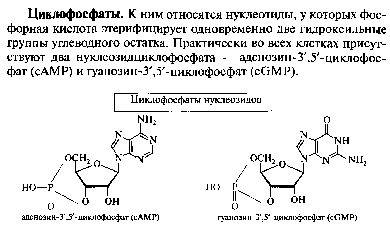 Биологическая роль нуклеиновых кислот 1. ДНК: хранение генетической информации. 2. У РНК функции более многообразны: а) хранение генетической информации (информосомы, некоторые РНК-вирусы; б) реализация генетической информации: и-РНК (м-РНК) - информационная (матричная), т-РНК (транспортная), р-РНК (рибосомальная). Все они обслуживают процесс синтеза белка. в) каталитическая функция: некоторые молекулы РНК способны катализировать реакции гидролиза 3’,5’-фосфодиэфирной связи в самой молекуле РНК. Показано, что некоторые молекулы РНК способны одним своим участком катализировать гидролиз фосфодиэфирных связей другого участка своей молекулы. Такое явление обозначается термином «самосплайсинг". ФУНКЦИИ МОНОНУКЛЕОТИДОВ. 1. Структурная - Из мононуклеотидов построены нуклеиновые кислоты, некоторые коферменты и простетические группы ферментов. 2. Энергетическая - Мононуклеотиды удерживают макроэргические связи - являются аккумуляторами энергии. АТФ - это универсальный аккумулятор энергии, энергия УТФ используется для синтеза гликогена, ЦТФ - для синтеза липидов, ГТФ - для движения рибосом в ходе трансляции (биосинтез белка) и передачи гормонального сигнала (G-белок). 3. Регуляторная - Мононуклеотиды - аллостерические эффекторы многих ключевых ферментов, цАМФ и цГМФ являются посредниками в передаче гормонального сигнала при действии многих гормонов на клетку (аденилатциклазная система), они активируют протеинкиназы. Азотистое основание аденин является более универсальным, чем остальные: у него такое взаимное расположение аминогруппы с фосфатом, что возможен синтез АТФ из АДФ и неферментативным путем. 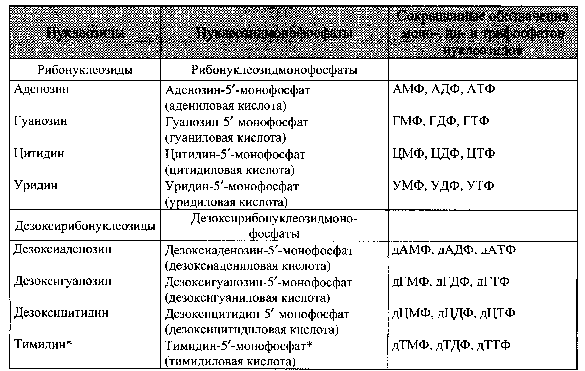 Вопрос №30 Расщепление нуклеиновых кислот в пищеварительном тракте. Пищевые нуклеопротеины, попадая в организм человека, в желудке отщепляют белковый компонент и денатурируют под действием НС1 желудочного сока. Далее полинуклеотидная часть этих молекул гидролизуется в кишечнике до мононуклеотидов. В расщеплении нуклеиновых кислот принимают участие ДНК-азы и РНК-азы панкреатического сока, которые, будучи эндонуклеазами, гидролизуют макромолекулы до олигонуклеотидов. Последние под действием фосфодиэстераз панкреатической железы расщепляются до смеси 3'- и 5'-мононуклеотидов. Нуклеотидазы и неспецифические фосфатазы гидролитически отщепляют фосфатный остаток нуклеотидов и превращают их в нуклеозиды, которые либо всасываются клетками тонкого кишечника, либо расщепляются нуклеозидфосфорилазами кишечника с образованием рибозо- или дезоксирибозо-1-фосфата, пуриновых и пиримидиновых оснований. Пищевые пурины и пиримидины не являются незаменимыми пищевыми факторами и очень мало используются для синтеза нуклеиновых кислот тканей. В энтероцитах обнаружена высокая активность ксантиноксидазы - фермента, который большую часть пуринов, поступающих в клетки, превращает в мочевую кислоту, удаляющуюся с мочой. Пиримидиновые основания, не успевшие поступить в энтероциты, под действием микрофлоры кишечника расщепляются до NH3, CO2, β-аланина и β-аминоизобутирата. В различных клетках организма синтезируется до 90% пуриновых и пиримидиновых нуклеотидов из простых предшественников de novo. Введённые в кровь азотистые основания и нуклеозиды, а также основания и нуклеозиды, образующиеся в результате внутриклеточного разрушения нуклеиновых кислот, в небольшом количестве могут использоваться для повторного синтеза нуклеотидов по так называемым "запасным" путям. 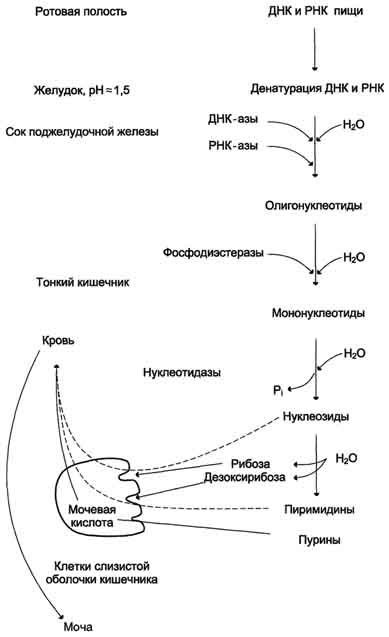 Вопрос №31 Биологически важные производные моно-, динуклеотидов. Их связь с витаминами. АТФ- аденозинтрифосфорная кислота - основной внутриклеточный переносчик свободной энергии. По структуре - это аденозин с тремя остатками фосфорной кислоты в пятом положении пентозы. В АТФ очень легко разрушаются связи между остатками фосфорной кислоты с выделением большого количества энергии - макроэргические связи. Кроме АТФ переносчиками энергии являются:
Производные урациловых участвуют в качестве коферментов в различных реакциях метаболизма гексоз и синтезе гликогена, например, уридиндифосфатлюкоза - предшественник в синтезе гликогена, УТФ используется в реакциях превращения галактозы в глюкозу. Некоторые нуклеозиды 5 - фосфаты выполняют роль переносчиков молекул, например, КоА является производным нуклеотида, переносит ацильные группы и ацетильные радикалы, содержит витамин - пантотеновую кислоту. К динуклеотидам относятся НАД, НАДФ, ФАД и др. НАД – никотинамидадениндинуклеотид; НАДФ – никотинамидадениндинуклеотид фосфат. В состав этих динуклеотидов входит никотинамид (амид никотиновой кислоты, являющееся важным витамином — витамином В5). Молекула НАДФ идентична по структуре НАД с той лишь разницей, что у НАДФ у С-3 атома рибозы ОН-группа замещена остатком молекулы фосфорной кислоты. Молекулы НАД и НФДФ способны к обратимому окислению и восстановлению (благодаря окислительно-восстановительной способности никотинамида), поэтому они участвуют в качестве переносчиков водорода; в реакциях биологического окисления НАД и НАДФ являются кофакторами ферментов дегидрогеназ. ФАД, как и другие динуклеотиды, способен обратимо окисляться и восстанавливаться, присоединяя к своей молекуле 2 атома водорода, поэтому он участвует в биологическом окислении в качестве переносчика водорода. Является кофактором дегидрогеназ, так же, как и НАД и НАДФ. Вопрос №32 Нуклеиновые кислоты: ДНК, РНК, первичная и вторичная структуры. Видовая специфичность нуклеиновых кислот. Первичная структура ДНК - порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинукпеотидной цепи. Каждая фосфатная группа в полинукпеотидной цепи, за исключением фосфорного остатка на 5'-конце молекулы, участвует в образовании двух эфирных связей с участием 3'- и 5'-углеродных атомов двух соседних дезоксирибоз, поэтому связь между мономерами обозначают 3', 5'-фосфодиэфирной. Концевые нуклеотиды ДНК различают по структуре: на 5'-конце находится фосфатная группа, а на 3'-конце цепи - свободная ОН-группа. Эти концы называют 5'- и 3'-концами. В каждом мономере нуклеиновой кислоты присутствует остаток фосфорной кислоты. При рН 7 фосфатная группа полностью ионизирована, поэтому in vivo нуклеиновые кислоты существуют в виде полианионов (имеют множественный отрицательный заряд). Остатки пентоз тоже проявляют гидрофильные свойства. Азотистые основания почти нерастворимы в воде, но некоторые атомы пуринового и пиримидинового циклов способны образовывать водородные связи. Вторичная структура ДНК. В 1953 г. Дж. Уотсоном и Ф. Криком была предложена модель пространственной структуры ДНК. Согласно этой модели, молекула ДНК имеет форму спирали, образованную двумя полинуклеотидными цепями, закрученными относительно друг друга и вокруг общей оси. Двойная спираль правозакрученная, полинуклеотидные цепи в ней антипараллельны, т.е. если одна из них ориентирована в направлении 3'→5', то вторая - в направлении 5'→3'. Поэтому на каждом из концов молекулы ДНК расположены 5'-конец одной цепи и 3'-конец другой цепи. 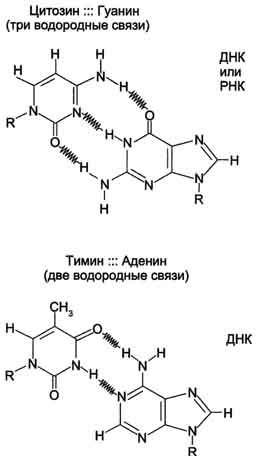 Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов - снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счёт водородных связей между комплементарными пуриновыми и пиримидиновыми азотистыми основаниями А и Т (две связи) и между G и С (три связи). При таком сочетании каждая пара содержит по три кольца, поэтому общий размер этих пар оснований одинаков по всей длине молекулы. Водородные связи при других сочетаниях оснований в паре возможны, но они значительно слабее. Последовательность нуклеотидов одной цепи полностью комплементарна последовательности нуклеотидов второй цепи. Поэтому, согласно правилу Чаргаффа (Эрвин Чаргафф в 1951 г. установил закономерности в соотношении пуриновых и пиримидиновых оснований в молекуле ДНК), число пуриновых оснований (А + G) равно числу пиримидиновых оснований (Т + С). Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов - снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счёт водородных связей между комплементарными пуриновыми и пиримидиновыми азотистыми основаниями А и Т (две связи) и между G и С (три связи). При таком сочетании каждая пара содержит по три кольца, поэтому общий размер этих пар оснований одинаков по всей длине молекулы. Водородные связи при других сочетаниях оснований в паре возможны, но они значительно слабее. Последовательность нуклеотидов одной цепи полностью комплементарна последовательности нуклеотидов второй цепи. Поэтому, согласно правилу Чаргаффа (Эрвин Чаргафф в 1951 г. установил закономерности в соотношении пуриновых и пиримидиновых оснований в молекуле ДНК), число пуриновых оснований (А + G) равно числу пиримидиновых оснований (Т + С). Комплементарые основания уложены в стопку в сердцевине спирали. Между основаниями двухцепочечной молекулы в стопке возникают гидрофобные взаимодействия, стабилизирующие двойную спираль. Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной цепи. В РНК, как и в ДНК, нуклеотиды связаны между собой 3',5'-фосфодиэфирными связями. Концы полинуклеотидных цепей РНК неодинаковы. На одном конце находится фосфорилированная ОН-группа 5'-углеродного атома, на другом конце - ОН-группа 3'-углеродного атома рибозы, поэтому концы называют 5'- и 3'-концами цепи РНК. Гидроксильная группа у 2'-углеродного атома рибозы делает молекулу РНК нестабильной. Так, в слабощелочной среде молекулы РНК гидролизуются даже при нормальной температуре, тогда как структура цепи ДНК не изменяется. Вторичная структура РНК. Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписывающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК. рРНК - 80%, тРНК - 15%, иРНК - 2%. Специфичность нуклеиновых кислот определяется не только их нуклеотидным составом, но и последовательностью отдельных нуклеотидов в цепи нуклеиновых кислот . Функции тРНК: Перенос аминокислот к месту синтеза белка; Адаптерная – помогает переводить информацию из последовательности нуклеотидов в последовательность аминокислот. Имеет вторичную структуру в виде клеверного листа, несколько петель (между азотистыми основаниями водородной связи). На 3’ – конце последовательность ЦЦА – сюда присоединяется аминокислота. Антикодоновая петля – для присоединения с кодоном (3нуклеотида) на мРНК. Псевдоуридиловая петля (ψу) -для присоединения тРНК в А-участке рибосоме. Дигидроуридиловая петля – связывается со специфическим ферментом (аминоацил-тРНК-синтетаза) при активации аминокислоты. Вопрос №33 Биосинтез ДНК. Механизм воспроизведения (репликация).
Стадии: 1)Образование репликативной вилки, 2) Синтез дочерних цепей ДНК, 3)Удаление праймеров Основной механизм – полуконсервативный, т.е. двойная спираль раскручивается, цепи расходятся и каждая затем достраивается до двуцепочечной по принципу комплементарности. Каждая новая двуцепочечная молекула ДНК = 1 цепь старой + 1 цепь дочерней ДНК. 1. Образование репликативной вилки: Топоизомеразы I (II) находят на двуцепочечной молекуле ДНК определенную последовательность – точку начала репликации. Затем разрывают или одну цепь (топоизомераза I), или обе (топоизомераза II) и встраиваются в них. Происходит разрыв двуцепочечной молекулы с образованием репликативного «глаза» = участок инициации репликации = original. Т.к. молекула ДНК содержит около 150∙106 пар нуклеотидов, а репликация идет со скоростью 50 нуклеотидов/мин, то репликация занимала был 800 часов, а она идет 9. Следовательно, на молекуле ДНК несколько участков начала репликации, и репликация идет в двух направлениях. В репликативном глазе можно выделить 2 репликативные вилки. Специфический фермент ДНК-геликаза (активность зависит от АТФ) встраивается между цепями и разъединяет их. Вдоль цепи расположены ДНК-раскручивающие белки = ДНК-дестабилизирующие белки = SSB-белки, которые не позволяют цепям ДНК образовать двуцепочную структуру, удерживают их в раскрученном виде, облегчают репликацию. 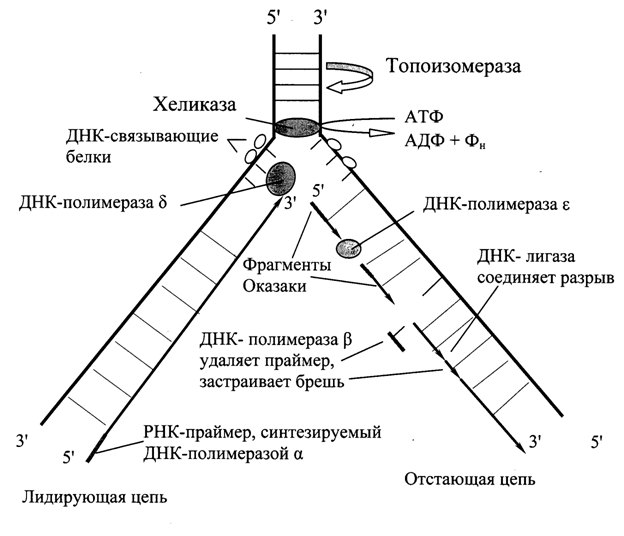 2.Синтез дочерних цепей. ДНК-полимеразы:
Следовательно, для синтеза дочерних цепей необходима «затравка» = праймер. Праймер строится из нуклеотидов, принадлежащих РНК (чтобы отличить его от дочерних цепей). Для этого используется фермент РНК-праймаза. После этого ДНК-полимераза-δ синтезирует дочернюю цепь быстро и непрерывно, т.к. направление синтеза совпадает с направлением репликации. Вторая дочерняя цепь синтезируется медленнее и фрагментами (фрагменты Оказаки), т.к. по принципу антипараллельности ДНК-полимераза достраивала бы в направлении 3’→ 5’, чего не может быть. Если бы мы строили в нужном направлении, то синтез дочерних цепей не совпадал бы с общим направлением репликации. Поэтому отстающая цепь синтезируется фрагментами. Для этого на материнской цепи строится несколько РНК-праймеров (около 200 нуклеотидов). ДНК-полимераза-ε узнает 3’-конец праймера и достраивает его в нужном 5’→3’ направлении до предыдущего праймера. Далее ДНК- полимераза-ε двигается в направлении репликации и находит 3’-конец следующего праймера и достраивает его (фрагменты Оказаки). И так далее. РНК-аза (эндонуклеаза) вырезает праймеры. ДНК-полимераза-β достраивает недостающие участки. Одноцепочечные разрывы соединяют ДНК-лигазы. Пострепликативные модификации ДНК: После синтеза ДНК материнская цепь отличается от дочерней, т.к. в ней есть метилированный аденин в последовательности Г-А-Т-Ц. Это позволяет ферментам системы репарации исправлять ошибки, которые могут возникнуть в дочерних цепях. После этого и дочерняя цепь метилируется по аденину в последовательности Г-А-Т-Ц. Вопрос №34 Репарация ошибок репликации и повреждений ДНК (на примемре восстановления дезаминированного цитозина). Процесс, позволяющий живым организмам восстанавливать повреждения, возникающие в ДНК, называют репарацией. Все репарационные механизмы основаны на том, что ДНК - двухцепочечная молекула, т.е. в клетке есть 2 копии генетической информации. Если нуклеотидная последовательность одной из двух цепей оказывается повреждённой (изменённой), информацию можно восстановить, так как вторая (комплементарная) цепь сохранена. Процесс репарации происходит в несколько этапов. На первом этапе выявляется нарушение комплементарности цепей ДНК. В ходе второго этапа некомплементарный нуклеотид или только основание устраняется, на третьем и четвёртом этапах идёт восстановление целостности цепи по принципу комплементарности. Однако в зависимости от типа повреждения количество этапов и ферментов, участвующих в его устранении, может быть разным. Нарушения комплементарности цепей ДНК могут происходить спонтанно, т.е. без участия каких-либо повреждающих факторов, например в результате ошибок репликации, дезаминирования нуклеотидов, депуринизации. Р 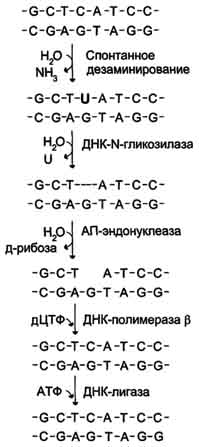 еакции дезаминирования цитозина и превращение его в урацил, аденина в гипоксантин, гуанина в ксантин происходят значительно реже, чем депуринизация, и составляют 10 реакций на один геном в сутки. еакции дезаминирования цитозина и превращение его в урацил, аденина в гипоксантин, гуанина в ксантин происходят значительно реже, чем депуринизация, и составляют 10 реакций на один геном в сутки. Исправление этого вида спонтанного повреждения происходит в 5 этапов. В репарации принимает участие ДНК-N-гликозилаза, гидролизующая связи между аномальным основанием и дезоксирибозой (первый этап), в результате образуется АП-сайт, который распознаёт фермент АП-эндонуклеаза (второй этап). Как только в цепи ДНК возникает разрыв, в работу вступает ещё один фермент - АП-экзонуклеаза, который отщепляет от цепи дезоксирибозу, лишённую основания (третий этап). В цепи ДНК появляется брешь размером в один нуклеотид. Следующий фермент ДНК-полимераза р к З'-концу разорванной цепи присоединяет нуклеотид по принципу комплементарности (четвёртый этап). Чтобы соединить два свободных конца (3'-конец встроенного нуклеотида и 5'-конец основной цепи), требуется ещё один фермент - ДНК-лигаза (пятый этап). Вопрос №35 Транскрипция и трансляция как механизмы перевода генотипической информации в фенотипические признаки. Основные компоненты белоксинтезирующей системы, этапы трансляции. ТРАНСКРИПЦИЯ
Биосинтез мРНК Этапы: 1) Инициация, 2) Элонгация, 3) Терминация Механизм – одна цепь ДНК - матричная цепь, а вторая – кодирующая, которая перписывается в комплементарную ей последовательность нуклеотидов РНК. 1.Инициация: На матрице существуют участки – транскриптоны:В начале – промотор (Pro), В конце - сайт терминации. В области промотора – гормон-чувствительные участки, которые могут стимулировать транскрипцию (энхансеры) или подавлять ее (сайленсеры).  1 – к Pro присоединяются белковые факторы – ТАТА  2 – это облегчает присоединение к Pro РНК-полимеразы II. РНК-полимеразы II – большие олигомерные белки, которые состоят из 2α, β, β’ и δ субъединиц (δ – регуляторная субъединица). Под действием факторов инициации происходит раскручивание участка одного витка спирали впереди РНК-полимеразы  3 – от РНК-полимеразы II отделяется δ-субъединица и на ее место присоединяется факторы элонгации. 2  .Элонгация: РНК-полимераза II продвигается по цепи ДНК, достраивая комплементарную ей цепь РНК, которая спаривается с ней на протяжении 8-10 нуклеотидов. .Элонгация: РНК-полимераза II продвигается по цепи ДНК, достраивая комплементарную ей цепь РНК, которая спаривается с ней на протяжении 8-10 нуклеотидов.3а – после синтеза примерно 30 нуклеотидов РНК происходит кэпирование5’-конца – присоединение к 5’-концу пре-мРНК метилированного ГТФ (связь 5’– 5’). 4 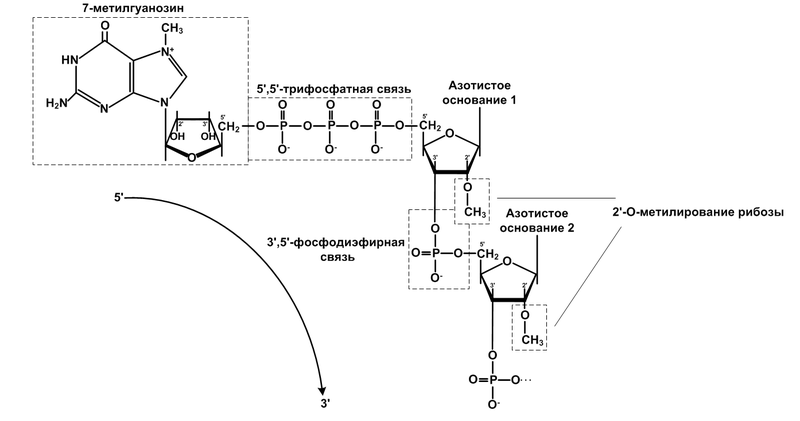 – когда РНК-полимераза достигает сайта терминации, факторы терминации отщепляют ее от матрицы. – когда РНК-полимераза достигает сайта терминации, факторы терминации отщепляют ее от матрицы.Синтезированная пре-мРнК подвергается процессингу(нет у пре-тРНК и пре-рРНК). Функции кэпа: Инициирование биосинтеза белков, Полиаденилирование - после синтеза пре-мРНК на 3’-конце образуется множество последовательностей –А-А-А- (поли-А). Функции поли-А: Облегчает выход РНК в цитоплазму, Защищает от гидролиза ферментами. После этого – сплайсинг – вырезание некодирующих участков – интронов, сшивание экзонов. Это осуществляют ферменты мя-РНП (малые ядерные нуклеопроетины), в составе которых есть мя-РНК. На ингибировании репликации и транскрипции основаны противоопухолевые препараты (токсин бледной поганки α-амоннитин ингибирует РНК-полимеразы). ТРАНСЛЯЦИЯ
Следовательно, должна существовать адаптерная молекула, которой является тРНК. Этапы: 1) Инициация, 2) Элонгация – синтез ппц, 3) Терминация -конец синтеза Механизм – в результате трансляции генетическая информация на матричной РНК переводится = транслируется в последовательность аминокислот в белке. Прежде чем аминокислоты будут включены в синтез, они должны быть активированы. А 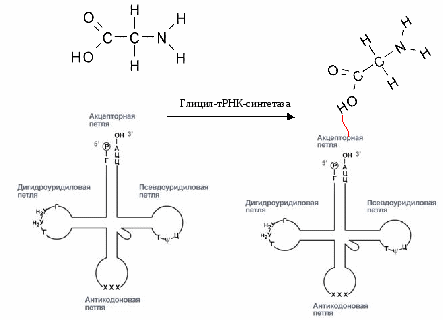 ктивация аминокислоты – присоединение аминокислоты к 3’-ОН концу тРНК макроэргической связью. ктивация аминокислоты – присоединение аминокислоты к 3’-ОН концу тРНК макроэргической связью.Процесс идет с затратой АТФ (2 макроэргических связи). Для каждой аминокислоты - своя тРНК (согласно таблице кодов). Присоединение катализируется специфичным ферментом – аминоацил-тРНК-синтетаза. Например, активация глицина: тРНК связывается со специфичным ферментом - гицилтранфераза- дигидроуридиловой петлей. Фермент, используя АТФ, переносит аминокислоту на тРНК (α-карбоксильная группа аминокислоты соединяется с 3’-ОН группой тРНК макроэргической связью). Образуется активированная аминокислота – глицил-тРНК (в общем случае – аминоацил-тРНК). 1.Инициация: Сборка белоксинтезирующего аппарата. В  цитоплазме в свободном виде находятся: цитоплазме в свободном виде находятся:
М 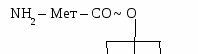 етионил-тРНК – инициирующая аминоацил-тРНК, т.к. с нее всегда начинается синтез белков у эукариот. етионил-тРНК – инициирующая аминоацил-тРНК, т.к. с нее всегда начинается синтез белков у эукариот.
А 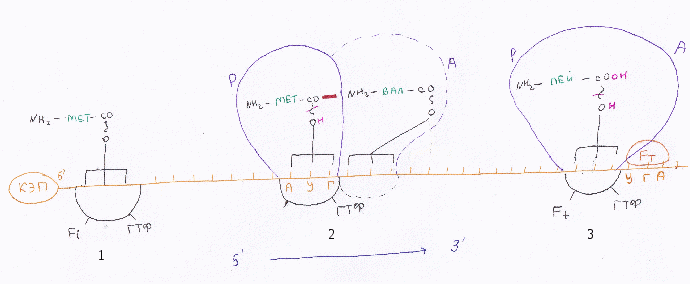 ) К малой субъединице рибосомы присоединяется инициирующая аминоацил-тРНК (метионил-тРНК), факторы инициации и ГТФ. ) К малой субъединице рибосомы присоединяется инициирующая аминоацил-тРНК (метионил-тРНК), факторы инициации и ГТФ.Б) Этот комплекс при использовании фактора инициации-«кэп-узнающего» - находит 5’-конец мРНК (где находится кэп) и присоединяется к нему. В) Комплекс передвигается по мРНК от 5’ к 3’ (затрачивается 1 АТФ), пока не достигнет стартового кодона. Важно: кодирует метионин, с него всегда начинается биосинтез – АУГ на мРНК. Г) При достижении комплексом АУГ от него отщепляются факторы инициации, гидролизируется ГТФ, присоединяется большая субъединица. В рибосоме формируется Р-участок (для инициирующей аминоацил-тРНК) и А-участок. 2.Элонгация– синтез ппц (циклический)
1 – в свободный А-участок присоединяется следующая аминоацил-тРНК согласно кодону мРНК. Затрачивается 1 ГТФ, принимают участие факторы элонгации. 2 – происходит разрыв макроэргических связей между аминокислотой и тРНК в Р-участке; при участии фермента пептидилтрансфераза (28S рРНК большой субъединицы рибосомы) остаток аминокислоты из Р-участка соединяется пептидной СО-концом с аминогруппой аминокислоты из А-участка. 3 – под действие фактора элонгации-2 и ГТФ рибосома перемещается на один кодон 5’→3’. При этом:
И все сначала. Это продолжается, пока рибосома не встретит один из терминирующих или стоп-кодонов (УАА, УАГ, УГА) терминацияне наступит. К терминирующему кодону присоединяется фактор терминации, разрываются макроэргические связи между тРНК и синтезированной ппц. Фермент пептидилтрансфераза присоединяет к свободному СО-концу воду. Так ппц освобождается из рибосомы, которая распадается. Посттрансляционные модификации
Вопрос №36 Образование пептидной связи в процессе трансляции. Энергетические затраты. На включение одной аминокислоты в растущую полипептидную цепь клетка затрачивает 4 макроэргические связи: 2 из АТФ в ходе реакции, катализируемой аа-тРНК синтетазой (в процессе активации аминокислот АТФ расщепляется на АМФ и пирофосфат), и 2 молекулы ГТФ: одна используется на связывание аа-тРНК в А-центре рибосомы, а вторая затрачивается на стадию транслокации. К этому следует добавить использование ещё двух мак-роэргических связей молекул: АТФ и ГТФ на инициацию и терминацию синтеза полипептидной цепи. Вопрос №37 Ингибиторы матричных биосинтезов: лекарственные препараты и бактериальные токсины. На ингибировании синтеза ДНК основано действие противоопухолевых препаратов. На ингибировании синтеза РНК и белков – антибиотиков, токсинов, вирусов.
Вирусы и токсины действуют на живые клетки.
Вирусы внедряются в клетки хозяина, включаются в ДНК и прекращают синтез ДНК, всех РНК и белков в клетке человека. В ответ выделяются интерфероны, которые стимулируют синтез РНК-аз (разрушают мРНК вирусов) и протеинкеназ (II класс ферментов), которые фосфорилируют фактор элонгации-2 вируса и инактивируют его. |
