Ответы к госэкзамену по терапии для терапевтов 2008. Ответы к государственному экзамену по внутренним болезням
 Скачать 4.53 Mb. Скачать 4.53 Mb.
|
|
ж) эндокринная дисфункция - гипогонадизм и импотенция у мужчин, нарушение менструального цикла у женщин з) анемический синдром (дефицит эритропоэтина) и) синдром поражения ЦНС - больные угнетены, характерна частая смена настроения, могут быть подергивания, иногда болезненные судороги икроножных мышц; со временем усиливается слабость, сонливость, утомляемость, апатия (уремическая энцефалопатия); в терминальной стадии - тяжелые полинейропатии с болевым и дистрофическим синдромами, судорожные подергивания, энцефалопатия вплоть до развития уремической комы с большим шумным ацидотическим дыханием (дыхание Куссмауля); иногда развивается тяжелая миопатия. Диагностика ХПН: 1. Лабораторные данные: а) ОАМ: в начальных стадиях характерна полиурия, никтурия, в терминальной – олигурия (вплоть до анурии); ранний симптом ХПН – снижение относительной плотности мочи до 1004-1011 б) Проба Реберга-Тареева: прогрессивное снижение СКФ (в среднем колебания СКФ по клиренсу эндогенного креатинина в норме 80-120 мл/мин при расчете на стандартную площадь тела – 1,73 м2; клинически определяют концентрацию креатинина в сыворотке и в моче, собранной за сутки, вычисляют минутный диурез, разделив общее количество мочи за сутки в мл на 1440 минут, и считают СКФ по формуле: СКФ = [креатинин мочи (ммоль/л) * минутный диурез (мл/мин)] / креатинин крови (ммоль/л). Во избежание погрешностей, возникающих при сборе мочи, можно пользоваться формулой Cockroft-Gault: для мужчин: СКФ = [1,23 * (140-возраст) * вес (кг)] / креатинин крови (мкмоль/л), для женщин: СКФ = [1,05 * (140-возраст) * вес (кг)] / креатинин крови (мкмоль/л). в) ОАК: постепенно нарастающая анемия; токсический лейкоцитоз со сдвигом влево; снижение числа тромбоцитов и их способности к агрегации; ускоренная СОЭ в различной степени. г) БАК: повышение мочевины, креатинина, средних молекул; при полиурии – гипокалиемия, при олигоанурии – гиперкалиемия; в терминальной стадии – гипермагниемия, гиперфосфоремия, гипокальциемия, метаболический ацидоз 2. Инструментальные данные: а) ЭКГ: малый зубец Т и косовосходящая депрессия сегмента ST (при уровне калия ниже 3,5 ммоль/л); высокий некоронарный зубец Т (при уровне калия выше 7,0 ммоль/л) б) УЗИ, обзорная рентгенография почек, радиоизотопная ренография (РРГ), биопсия почки – для установления причины ХПН (информативны только на первых двух стадиях процесса) Лечение и тактика ведения больных с ХПН: Лечение одновременно является патогенетическим и симптоматическим и включает мероприятия, направленные на: нормализацию АД, коррекцию анемии, липидного и углеводного обмена, КЩС, водно-электролитных расстройств, предупреждение накопления в организме токсичных продуктов обмена (дезинтоксикационная терапия). 1. Режим: избегать переохлаждения, физических и эмоциональных перегрузок; в начальных стадиях – лечение основного заболевания 2. Диета: ограничение белка – от 0,5 до 1,0 г/кг массы тела; количество потребляемой жидкости = диурез за предыдущие сутки + дополнительно 300 мл (при отсутствии выраженных отеков); ограничение поваренной соли; коррекция ионов калия 3. Коррекция ацидоза, электролитных нарушений: 4,2% р-р NaHCO3, трисамин в/в 4. Противоазотемическая терапия: сорбенты; кишечный диализ, форсированная диарея; желудочный лаваж; леспенефрил, кофитол; дезинтоксикационная терапия (гемодез в/в) 5. Лечение АГ: ИАПФ (только на начальной стадии при СКФ > 30-40 мл/мин и при отсутствии гиперкалиемии), петлевые диуретики (фуросемид), допегит/клофелин, бета-адреноблокаторы. 6. Лечение анемии: препараты железа, андрогены (тестостерона пропионат 5% – 1,0 в/м); рекомбинантный эритропоэтин 25-50 ЕД/кг 3 раза в неделю п/к или в/в; переливание эритроцитарной массы 7. Лечение уремической остеодистрофии: ограничение продуктов, богатых фосфором (зерновые, бобовые, отруби, рыба, творог); фосфорсвязывающие агенты (карбонат кальция, ацетат кальция, альмагель и др.); соли кальция перорально по 1,0-1,5 г/сут; препараты витамина D3 8. Гемодиализ – показан в следующих случаях: 1) СКФ < 10 мл/мин; 2) мочевина плазмы > 30 ммоль/л; 3) креатинин плазмы > 750 ммоль/л; 4) стойкая олигурия < 500 мл/сут; 5) калий > 6 ммоль/л; 6) начинающийся отек легких на фоне гипергидратации; перитонеальный диализ 9. Трансплантация почки – показана только в терминальной фазе ХПН (возможна в I и II периодах терминальной фазы). МСЭ: определяется стадией ХПН, на начальных стадиях больные трудоспособны. БОЛЕЗНИ СИСТЕМЫ КРОВЕТВОРЕНИЯ 53. Железодефицитные анемии: этиология, патогенез, клиника, классификация, диагностика, лечение. Железодефицитная анемия (ЖДА) – гипохромная микроцитарная анемия, развивающаяся вследствие абсолютного уменьшения запасов железа в организме. Эпидемиология: ЖДА страдают около 200 млн. людей во всем мире; самая частая форма анемий (80%). Этиология ЖДА: 1. Хронические периодические кровопотери (желудочно-кишечные кровотечения, маточные кровотечения, гематурия, кровоточащие опухоли, донорство и др.) 2. Повышенный расход железа (беременность, лактация, половое созревание, хронические инфекции) 3. Недостаточное поступление железа с пищей 4. Нарушение всасывания железа (синдром мальабсорбции, резекция желудка, высокая энтеропатия и др.) 5. Нарушение транспорта железа (наследственный недостаток трансферина, АТ к трансферрину) 6. Врожденный дефицит железа (нарушение реутилизации железа и т.д.) Патогенез ЖДА: В основе заболевания – дефицит железа, в котором выделяют 2 стадии: а) латентный дефицит – уменьшаются запасы железа в печени, селезенке, костном мозге, при этом снижается уровень ферритина в крови, происходит компенсаторное усиление всасывания железа в кишечника и повышение уровня мукозного и плазменного трансферина; содержание сывороточного железа еще не снижено, анемии нет б) собственно ЖДА – истощенные депо железа не способны обеспечить эритропоэтическую функцию костного мозга и, несмотря на сохраняющийся высокий уровень трансферина в крови, значительное содержается содержание сывороточного железа, синтез гемоглобина, развивается анемия и последующие тканевые нарушения. При дефиците железа, помимо анемии, снижается активность железосодержащих и железозависимых ферментов в различных органах и тканях, уменьшается образование миоглобина дистрофические поражения эпителиальных тканей (кожи, слизистых ЖКТ, мочевыводящих путей и др.) и мышц (скелетный, миокарда). Распределение железа в организме: 57-65% – гемоглобин; 27-30% – железо негемовых белков (ферритин, гемосидерин); 8-9% – миоглобин; до 0,5% – железо ферментов (цитохромов и пероксидаз); 0,1% – транспортное железо (с трансферрином). Классификация ЖДА: 1) по этиологии: а) хроническая постгеморрагическая ЖДА б) ЖДА вследствие повышенного расхода железа в) ЖДА вследстие недостаточного исходного уровня железа (у новорожденных и детей младшего возраста) г) алиментарная ЖДА д) ЖДА вследствие недостаточного всасывания в кишечнике е) ЖДА вследствие нарушения транспорта железа 2) по стадии развития: латентная анемия и ЖДА с развернутой клинико-лабораторной картиной заболевания 3) по степени тяжести: легкая (Hb 90-120 г/л), средняя (Hb 70-90 г/л), тяжелая (Hb ниже 70 г/л). Клиника ЖДА: а) общеанемический синдром: - общая слабость, повышенная утомляемость, снижение работоспособности, памяти, сонливость, головокружение, шум в ушах, мелькание мушек перед глазами, сердцебиение, одышка при физических нагрузках, склонность к ортостатическим обморокам - бледность кожи и видимых слизистых оболочек (иногда с зеленоватым оттенком – «хлороз») - небольшая пастозность в области голеней, стоп, лица, утренние отеки – «мешки» над и под глазами - синдром миокардиодистрофии (одышка, тахикардия, часто аритмия, умеренное расширение границ сердца влево, глухость тонов, систолический шум на верхушке) б) сидеропеничекий синдром (синдром гипосидероза): - извращение вкуса - непреодолимое желание употреблять в пищу что-либо необычное и малосъедобное (мел, зубной порошок, уголь, глину, сырое тесто, фарш, крупу); чаще встречается у детей и подростков - пристрастие к острой, соленой, кислой, пряной пище - извращение обоняния - пристрастие к запахам, которые большинством окружающих воспринимаются как неприятные (бензин, керосин, ацетон, запах лаков, красок, гуталина, нафталина и др.) - выраженная мышечная слабость и утомляемость, атрофия мышц и снижение мышечной силы; императивные позывы на мочеиспускание, невозможность удержать мочу при смехе, кашле, чихании, возможно даже ночное недержание мочи (слабость сфиктера мочевого пузыря) - дистрофические изменения кожи и ее придатков (сухость, шелушение, склонность к быстрому образованию на коже трещин; тусклость, ломкость, выпадение, раннее поседение волос; истончение, ломкость, поперечная исчерченность, тусклость ногтей; симптом койлонихии - ложкообразная вогнутость ногтей) - дистрофические изменения слизистых: ангулярный стоматит - трещины, «заеды» в углах рта; глоссит - ощущение боли и распирания в области языка, покраснение его кончика, в дальнейшем атрофия сосочков («лакированный» язык); склонность к пародонтозу и кариесу; атрофические изменения ЖКТ (сухость слизистой пищевода и затруднения, а иногда боли при глотании пищи, особенно сухой - сидеропеническая дисфагия или симптом Пламмера-Винсона; атрофический гастрит и энтерит) - снижение репаративных процессов в коже и слизистых - симптом «синих склер» Ослера - синеватая окраска или выраженная голубизна склер (из-за нарушения гидроксилирования пролина и лизина при дефиците железа склера истончается и через нее просвечивается сосудистая оболочка глаза) - «сидеропенический субфебрилитет» - длительное повышение температуры до субфебрильных величин - выраженная предрасположенность к ОРВИ, хронизации инфекций (из-за нарушения фагоцитоза) Диагностика ЖДА: а) ОАК: снижение содержания гемоглобина и (в меньшей степени) эритроцитов; микроцитоз; ЦП < 0,8 (= 3*Hb / 3 первые цифры числа эритроцитов); нормальные лейкоциты и тромбоциты б) БАК: тесты феррокинетики: 1) сывороточное железо (СЖ): женщины - норма 11,5-30,4 мкмоль/л, при дефиците железа < 11,5 мкмоль/л; мужчины - норма 13,0-31,4 мкмоль/л, при дефиците железа < 11,5 мкмоль/л 2) общая железосвязывающая способность сыворотки (ОЖСС): женщины – норма 44,8-70,0 мкмоль/л, при дефиците железа > 70,0 мкмоль/л; мужчины – норма 44,8-70,0 мкмоль/л, при дефиците железа > 70,0 мкмоль/л 3) процент насыщения трансферрина железом (%НТЖ): женщины – норма 25-40%, при дефиците железа < 25%, мужчины – норма 25-50%, при дефиците железа < 25% 4) сывороточный ферритин: женщины – норма 10-100 нг/мл, при дефиците железа < 10 нг/л; мужчины – норма 30-200 нг/мл, при дефиците железа < 30 нг/мл Принципы рациональной терапии ЖДА: 1. Основа лечения – препараты солевого железа per os; ЖДА невозможно купировать только диетой, богатой железом, т.к. из пищи в тонкой кишке всасывается 2-2,5 мг железа в сутки, а из препаратов – в 10-15 раз больше. NB! Перед применением препаратов железа следует исключить сидероахрестическую (железонасыщенную) анемию, при которой дефицита железа нет, но оно не используется; образуются гипохромные эритроциты, а железо захватывается клетками макрофагальной системы и откладывается в органах и тканях, вызывая их гемосидероз. Назначение препаратов железа при данной анемии только ухудшит состояние больного! 2. Этапность лечения – 2 этапа (3-5 мес.): 1) купирование анемии (от начала терапии до нормального уровня Hb – обычно 4-6 недель) 2) «терапия насыщения» - восполнение депо железа в организме (8-12 недель - по 30-60 мг ЭЖ/сут). 3. Правильный расчет лечебной и профилактической дозы по элементарному железу (ЭЖ): лечебная доза рассчитывается по содержанию элементарного железа в препарате и для взрослого весом 70-80 кг составляет 100-200 мг ЭЖ Основные препараты железа для перорального приема: «Ферроплекс»: 1 таблетка = 10 мг ЭЖ, «Ферроцерон»: 1 таблетка = 40 мг ЭЖ, «Феррокальм»: 1 таблетка = 44 мг ЭЖ; пролонгированные формы (1-2 раза/сут): Ферро-градумет»: 1 таблетка = 105 мг ЭЖ; «Мультирет»: 1 таблетка = 105 мг ЭЖ; «Тардиферон»: 1 таблетка = 80 мг ЭЖ; «Сорбифер»: 1 таблетка = 100 мг ЭЖ. 4. Лечение сочетают с одновременным применением аскорбиновой кислоты (0,3-0,5 г на прием), которая в 2-3 раза повышает всасывание железа в кишечнике; целесообразны также антиоксиданты и витамин В6. 5. Оптимально принимать препарат железа за 30 мин до еды, при плохой переносимости – через 1 час после еды, не разжевывая, запивая водой, можно фруктовыми соками без мякоти, но не молоком (кальций молока тормозит всасывание железа); для детей можно использовать сиропы - «Ферринсол», «Гемофер», «Интрофер». 6. Парентерально препараты железа используются по показаниям: синдром мальабсорбции; резекция желудка; резекция верхнего отдела тонкой кишки («Феррум-лек», «Эктофер», «Фербитол»). 7. При уровне гемоглобина < 70 г/л показано переливание эритроцитарной массы. 8. Критерии излеченности: а) повышение уровня ретикулоцитов на 5-7 день от начала ферротерапии б) повышение уровня гемоглобина с 3 (и раньше) недели лечения и восстановление его к 6-ой в) нормализация показателей СФ, СЖ, ОЖСС, %НТЖ по окончании курса лечения 9. Профилактический курс ферротерапии – приём препарата по 30-40 мг ЭЖ/сутки в течение 4-6 недель (тардиферон по 1 таблетке в 2 дня и др.) 54. Мегалобластные анемии: этиология, патогенез, клиника, классификация, диагностика, лечение. Мегалобластные анемии (МА) – группа анемий, основной причиной которых является дефицит фолиевой кислоты и витамина В12 и связанное с этим нарушение синтеза ДНК (при этом страдают прежде всего быстро обновляющиеся ткани – кроветворная и эпителий ЖКТ). Морфологически при МА деление клеток замедляется, цитоплазма созревает нормально, в результате клетки становятся крупными, содержание РНК превышает ДНК; эритропоэз неэффективный, т.к. на уровне костного мозга образуются мегалобласты – предшественники эритроцитов, разрушающиеся в самом костном мозге. Классификация мегалобластных анемий: а) В12-дефицитная анемия б) Фолиеводефитиная анемия в) МА, обусловленная наследственным дефицитом ферментов, участвующих в синтезе пуриновых и пиримидиновых оснований (дигидрофолиевой редуктазы, формиминотрансферазы и др.) г) МА, поддающаяся лечению витамином В1 (врожденное аутосомно-рециссивное заболевание) д) МА, обусловленная дефицитов витамина С (он участвует в метаболизме фолиевой кислоты) е) острая мегалобластная болезнь (быстрое развитие МА вследствие действия различных причин – закиси азота, гемодиализа, длительного парентерального питания и др.) Этиология мегалобластных анемий: 1. Причины дефицита витамина В12: а) недостаточное поступление его с пищей б) нарушение его всасывания при недостатке внутреннего фактора Касла (на уровне желудка), поражении дистальных отделов ileum, конкурентном поглощении витамина В12 при дифиллоботриозе, применении некоторых лекарственных средств (аминосалициловая кислота, неомицин) 2. Причины дефицита фолиевой кислоты: а) недостаточное поступление с пищей (особенно у алкоголиков, подростков, грудных детей) б) период повышенной потребности в фолиевой кислоте (беременность, грудной возраст, злокачественные опухоли, гемолитическая анемия, гемодиализ) в) нарушение всасывания (болезни тонкого кишечника: целиакия, спру; применение некоторых ЛС: барбитураты, фенитоин) г) нарушения метаболизма фолиевой кислоты (применение ингибиторов дигидрофолатредуктазы - метотрексата, триметоприма; алкоголь; недостаточность дигидрофолатредуктазы) и др. Патогенез мегалобластных анемий: Фолиевая (птероилглутаминовая) кислота – источник для человека – зеленые овощи и фрукты, минимальная потребность – 50 мкг/сут (при беременности увеличивается в несколько раз), резерв в организме 5-20 мг (половина резерва содержится в печени); в пище находится в конъюгированной форме в виде полиглютамата; основная функция - перенос метильной или формильной группы от одного вещества к другому. Метаболизм фолиевой кислоты: полиглютамат + γ-глютамилгидролаза в просвете кишечника моноглютамат всасывание в проксимальном отделе тонкой кишки попадание с помощью переносчика в клетку потеря метильной группы (при участии витамина В12) повторное образование полиглютамата использование на нужды клетки. При дефиците фолиевой кислоты нарушается синтез ДНК в кроветворных клетках из-за нарушения синтеза пуриновых и пиримидиновых оснований. Витамин В12 (кобаламин) – источник для человека – продукты животного происхождения (мясо, молоко, яичные желтки); минимальная потребность – 2,5 мкг/сут, резерв в организме: 2 мг в печени + 2 мг в других тканях (поэтому дефицит развивается лишь через 3-6 лет после прекращения поступления в организм); Метаболизм кобаламина: высвобождение кобаламина из пищи в желудке + желудочный R-белок комплекс В12+R-белок поступает в ДПК соединение с внутренним фактором Касла (вырабатывается париетальными клетками желудка) расщепление образовавшегося комплекса в энтероцитах концевого отдела подвздошной кишки связь кобаламина с транскобаламином II (переносчиком) перенос кровью к костному мозгу и печени. А 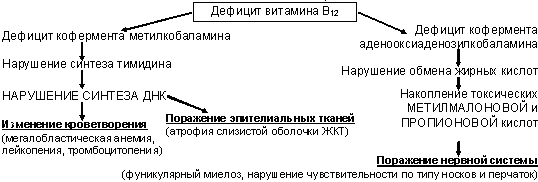 трофия желудка с нарушением образования внутреннего фактора Касла и развитием МА – болезнь Адиссона-Бирмера (пернициозная анемия, в 60% при ней обнаруживают АТ к париетальным клеткам желудка или к внутреннему фактору Касла) трофия желудка с нарушением образования внутреннего фактора Касла и развитием МА – болезнь Адиссона-Бирмера (пернициозная анемия, в 60% при ней обнаруживают АТ к париетальным клеткам желудка или к внутреннему фактору Касла)Клиническая картина В12-дефицитной анемии: |
