Педиатрия в вопросах и ответах. ПЕДИАТРИЯ В ВОПРОСАХ И ОТВЕТАХ. Педиатрия в вопросах и ответах содержание Неонатология 7 Основные термины и понятия неонатологии 8
 Скачать 1.1 Mb. Скачать 1.1 Mb.
|
Желтухи новорожденныхКлассификация желтух у новорожденных. Клинико-лабораторные критерии диагностики желтухКлассификация желтух новорождённых Так, все желтухи можно разделить на физиологическую и патолоические. По генезу - на наследственные и приобретенные. В настоящее время среди клиницистов наиболее распространена клинико-лабораторная классификация, по которой выделяют две основные группы: А) Гипербилирубинемия с преобладанием непрямого билирубина Б) Гипербилирубинемия с преобладанием прямого билирубина Наиболее значимой для дифференциальной диагностики нам представляется классификация с учетом патогенетических механизмов: А) ИЗЛИШНЯЯ ПРОДУКЦИЯ:1.ГБН 2.Наследственная гемолитическая анемия: а)мембранные дефекты (анемия Минковского - Шоффара, эллиптоцитоз б)гемоглобинопатии (дефекты структуры (серповидно-клеточная болезнь), дефекты синтеза Нв (талассемия и гема (вр эритропорфирии) в)дефекты энзимов эритроцитов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы) 4.Полицитемия ( идиопатическая, фето-фетальная, материнско-фетальная трансфузия, позднее пережатие пуповины, ЗВУР) 5.Внесосудистый гемолиз: а)заглатывание материнской крови (тест Апта) б)кровоподтеки, внутреннее кровотечение (напр. Кефалогематома, кровоизлияние в мозг, внутренние органы, обильные петехии) 6.Повышенная энтерогепатическая циркуляция (пилоростеноз, непроходимость кишечника, мекониальный илеус. Генез при этих заболеваниях смешанный: имеет значение также нарушение конъюгации. В) НЕДОСТАТОЧНАЯ ПЕЧЕНОЧНАЯ ФУНКЦИЯ: 1.Нарушение транспорта билирубина в гепатоцит: а)сниженная синусоидальная перфузия б)дефицит лигандина в)связывание Y и Z протеинов другими анионами 2.Сниженная конъюгация: а)недостаток энзимов (синдром Криглера_Найара) б)ингибирование ферментов (синдром Люцея-Дрисколла) 3.Неадекватный транспорт из гепатоцитов (синдром Дубина - Джонсона, Ротора) С) БИЛИАРНАЯ ОБСТРУКЦИЯ 1.Атрезия желчных ходов: а)внутрипеченочных -полная-неполная б)внепеченочных желчных ходов-полная-неполная 2.Синдром «сгущения желчи 3.Киста желчного протока или сдавление извне желчных путей 4.Муковисцидоз, дефицит альфа-1-антитрипсина (имеет значение также нарушение конъюгации) Д) КОМБИНИРОВАННЫЕ 1.Гепатиты А, В, С,Д. 2.другие внутриутробные инфекции (ЦМВ, токсоплазмоз, краснуха и др.) 3.постнатальные инфекции, сопровождающиеся поражением печени (сепсис) 4.нарушения обмена веществ (тирозинемия, гипотиреоидизм, галактоземия) Е)ЖЕЛТУХИ, СВЯЗАННЫЕ С ГРУДНЫМ ВСКАРМЛИВАНИЕМ 1.Желтуха от кормления грудью 2.желтуха от грудного молока Лечение и профилактика желтух у новорожденных, обусловленных накоплением неконъюгированного билирубинаПринципы лечения желтух • барбитураты, зиксорин для ускорения созревания фермента глю-куронилтрансферазы (5—10 мг/кг) в течение 5—7 дней; • активированный уголь или смекта для адсорбции билирубина в кишечнике; • желчегонные (сернокислая магнезия — 12,5 % раствор по 5—10 мл Г раз в день 3 дня); • следить за стулом, очистительные клизмы; • не назначать гормоны, витамин К, антибиотики (аминогликози-ды, тетрациклинового ряда, цефалоспорины, левомицетин), сульфаниламиды; • не давать оранжевые соки; • правильный уход, вскармливание; • следить в динамике за уровнем билирубина, данными анализа крови, мочи (1 раз в 7—10 дней); • при длительной и выраженной гипербилирубинемии — госпитализация; • консультация невропатолога, оториноларинголога, окулиста (в первые 2—3 нед жизни). Гемолитическая болезнь плода и новорожденного (ГБН)Гемолитическая болезнь плода и новорожденного: определение, этиология, патогенез. Варианты клинического теченияГБН − врожденное заболевание плода и новорожденного, обусловленное иммунологической несовместимостью крови плода и матери по Er-антигенам. Этиология ГБН. Причина – несовместимость по Rh, АВО. Факторы риска: Rh “-“ мать и Rh “+” плод, последующая беременность и роды резус + плодом, аборты, гемотрансфузии, трансплантации, ГБН у предыдущих детей, мать с I группой, а ребенок II или III. Патогенез ГБН 6 антигенов Rh: C(Rh), c(hr), D(Rh0), d(hr0), E (Rh*), e(hr*). Д-антиген определяет принадлежность к Rh и обладает выраженной изоантигенной активностью, к нему нет естественных антител. А-ген кодируется 6 генами (по 3 на хромосоме). В гомозиготном состоянии (Dd), полного доминирования нет. Плацента не пропускает а-гены. Нарушение при гестозах, эндокринной патологии и др. Несовместимость по АВО – чаще у матерей с I группой, а у ребенка II или III, причем титр анти А- антител выше. (А-ген А доминирует над О и В, В доминирует над О). Этот конфликт легче, чем Rh-несовместимость. При неблагоприятных условиях во время беременности, родов Эр плода с Д или А-В а-генами проникают ч/з плаценту в кровоток матери сенсибилизация с образованием а-тел ч/з плаценту к плоду идет переход антител против Er плода и ребенка иммунное повреждение Эр. плода и лизис эритроцитов. Различают 2 типа групповых антител: 1) естественные (в процессе формирования организма), 2) иммунные агглютинины − результат скрытой сенсибилизации (вакцинация, инфекционные заболевания). При первичной сенсибилизации по резус-фактору образуются антитела Ig M, при повторном поступлении – Ig G. Ig M – естественные антирезус а-тела, они являются полными, бивалентными, высокомолекулярными, способны преципитировать, не проникают ч/з плаценту. Ig G – гипериммунные, гемолизины, неполные, одновалентные, низкомолекулярные, свободно проникают ч/з плаценту, не активируют комплемент. ГБН относится ко 2 типу иммунологических реакций. Выделяют 3 фазы аллергических реакций: 1) иммунологическая (Аг+Ат на поверхности Эр) – либо гемолиз, либо блокада Эр. 2) Патохимическая – связана с удалением ИК за счет компонентов С3-С5- комплемента и Т-киллеров повреждение базальной мембраны. 3) Патофизиологическая – прямое действие на мембрану и её разрушение. Классификация ГБН: по этиологии: Rh, ABO; по клинике: внутриутробная гибель с мацерацией, отечная форма, желтушная форма, анемическая; по тяжести: легкая, ср, тяжелая; осложнения: ДВС, кардиопатия, биллирубиновая энцефалопатия, гипогликемия, синдром сгущения желчи. По ВОЗ: 1. Водянка плода, обусловленная иммунизацией. 2. ГБ плода и новорожденного вследствие изоиммунизации. 3. Ядерная желтуха. Гемолитическая болезнь плода и новорожденного: основные звенья патогенеза отечной и желтушной форм болезни. Клинические проявленияОтёчная форма (водянка): Резкая бледность и общий отек со значительно увеличенным в объеме животом, гепатоспленомегалия, расширение границ относительной сердечной тупости. Проявления дыхательных расстройств в результате гипоплазии легкого, которое было поджато печенью или вследствие развития БГМ. Геморрагические расстройства. Асцит. Развитие острой почечной недостаточности. Желтушная форма. У большинства детей желтуха проявляется в первые часы и сутки жизни. Чем раньше она появляется, тем тяжелее она протекает. При АВО-конфликте желтуха проявляется на 2-3 день жизни и даже позже. Это обусловлено незрелостью рецепторов на эритроцитах к антителам-агглютининам ОС и [3 и протекает более легко, чем при Rh-конфликте. Отмечается увеличение печени и селезенки при резус-несовместимости и отсутствие данного синдрома при групповом конфликте. По мере повышения уровня НБ в кровяном русле, дети становятся вялыми, адинамичными, снижаются физиологические рефлексы. При массивном проникновении антител к плоду в антенатальном периоде, у новорожденных, кроме желтушной формы, ГБН может проявляться анемической формой. Гемолитическая болезнь плода и новорожденного: клинические и лабораторные критерии диагностикиДиагностика ГБН Акушерский анамнез, амниоцентез с исследованием вод на оптическую плотность, биллирубин, глюкозу, белок (все повышено), иммунологический мониторинг (титр Ig M – диагностич титр АВО 1:512, Rh – 1:32, 1:128 – при 2 беременности), непрямая реакция Кумбса у матери, УЗИ плода и плаценты (утолщение плаценты, гепатоспленомегалия плода), КТГ (гипоксия плода). Постнатальная диагностика: определение групп риска по ГБН, лабораторная диагностика (уровень биллирубина в пуповинной крови (в норме не>50-60 мкмоль/л), динамика биллирубина по фракциям, почасовой прирост биллирубина – не >5-6/час в норме),ОАК, иммунодиагностика – р-ция Кумбса прямая (оценка наличия иммунных комплексов) – Эр плода + антиглобулиновая сыворотка агглютинация ИК. При АВО положительная ч/з 2-3 дня, при Rh сразу. Непрямая р-ция Кумбса: сыворотка новорожденного + известные Эр (барана) на сутки в термостат, отмывание + антиглобулиновая сыворотка агглютинация (положительная на 1-2 сут) Степень тяжести гемолитической болезни новорожденных определяется уровнем гемоглобина, билирубина и характером отеков.
Особенности патогенеза и клинических проявлений гемолитической болезни новорожденных при групповой несовместимости. Дифференциальный диагноз с резус-конфликтомПринципы лечения гемолитической болезни новорожденных. ПрофилактикаЯдерная желтуха: определение, причины развития, клинические стадии и проявления, лечение, исход, профилактикаДля клиники ядерной желтухи характерна стадийность ее течения: I стадия- апноэтическая или асфиксическая: снижение рефлексов, мышечного тонуса, гиподинамия, срыгивание, приступы апноэ, приступы цианоза; II стадия - спастическая или манифестных, клинических проявлений: беспокойство, скованность, гипертонус, голова запрокинута кзади, судороги, эпистотонус, широко раскрытые глазные щели, плавающие глазные яблоки, симптом "заходящего солнца", гипертермический синдром; III стадия - мнимого благополучия, которая может длится до 3-4 недель: исчезает патологическая клиническая симптоматика; IV стадия - остаточных явлений: глухота, ДЦП, задержка психомоторного и речевого развития. Диспансерное наблюдение в поликлинике за новорожденным, перенесшим гемолитическую болезньСиндром дыхательных расстройств (СДР) у новорожденныхПричины возникновения дыхательных расстройств у новорожденных. Удельный вес СДР в структуре неонатальной смертности. Основные принципы профилактики и леченияК легочным причинам дыхательных расстройств относятся: Патология воздухоносных путей: пороки развития с обструкцией дыхательных путей (атрезия и гипоплазия хоан, микрогнатия. макроглоссия, опухоли шеи, врожденные стенозы гортани, бронхов и др.); приобретенные заболевания (отеки слизистой носа инфекционного и медикаментозного генеза, ОРВИ. бактериальные инфекции верхних дыхательных путей и др.). Патология альвеол и / или паренхимы легких: первичные ателектазы легких, болезнь гиалиновых мембран, аспирационный синдром меконием, транзиторное тахипноэ (влажные легкие), отек легких, кровоизлияния в легкие, синдромы, сопровождаемые выходом воздуха в полость грудной клетки (пневмоторокс, пневмомедиалинум, ингерстициальная эмфизема). Патология легочных сосудов. Пороки развития легких. Приступы апноэ. Хронические заболевания легких (БЛД, синдром Вильсона-Микити). К внелегочным причинам развития дыхательных расстройств относятся: Врожденные пороки сердца. Повреждения головного и спинного мозга. Метаболические нарушения. Аномалии развития грудной клетки и диафрагмы. Гиповолемический или септический шок. Миопатии. Медикаментозное лечение: В первые сутки жизни введение в трахею экзогенного сурфактанта: альвеофакт, который назначают по 50мг/кг или 1,2мл/кг с интервалом 6 часов, но не более 4 раз в течение 48 часов; курсовая доза не должна превышать более 200мг/кг; экзосурф по 5 мл/кг однократная доза. Повторное введение через 12 часов, кратность введения от 1 до 3 раз. Создание оптимальных условий выхаживания недоношенного ребенка (кувезный режим с индивидуальным подбором температуры) и вскармливания ( энтеральное при РДС I - II ст. и парентеральное при синдроме II -III ст.) Обеспечение свободного дыхания через верхние дыхательные пути, в случае аспирационного синдрома проводится интубация трахеи и лаваж теплым физиологическим раствором из расчета 0,5 мл/кг с дальнейшим ведением такого ребенка на ИВЛ. Нормализация газового состав крови путем проведения оксигенотерапии: РДС легкой степени, подача увлажненного и подогретого 40% кислорода ребенку в кувез или через носовые катетеры или кислородную маску со скоростью 1-2 л/мин; РДС средней степени тяжести - проведение спонтанного дыхания под положительным давлением (СДППД = СРАР) по методике Грегори или Мартина, с помощью назофарингиальных канюль, с помощью клапана Бенвенисте 60-70% кислородом со скоростью 5 л/мин с давлением на выдохе 2-3 см. водн. ст.; РДС тяжелой степени - взятие ребенка на аппарат ИВЛ при ЧД более 80/мин, частых и длительных приступах апноэ, сохраняющемся распространенном цианозе кожных покровов; при подаче кислорода высокой концентрации при КОС : рО2 50 мм. рт. ст., SaО2 < 90(80) на фоне оксигенации 90-100% О2 , рСО2 > 60 мм. рт. ст., рН < 7,2, ВЕ<-12. Респираторный дистресс-синдром (болезнь гиалиновых мембран). Предрасполагающие причины, этиология, звенья патогенеза, диагностические критерииДыхательные расстройства (ателектазы, СДР = РДС = БГМ, синдром аспирации мекония, транзиторное тахипноэ, БЛД) К группе риска по развитию дыхательных расстройств можно отнести: недоношенных детей с гестационным возрастом менее 35 недель; новорожденных с морфофункциональной незрелостью; детей перенесших хроническую или острую гипоксию; младенцев, родившихся от матерей с сахарным диабетом, гипотиреозом и другими эндокринными заболеваниями; детей от многоплодной беременности; новорожденных, родившихся путем операции кесарева сечения; отслойку плаценты с кровотечением в родах; наличие врожденных и наследственные заболеваний у родителей; новорожденных с родовой травмой ЦНС. Особенности дыхательной системы недоношенных детей, способствующие развитию дыхательных расстройств: незрелость дыхательного центра; бронхи имеют узкий просвет и богато снабженную слизистую кровеносными сосудами, что легко приводит к ее отеку и сужению просвета бронхов; незрелость сурфактантной системы; горизонтальное расположение ребер; недостаточно развита межреберная мускулатура; низкая растяжимость легочной ткани; лабильная частота дыханий (ЧД < 30 в 1 минуту брадипноэ, > 70 в 1 минуту). К легочным причинам дыхательных расстройств относятся: Патология воздухоносных путей: пороки развития с обструкцией дыхательных путей (атрезия и гипоплазия хоан, микрогнатия. макроглоссия, опухоли шеи, врожденные стенозы гортани, бронхов и др.); приобретенные заболевания (отеки слизистой носа инфекционного и медикаментозного генеза, ОРВИ. бактериальные инфекции верхних дыхательных путей и др.). Патология альвеол и / или паренхимы легких: первичные ателектазы легких, болезнь гиалиновых мембран, аспирационный синдром меконием, транзиторное тахипноэ (влажные легкие), отек легких, кровоизлияния в легкие, синдромы, сопровождаемые выходом воздуха в полость грудной клетки (пневмоторокс, пневмомедиалинум, ингерстициальная эмфизема). Патология легочных сосудов. Пороки развития легких. Приступы апноэ. Хронические заболевания легких (БЛД, синдром Вильсона-Микити). К внелегочным причинам развития дыхательных расстройств относятся: Врожденные пороки сердца. Повреждения головного и спинного мозга. Метаболические нарушения. Аномалии развития грудной клетки и диафрагмы. Гиповолемический или септический шок. Миопатии. Сурфактантная система легких состоит из 3-х компонентов: собственно сурфактанта, гипофазы - подстилающий гидрофильный слой, клеточного - альвеоциты II типа. Сурфактант - поверхностно-активное вещество, синтезируемое альвеоцитами II типа и клетками Клара (безволосковые бронхиолярные клетки). Состав сурфактанта: 90% - липиды: 80% - фосфолипиды, основным компонентом которых является фосфотидилхолин (лецитин), 10% - нейтральные липиды; 8% сухого веса сурфактанта - протеины А, В, С; др. Функции сурфактанта: препятствует спадению альвеол на выдохе (ателектатическая); защищает эпителий легких от повреждений; способствует мукоцилиарному клиренсу; обладает бактерецидной активностью против Гр+ бактерий; стимулирует макрофагальную систему легких; участвует в регуляции микроциркуляции в легких и проницаемости стенок альвеол препятствует развитию отека легких. Стимуляторы синтеза сурфактанта: адреналин и норадреналин; глюкокортикоиды, тиреоидные гормоны. Два пути синтеза сурфактанта: ранний ( с 20-24 по 35 недели внутриутробной жизни ) - синтез идет путем метилирования этаноламина, основным компонентом которого является лецитин II типа, который неустойчив к воздействию повреждающих факторов: гипоксемии, гиперкапнии, ацидозу, гипотермии; поздний (с 36 недель внутриутробного развития) - фосфатидилхолиновый путь, в этом случае основным компонентом сурфактанта является лецитин I типа, который устойчив к воздействию неблагоприятных факторов. Для нормального функционирования сурфактанта имеют значение и другие его компоненты: фосфатидилглицерин и фосфатидилинозитол. Период полураспада сурфактанта 10-20 часов. Болезнь гиалиновых мембран у новорожденных: клинические проявления, лечение. ПрофилактикаБГМ Причинными факторами развития БГМ являются: • дефицит образования и выброса сурфактанта, • качественный дефект сурфактанта, • ингибирование сурфактанта (инфекции, особенно Гр+ и микоплазменные, белками плазмы, метаболический ацидоз), • гистологическая незрелость структуры легочной ткани и анатомофизиологические особенности респираторной системы. К способствующим факторам в развитии БГМ относится: • дефицит плазминогена, что ведет к малой активности фибринолиза. • внутриутробные инфекции. I стадия - " светлого промежутка ", которая длится несколько часов (4-6), во время которой состояние ребенка в основном обусловлено степенью недоношенности, без клиники дыхательных расстройств. За это время расходуется "незрелый" сурфактант и его запасы не восполняются. В некоторых случаях данная стадия может отсутствовать. Для II стадии - "манифестных клинических проявлений", длительностью 48 часов, характерны кардинальные клинические симптомы: рз возбуждение и угнетение нервной системы; \Ъ тахипноэ, более 65 в минуту, кгорое может достигать 80-120 в минут/, fb стон при выдохе, который наблюдается в начале заболевания и исчезает по мере его развития (спазм голосовой щели с целью увеличения остаточного объема в легких); \Ь участие вспомогательной мускулатуры в акте дыхания; fbпериоральный и акроцианоз, цианоз кожи, который в начале заболевания обусловлен спазмом легочных сосудов, а затем сбросом крови справа налево. По мере развития гиалиновых мембран цианоз усиливается; рз появляются приступы апноэ; pj аускультативно дыхание ослаблено умеренно или значительно, выслушиваются крепитирующие и мелкопузырчатые влажные хрипы; \Ь со стороны сердечно-сосудистой системы отмечается спазм периферических сосудов, повышается АД, тахикардия 180-220 в мин., выслушивается систолический шум; pj снижается диуреза вплоть до развития олигурии или анурии ; р) появление начальных признаков ДВС-синдрома. III стадия - "восстановления" длительностью 3-10 дней - исчезают признаки дыхательных расстройств и изменения со стороны ЦНС, нормализуется периферическое кровообращение или эта стадия может быть "терминальной" - ребенок угнетен, выражен тотальный цианоз кожных покровов с мраморным рисунком, тяжелая степень дыхательных расстройств с парадоксальными типами дыхания, длительные и частые приступы апноэ, брадипноэ. На фоне ослабленного дыхания выслушиваются крепитирующие и разнокалиберные влажные хрипы, что свидетельствует об отеке легких. Отмечается падение АД. выслушивается грубый систолический шум, брадикардия, перкуторно - кардиомегалия. Развивается полиорганная недостаточность, ДВС-синдром, анурия. Сепсис новорожденныхСепсис новорожденных: определение, частота, летальность, основные причины и факторы риска возникновения. КлассификацияСепсис − инфекционное полиэтиологическое заболевание, вызывыаемое условно патогенной и патогенной микрофлорой или ассоциацией возбудителей, характерезующееся ациклическим течением, наличием первичного гнойно-воспалительного очага, генерализацией процесса на фоне сниженной или извращенной иммунологической реактивности организма. Частота сепсиса среди новорожденных составляет 0,5-0,8%, но его частота не одинакова среди доношенных и недоношенных. Так, доношенные дети болеют сепсисом до 1%, а недоношенные в 10 раз чаще, что составляет 10%. Среди глубоконедоношенных (1000-500гр) сепсис встречается в 33% случаев. В структуре заболеваемости новорожденных внутриутробный сепсис составляет 3-10%. Летальность от сепсиса в среднем колеблется от 15% до 40%, увеличиваясь при внутриутробном сепсисе до 60-80%. В структуре младенческой смертности сепсис занимает 4-5 место. Этиология. Основными этиологическими факторами сепсиса у доношенных детей являются: стафилококк -50-60%, грам-отрицательная флора - 30-40% (клебсиелла, протей, синегнойная палочка, энтеробактер, эшерихии) и стрептококки - 5-10%. У недоношенных новорожденных в 60-70% септицемию вызывают грам-отрицательные бактерии, 25-30% - золотистый и эпидермальный стафилококки. У 50% больных обнаруживается сочетаиная флора: стафилококки и грам-отрицательная флора. Наряду с данной флорой, в последнее время среди возбудителей неонатальыого сепсиса отмечается рост кандидозной инфекции - 10-15% . Этиология заболевания обуславливает клиническую картину болезни, выбор медикаментозной терапии и исход заболевания. Поэтому установление этиологического фактора является обязательным при постановке диагноза. Основным источником инфицирования является обслуживающий персонал роддомов, мать, которая внутриутробно инфицирует плод и окружающая среда. Основными путямим инфицирования плода является трансплацентарный, восходящий, что подтверждается гистологическим и бактериологическим методоми исследованиями плаценты, а также интранатальный путь инфицирования. Предрасполагающие факторы, спсобствующие развитию сепсиса I. Перинатальные (оказывающие депрессивное воздействие на формирование иммунитета плода и новорожденного): гестозы, генитальная и экстрагенитальная патология у матери, угроза прерывания беременности, дефекты питания беременной женщины, недоношенные и "незрелые" дети, дети, родившиеся от матерей с эндокринной патологией, холодовой стресс, новорожденные с ЗВУР и врожденной гипотрофией. родовая травма, СДР, ОРВИ, внуртриутробная гипоксия плода и асфиксия в родах, нарушение процессов адаптации в раннем неонатальном периоде. П. Анте - и интранатальные факторы (способствующие восходящему внутриутробному инфицированию плода): урогенитальная инфекция во время беременности и в родах. раннее отхождение околоплодных вод, длительный безводный период (более 6 часов), продолжительность родов более 24 часов, лихорадка в родах, хронические очаги инфекции и их обострения в период беременности. инфекционно-воспалительные процессы в послеродовом периоде. III. Лечебно - диагностические манипуляции: интубация, лаваж, ивл, катетеризация центральных вен и прочее. IV. Наличие различных очагов инфекции у новорожденных омфалит, ОРВИ, пневмонии, кожные заболевания в первые 7 дней жизни, дисбактериоз. V. Ятрогенный фактор : гормональная терапия, антибактериальная терапия беременных и новорожденных, неадекватная калорийное обеспечение и компенсирование метаболических нарушений. Сепсис новорожденных: основные звенья патогенеза, варианты клинического течения. Диагностические критерииПатогенез. Возникновение сепсиса зависит от 3-х факторов: 1. Состояния реактивности макроорганизма (его естественные барьеры. 2. Массивности бактериальной и/или фрагментов бактериальной клетки (бактериальные модулины) инвазии и вирулентности возбудителя. 3. Особенностей внешней среды. Однако, решающее значение в возникновении заболевания, принадлежит реактивности макроорганизма. Для развития сепсиса необходимо повреждение естественных барьеров организма вследствие позднего прикладывания к груди, развития дисбактериоза, катаболической направленности обменных процессов, снижения функции неспецифических факторов защиты, с участием микроорганизмов, как пусковым механизмом, с бактериемией до 10 10 в 1мл крови. Г.Н.Спиранснийш выделяетследукиеосновнь1езвенья патогенеза сепсиса: => входные ворота, => местный воспалительный очаг, который характерезуется не столько воспалением, а некрозом тканей в силу анатомо-физиологический особенностей, обусловленных концевым типом расположения сосудов и недостаточно развитым сосудистым компонентом воспалительной реакции, что способствует замедлению кровотока и оседанию микроорганизмов с развитием воспаления альтернативно-дегенеративного характера. => бактериемия, => сенсибилизация и перестройка иммунологической реактивности организма, => септицемия (в этот период под воздействием экзо-, эндотоксинов и бактериальных фрагментов-модулинов происходит активация моноцитов, нейтрофилов, макрофагов, клеток эндотелиальной системы, которые выделяют простогландины. лейкотриены, цитокины - IL 1,2,6 и ФНО, кислородные радикалы, факторы комплемента СЗ, все они являются провоспалительными факторами и способствуют развитию системному воспалительному ответу организма. В ответ на длительную циркуляцию в крови большого количества провоспалительных факторов (цитокинов). увеличивается концентрация и противовоспалительных факторов - цитокинов (IL 4,10), простогландина Е2. Их избыток ведет к возникновению феномена эндотоксиновой толерантности моноцитов и они не способны реагировать на бактериальные стимулины, что ведет к иммунному параличу организма), => септикопиемия - появление вторичных гнойных очагов, => эндотоксикоз - системный воспалительный ответ организма с чрезмерной активацией защитных механизмов и гиперметаболизмом, => полиорганная недостаточность, проявляющаяся энцефалопатическим, респираторным, желудочно-кишечным, анемическим, желтушным, мочевым, геморрагическим, кардиоваскулярным и дистрофическим синдромами. Тяжесть состояния больного сепсисом в основном обусловлена степенью токсинемии и эндогенной интоксикации. Наиболее токсичными являются "среднемолекулярные субстанции", это - продукты катаболизма белков, липидов, углеводов, а также биологически активные вещества (стрессовые гормоны, эклефалины, ИЛ, ЦИК, фактор некроза опухоли, лейкотриены, факторы комплемента и др.) Поступление эндотоксинов в кровь вызывает генерализацию интоксикации, поражение клеток всех органов и тканей, способствует развитию ДВС-синдрома и полиорганной недостаточности. Варианты Внутриутробный сепсис развивается вследствие анте- и интранатального инфицирования и в этом случае первичный очаг находится вне организма ребенка, т.е. в плаценте или в организме матери (это плацентит, хорионамнионит. эдометрит, аднексит, хронический пиелонефрит и другая экстрагенитальная инфекционная патология). У новорожденных внутриутробный сепсис чаще протекает в форме септицемии, без гнойных метостазов и характеризуется молниеносным или острым течением. Клинически сопровождается очень тяжелым состоянием с симптомами септического шока, дыхательных расстройств (РДС, апноэ, цианоз), нестабильностью температуры тела, желудочно-кишечными расстройствами. Септицемия наиболее характерна для недоношенных детей, т. к. они не способны локализовать очаг инфекции вследствие особенностей иммунологической реактивности их организма. При этой форме начало заболевания более постепенное, скрытый период от 2-5 дней до 3 недель и характерезуется наличием первичного гнойного очага, симтомами интоксикации без выраженных лабораторных сдвигов. В период разгара болезни усиливается токсикоз выявляются полиорганные поражения, изменяются лабораторные показатели. Септикопиемия протекает остро, с гиперлейкоцитозом и выраженным токсикозом. При грам-отрицательной флоре - температура тела может быть нормальной со скудными клиническими проявлениями с преобладанием явлений интоксикации. Для данной клинической формы сепсиса характерно наличие вторичного гнойнгого очага, как очагов отсева. Наиболее часто поражаются кости, мозговые оболочки, легкие. Септикопиемия чаще встречается среди доношенных новорожденных. Для постановки диагноза сепсиса новорожденных необходимо наличие одновременно III групп критериев: Наличие факторов риска в развитии сепсиса новорожденных, на которых мы останавливались выше. Клинические критерии: наличие первичного гнойного очага проявления интоксикации несоответствие выраженности токсикоза величине гнойного очага появление вторичных гнойных очагов отсутствие положительной динамики в состоянии ребенка на фоне активной терапии в разгар заболевания клинические проявления токсикоза и полиорганной недостаточности с наличием 3-4-х синдромов: => энцефалопатический - вялость, гипотония, гипорефлексия. летаргия, отказ от пищи, нарушение терморегуляции. сосания, судороги; => респираторный - одышка более 60 в минуту, длительные апноэ, при отсутствии выраженных изменений в легких на R- грамме; => кардио-васкулярный - аритмия, глухость сердечных тонов, расширение границ относительной сердечной тупости и появлением систолического шума, увеличение печени, отечность, с-м "белого пятна", мраморность кожи, гипотензия АД < 35 мм.рт.ст. => желудочно-кишечный - вздутие живота, диспептические расстройства, срыгивания, рвота; => геморрагический и анемический синдромы; => желтушный - волнообразная и затяжная желтуха; => дистрофический - плоская весовая кривая, вторичное падение массы тела, сухость, шелушение кожи, снижение тургора. Лабораторные критерии: бактериологическое исследование флоры из первичного очага, а также крови, фекалий, мочи, спинномозговой жидкости, при этом имеет большое значение идентификация флоры; гистологическое и бактериологическое исследование плаценты; общий анализ крови: красная кровь: снижение Hb; белая кровь: лейкоцитоз в начальной стадии заболевания (>30,0х109/л) и затем лейкопения (< 5,0х109/л), 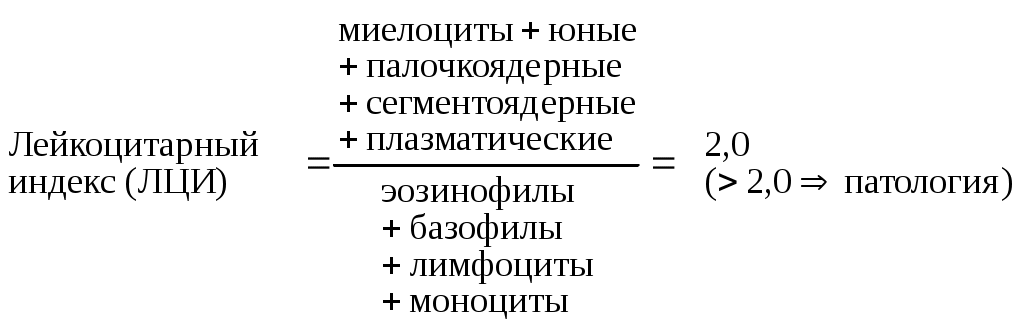 , палочкоядерный сдвиг влево, , палочкоядерный сдвиг влево,  , токсическая зернистость нейтрофилов, что свидетельствует о наличии эндотоксикоза, лимфопения, моноцитоз; , токсическая зернистость нейтрофилов, что свидетельствует о наличии эндотоксикоза, лимфопения, моноцитоз;тромбоцитопения (<100x109); общий анализ мочи: протеинурия, микрогематурия, лейкоцитурия биохимический анализ крови: гипопротеинемия < 50-45 г/л, диспротеинемия, увеличение СРБ > 10 мг/л, гипербилирубинемия, повышение мочевины более 7 ммоль/л, повышение креатинина более 0,1 ммоль/л, изменения КОС и электролитного баланса, гипергликемия более 6 ммоль/л, увеличение "средних молекул" более 0,8 оптич. ед., увеличение щелочной фосфатазы (N 0,5-1,3 ммоль/л), увеличение тимоловой пробы (N 0-4 ед); иммунологический мониторинг: снижение CH50 , лизоцима, Т- и В-лимфоцитов, IgG, индекса супрессии (менее 2), увеличение IgA и IgM, ЦИК, снижение НСТ-теста (N 5-8%), что свидетельствует о низкой фагоцитарной активности; УЗИ и R-грамма, ЭКГ. Сепсис новорожденных: лечение в остром периоде, реабилитация в амбулаторно-поликлинических условияхЛечение сепсиса в остром периоде Создание оптимальных условий выхаживания больного ребенка. Рациональное вскармливание − нативное молоко, в случае отсутствия − донорское грудное молоко с добавлением лизоцима по 10 мг на 100 мл молока или используют биологически-активные добавки, содержащие лизоцим, бифидум-бактерин (БАД-1Л, БАД-1Б, БАД-2), бидобакт или бифидотат по 10 мл 3 раза в день. Калорийное обеспечение с учетом потребности в основных ингредиентах - Б, Ж, У. Санация местных очагов инфекции. При лечении сепсиса, антибактериальная теапия по значимости занимает 1-е место в общей структуре лечебных мероприятий и направлена на борьбу с возбудителем.. В основном в лечении сепсиса применяются антибиотики, относящиеся к бета-лактамным (пенициллины, цефалоспарины, карбапенемы), антибиотики группы аминогликозидов, а также гликопептиды и фторхинолоны. Выбор антибиотика строго должен быть аргументирован чувствительностью к флоре. Дозировка, кратность и пути введения препаратов зависят от тяжести течения процесса, формы заболевания, возраста и степени зрелости новорожденного. При раннем неонатальном сепсисе - могут быть использованы полусинтетические пенициллины : амоксициллин (клавуланат, амоксиклав) 50-100 мг/кг/сут в 2 приема в/в, в/м; ампициллин/сульбактам 100 мг/кг/сут в/в, в/м через 12 часов. Данные полусинтетические пенициллины являются резистентными к В-лактамазе. Наиболее часто полусинтетические пенициллины комбинируют с аминогликозидами. При более позднем начале сепсиса, наличии гнойного очага или подозрении, что причиной развития сепсиса явилась госпитальная инфекция, целесообразно начать антибиотикотерапию с цефалоспаринов. В качестве «стартового» антибиотика назначауют цефалоспарины II поколения - цефуроксим (зинацеф), цефуроксим-аксетил (кетацеф, зиннат) в суточной дозе 30-100 мг/кг в/в, в/м через 8-12 часов в комбинации с аминогликозидами. В случае госпитальной инфекции, тяжелого течения сепсиса и/или гентамицинрезистентных энтеробактерий, целесообразно назначение цефалоспаринов III поколения - цефоперазон (цефобид), цефотаксим (клафоран), цефтриаксон (лонгоцеф, роцефин) в/венно, в/мышечно в суточной дозе 50-100(150) мг/кг в 2-3 приема. Аминогликозиды - гентамицин, нетрамицин, тобромицин, сизомицин, бруломицин, нетилмицин традиционно используют в лечении сепсиса в комбинации с цефалоспоринами и пенициллинами в суточной дозе 3-8 мг/кг, амикацин 15-20(30) мг/кг в сутки 2-3 раза в день в/венно, в/мышечно, длительность лечения аминогликозидами не более 7 дней ввиду выраженности ото- и нефротоксического действия этих препаратов. Реже аминогликозиды используют в виде монотерапии. При резистентной грам-отрицательной флоре, вызвавшей сепсис, весьма эффективно применение пептидных антибиотиков - полимиксинов В и Е (колистин) для парентерального введения 15-20 мг/кг в сутки 3-4 раза в день. Препаратами выбора из группы макролидов в лечении сепсиса являются эритромицин и спирамицин для внутривенного введения в суточной дозе 50 мг/кг , каждые 8-12 часов. Препаратами резерва антибиотиков в лечении гнойно-воспалительных заболеваний являются: карбопенемы -тиенам , который назначается в дозе 60 мг/кг/сут для в/мышечного введения и меропенем для в/венного капельного введения в суточной дозе 30-60 мг/кг в 2 -3 приема; гликопептиды - ванкомицин (ванкоцин, ванколед,эдицин) назначается в дозе 20-30(45) мг/кг/сут в/венно каждые 8- 12 часов; фторхинолоны - ципрофлоксацин в суточной дозе 20-30 мг/кг в/венно капельно, курс 7 дней. При кандидозном сепсисе используется амфотерацин В, который назначается в/венно капельно в течение 3-6 часов по 0,1 мг/кг/сут в первые сутки с последующим повышением дозы до 0,5-1,0 мг/кг/сут, курс лечения составляет 2-3 недели. Последнее время довольно широко при кандидозе применяются и другие препараты: флутотавин (анкотил) 100-200 мг/кг 1 раз в сутки в/венно или орально (курс 4-6 недель); дифлюкан 3,5-6,0 мг/кг в/венно 1 раз в сутки с последующим переходом на энтеральный прием ввиде сиропа по 2 мл (1 мл=5 мг препарата) 1 раз в сутки. Курс лечения одной группы антибиотиков от 7-10 до 14 дней, длительностью не менее 1 месяца. При выявлении анаэробной флоры широко применяют метронидозол, метроджил в суточной дозе 5-8(15) мг/кг с 3-х кратным в/венным введением, курсом 5 дней. Возможно применение клиндамицина по 15-20 мг/кг/сут с 3-х кратным в/в. в/м введением или линкоцина в суточной дозе 30-60 мг/кг в/венно или в/мышечно через 8 часов. Со 2-ой недели лечения антибиотиками, назначают противогрибковые препараты - нистатин в суточной дозе 75000ЕД/кг, леворин 25мг/кг , 3-4 раза в день. В целях профилактики развития дисбактериоза назначают эубиотики - бифидум-бактерин по 5-10 доз. лактобактерин по 3 дозы в сутки. Иммунокоррегирующая терапия: а) создание пассивного иммунитета иммуноглобулин человеческий для в/венного введения от 3 до5 мл/кг (0,3 - 0,5 г/кг); иммуноглобулины направленного действия: антистафилококковый у- глобулин 20 АЕ/кг в сутки, ежедневно или через день, курс 5 дней; пентаглобин 5 мл/кг в/венно капельно курсом 3 дня; введение специфических антител с антистафилококковой, антисинегнойной плазмой 15 мл/кг; применение бактериофагов по 5 мл орально или по 10 мл ректально 3 раза в сутки; УФО и лазерное облучение крови; б) при изменениях в иммунограмме - лейкопения, лимфопения, снижение относительного и абсолютного числа Т и В лимфоцитов, а также индекса супрессии, показано назначение иммуномодуляторов и адаптогенов : тимолин 0,2-0,5 мг/кг (не более 1 мг в сутки), Т-активин до Змкг/кг, тимоген 10 мкг все выше указанные препараты назначаются 1 раз в сутки в/мышечно. Курс лечения 5-7 дней. Дибазол 1мг 1 раз в день, карнитина хлорид 20% по 5-10 капель 2-3 раза в день, нуклеинат натрия 5-10 мг 2-3 раза в день. Рибамунил по схеме. Адекватная дезинтоксикационная терапия: V= ЖП + ЖТПП + ЖВО (эксикоз 1ст. 10-12% - 50 мл/кг; Пет. 13-20% - 75 мл/кг; Шст>20% - 100мл/кг) В инфузии используют коллоидные препараты - свежезамороженную плазму, альбумин, реополиглюкин 10 мл/кг и кристаллоиды - 5, 7,5 и 10% глюкоза, физиологический и полиионные растворы (ацесоль). Коррекция КОС. Стабилизаторы клеточных мембран: вит. А, Е, АТФ, унитиол, аевит. Антигемморагическая терапия, направленная на укрепление сосудистой стенки - дицинон, адроксон. этамзилат по 10-15 мг/кг (0,1-0,2мл/кг). Назначение антипротеолитических препаратов: контрикал 1-2 тыс. ЕД/кг, гордокс 6-7 тыс. ЕД/кг в/венно курсом 5-7 дней. Противошоковая терапия: кислородное обеспечение; введение адреналина или изодрина 0,01% - 0,1 мл/кг; глюконат Са 1мл/кг; контрикал 2 тыс ЕД/кг; глюкокортикоиды, доза может быть увеличена в 10 раз от терапевтической; коррекция гиповолемии, метаболических и электролитных нарушений; нормализация гемодинамики: титрование дофамина, добутамина, доза которых зависит от характера гемодинамических расстройств. Симптоматическое лечение. На современном этапе в лечении сепсиса новорожденных используются гемосорбция, частичное или полное ЗПК, плазмоферез. | |||||||||||||||||||
