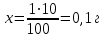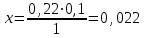Phenylii salicylatis ana 0,25
 Скачать 231.24 Kb. Скачать 231.24 Kb.
|
Простерилизовано! Натрия сульфита безводногоПриготовил (подпись) 1000 мл раствора – 2,0 Проверил (подпись) 50 мл – х1 Отпустил (подпись) х1 = 0,1 Воды для инъекций 50 – (2,5 0,61)+(1,11 0,3)=48,1 мл Технология лекарственной формы с теоретическим обоснованием. Изготовление инъекционного раствора ведется в соответствии с требованиями приказа МЗ РФ № 214 от 16.07.97 г. и № 308 от 21.10.97 г. и статьи ГФ ХI «Инъекционные лекарственные формы». Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97 г. Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97 г. Кислота аскорбиновая имеет в своей структуре ендиеновую группу с подвижными атомами водорода. Она при воздействии кислорода, находящегося в растворе и над его поверхностью переходит в 2,3 - дикетогулоновую кислоту, лишенную С- витаминной активности. О Н Н О2 ОН Н Н =  С – С – С – С – С – С – ОН О = С – С – С – С – С – С – ОН С – С – С – С – С – С – ОН О = С – С – С – С – С – С – ОН НО ОН Н ОН Н ОН О О Н ОН Н Для стабилизации применяют антиоксидант натрия сульфит безводный (2,0 на 1000 мл). С целью снижения болезненности инъекций к раствору добавляют натрия гидрокарбонат в эквивалентном количестве. Рассчитанные количества стабилизатора (натрия сульфата), натрия гидрокарбоната и кислоты аскорбиновой растворяют при перемешивании в 1/3 расчетного количества свежепрокипяченной воды для инъекций до окончания бурного выделения пузырьков углерода диоксида, затем добавляют еще 1/3 часть воды и перемешивают до полного растворения веществ. После окончания выделения пузырьков газа раствор доливают водой до требуемого объема и перемешивают. Раствор фильтруют через стерильный бумажный фильтр с подложенным под него комочком стерильной медицинской длинноволокнистой ваты в стерильный флакон нейтрального стекла вместимостью 50 мл. Флакон заполняют раствором доверху. Изготовленный раствор подвергают полному химическому контролю до и после стерилизации. (Для этого во флакон из стеклодрота отливают 2-3 мл раствора. Флакон укупоривают «под обкатку», стерилизуют вместе с основным флаконом. После стерилизации раствор из флакона используют для проведения полного химического анализа.) Кроме того, флакон с раствором просматривают невооруженным глазом на отсутствие механических включений на белом и черном фоне, освещенном электрической лампочкой матового стекла мощностью 40 Вт. Причем проверка на отсутствие механических включений проводится также дважды: до и после стерилизации. После первичной оценки на отсутствие механических включений и положительного химического анализа флакон укупоривают стерильной резиновой пробкой с металлическим колпачком «под обкатку», пробку обвязывают пергаментной бумагой. На обвязке надписывают простым карандашом состав, концентрацию раствора и фамилию лица, изготовившего раствор. Проверяют качество укупорки. Стерилизацию раствора проводят насыщенным паром при температуре 120С в течение 8 мин в паровом стерилизаторе. После стерилизации вторично проводят полный химический контроль, вторично проверяют на отсутствие механических включений и качество укупорки. Упаковка и оформление. Флакон с готовым раствором в соответствии с требованиями приказа МЗ РФ № 120 от 05.09.97г. оформляют этикеткой «Для инъекций», на которой кроме общих для всех этикеток пунктов указывают: «Раствор кислоты аскорбиновой 5% 50 мл. Для внутримышечного введения по 2 мл 1 раз в день» и указывают номер анализа. Предупредительные Срок хранения укупоренного «под обкатку» в аптеке составляет 30 с уток при температуре не выше 25С, в защищенном от света месте. Оценка качества. Оформление соответствует требованиям приказа МЗ РФ № 120 Полный химический контроль № 214 Отклонения в объеме 4% (от 48 до 52 мл.) Стерильность, апирогенность. Применение. Применяют при гипо- или авитаминозах витамина С. № 59. 1. Recipe: Solutionis Coffeini – natrii benzoatis 20% 25 мл Sterilisetur! Da. Signa: Для подкожного введения по 2 мл 2 раза в день. 4.Характеристика лекарственной формы. По определению ГФ XI лекарственные средства для парентерального применения – стерильные водные и неводные растворы, суспензии, эмульсии и сухие твердые вещества (порошки, пористые массы, таблетки), которые растворяют в стерильном растворителе непосредственно перед введением. Данная лекарственная форма представляет собой истинный водный стерильный раствор для инъекционного применения, в состав которого входит вещество списка Б. По дисперсологической классификации – свободнодисперсные системы с жидкой дисперсионной средой и максимально измельченной дисперсной фазой (гомогенная система) – раствор. 5. Проверка доз веществ списка А и Б и норм одноразового отпуска. Кофеин – бензоат натрия – сп.Б В.р.д. под кожу 0,4 В.с.д. под кожу 1,0 В 2 мл 20% раствора содержится 0,4 кофеина бензоата натрия. Р.д. – 0,4 С.д. – 0,4 2 = 0,8 -Дозы не завышены. Веществ, имеющих нормы одноразового отпуска, в прописи нет. 6. Паспорт письменного контроля. Лицевая сторона Оборотная сторона Дата № рецепта Кофеина бензоата натрия 5,0 Aquae purificatae 21,65 ml Раствора едкого натра 0,1М – Solutionis natrii hydroxydi 0,1 М-0,1ml 0,1 мл – 2 капли Coffeini – natrii benzoatis 5,0 Воды для инъекций Объем 25 ml 25 – (5,0 0,65) – 0,1 = 21,65 мл Простерилизовано 7. Технология лекарственной формы с теоретическим обоснованием. Рабочее место № 309. Изготовление раствора статьи ГФ ХI «Инъекционные лекарственные формы», № 308, приказом МЗ РФ № 214. В рецепте прописан раствор для подкожного введения, в состав которого входит вещество легко растворимое в воде и являющееся солью сильного основания и слабой кислотой. Инъекционные растворы кофеина бензоата натрия нуждаются в стабилизации 0,1 М раствором едкого натрия, т.к. для подавления гидролиза подобных растворов солей необходимо добавлять щелочь. При расчете количества воды для инъекций необходимо учитывать, что концентрация кофеина бензоата натрия превышает 3% и согласно приказа МЗ ЗФ № 308 от 97г. необходимо учитывать коэффициент увеличения объема. В асептических условиях в стерильной подставке в 21,65 мл воды для инъекций растворяют 5,0 г кофеина бензоата натрия (сорта х.ч.), добавляют 0,1 мл 0,1 М раствора едкого натра. Приготовленный раствор фильтруют в склянку для отпуска емкостью 30мл из нейтрального стекла через двойной стерильный беззольный фильтр с подложенным комочком длинноволокнистой ваты. Флакон укупоривают стерильной резиновой пробкой, обкатывают металлическим колпачком, маркеруют. Проверяют раствор на прозрачность, отсутствие механических включений, цветность. Затем раствор стерилизуют в автоклаве при температуре 120С 8 минут. После стерилизации и охлаждения раствор передают на контроль повторно. 8. Упаковка и оформление.Флакон прозрачного нейтрального стекла укупорен герметично резиновой пробкой «под обкатку». 9. Оценка качества. Упаковка и оформление соответствует требованиям приказа МЗ РФ № 120. Объем лекарственной формы 25 1 мл, что соответствует нормам допустимых отклонений ( 4%) по приказу МЗ РФ № 305 от 16.10.97г. 10. Применение. Кардиотоническое средство. № 60. 1. Recipe: SolutionisPilocarpinihydrochloridi 1% 10 ml Sterilisetur! D.S. По 2 капли в правый глаз. 4.Характеристика лекарственной формы. Выписана жидкая лекарственная форма- глазные капли, представляющая собой водный истинный раствор вещества списка А. 6. Паспорт письменного контроля. Выдал: Pilocarpinihydrochloridi 0,1г (один дециграмм) Дата подпись Получил: Pilocarpinihydrochloridi 0,1г (один дециграмм) Дата подпись
7. Технология лекарственной формы с теоретическим обоснованием. Рабочее место № 309. Изготовление капель ГФ ХI «Капли глазные». ППК № 214. В асептических условиях в 5 мл воды очищенной растворяют 0,1г пилокарпина гидрохлорида. (Вещество сп. А - пилокарпина гидрохлорид, отвешивает провизор-технолог в присутствии ассистента. Об этом делается отметка в ППК и на оборотной стороне рецепта.) Затем отвешивают 0,07 г натрия хлорида и растворяют. Раствор фильтруют во флакон для отпуска через стерильный фильтр, промытый водой очищенной. Фильтр промывают 5 мл воды очищенной с целью сохранения концентрации и объема раствора. Раствор проверяют на отсутствие механических включений, укупоривают «под обкатку» и стерилизуют при 120С – 8 минут. 8. Упаковка и оформление. Флакон из стеклодрота оформляют этикеткой розового цвета для глазных капель, на которой указывают номера аптеки, рецепта, ФИО больного, способ применения. Наклеивают предупредительные этикетки: «Хранить в прохладном и защищенном от света месте», «Стерильно», «Обращаться с осторожностью», «Беречь от детей». (Пилокарпин не находится на предметно-количественном учете). 9. Оценка качества. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97г. Объем капель соответствует 10,0 1,0мл (приказ МЗ РФ № 305 от 16.10.97г.). 10. Применение. Миотическое средство. Используется при глаукоме. № 61. 1. Recipe: Веnzylhenicillini – natrii 500 000 ED Solutionis Natrii chloridi guantum satis 20 ml Da. Signa: Капли в нос. 4.Характеристика лекарственной формы. Выписана жидкая лекарственная форма, представляющая собой водный раствор антибиотика. Паспорт письменного контроля. Лицевая сторона Оборотная сторона Aquae purificatae 20,0 - Бензилпенициллина Natrii chloridi 0,18 1 000 000 ЕД – 0,65 г Sol. Natrii chloridi 0,9% 500 000 EД – x г Sterilis 20,0 х = 0,33 г Benzylpenicillini – natrii 0,33 - Натрия хлорида V общ. = 20 ml 0,9 – 100 мл х – 20 мл х = 0,18 г Приготовил (подпись) С % сухих веществ в рецепте Проверил (подпись) (0,18 + 0,33)х 5 = 0,51 х 5 = 2,55%, Отпустил (подпись) что меньше 3% КУО не используют. Объем воды очищенной 20 мл. 7.Технология лекарственной формы с теоретическим обоснованием. Рабочее место № 309. Изготовление капель ГФ ХI «Капли глазные». ППК № 214. Капли с антибиотиками приготавливают в асептических условиях (во- первых, бензилпенициллин не выдерживает тепловой стерилизации, во-вторых, бензилпенициллин поступает в аптеки в виде стерильного порошка). В асептических условиях в 10 мл воды очищенной растворяют 0,18 г натрия хлорида. Раствор фильтруют через стерильный фильтр, промытый водой во флакон для отпуска. Фильтр промывают 10 мл воды очищенной (таким образом концентрация и объем раствора будут соответствовать прописанным в рецепте). Раствор стерилизуют при 120С – 8 мин без антибиотика, так как он термолабилен. Стерильный антибиотик растворяют в растворе натрия хлорида в асептических условиях. Флакон укупоривают «под обкатку». 8. Упаковка и оформление. Флакон из стеклодрота оформляют этикеткой желтого цвета, на которой указывают номера аптеки, рецепты, ФИО больного, способ применения. Наклеивают предупредительные этикетки: «Хранить в прохладном, защищенном от света месте», «Приготовлено асептически», «Беречь от детей». 9. Оценка качества. Упаковка и оформление соответствует требованиям приказа МЗ ЗФ № 120 -Объем раствора 10,0 1,0 соответствует требованиям приказа МЗ РФ № 305 от 16.10.97г. Капли бесцветные, механические включения отсутствуют. 10.Применение. Антимикробное средство. № 62. 1. Recipe: Solutionis Riboflavini 0,01% 10 ml Sterilisetur! Da. Signa: По 2 капли в оба глаза. Характеристика лекарственной формы. Выписана жидкая лекарственная форма, представляющая собой истинный водный раствор малорастворимого вещества, витамина В2. Паспорт письменного контроля. Лицевая сторона Оборотная сторона Дата № рецепта Aquae purificatae 5 ml - Рибофлавин Natrii chloridi 0,09 0,01 г – 100 мл раствора Sol. Natrii chloridi 5 ml х г – 10 мл раствора Sterilis! х = 0,001 г Sol. Riboflavini 0,02% 5,0 ml - концентрат рибофлавина 0,02% V общ. = 10 мл 0,02 г – 100 мл 0,001 г – х мл х = 5 мл Приготовил (подпись) натрия хлорид для изотонирования Проверил (подпись) раствора Отпустил (подпись) 0,9 г – 100 мл х – 10 мл х = 0,09 г - Объем воды 10 – 5 = 5,0 мл Технология лекарственных форм с теоретическим обоснованием. Рабочее место № 309. Изготовление глазных статьи ГФ XI «Капли глазные». ППК № 214 от 16.07.97 г. Глазные капли приготавливают в асептических условиях. В аптеке имеется стерильный 0,02% раствор рибофлавина (внутриаптечная заготовка), поэтому капли изготавливают следующим образом: В 5 мл воды очищенной растворяют 0,09 г натрия хлорида. Раствор фильтруют через стерильный фильтр, промытый водой во флакон для отпуска. Раствор просматривают на отсутствие механических включений, укупоривают и стерилизуют при 121С – 8 мин. (Капли, прописанные в рецепте необходимо изотонировать, т.к. они гипотоничны). После стерилизации и охлаждения раствора, флакон вскрывают в асептических условиях, и добавляют 5 мл стерильного 0,02% раствора рибофлавина. Флакон укупоривают «под обкатку». Упаковка и оформление. Флакон из стеклодрота оформляют этикеткой розового цвета, на которой указывают номера аптеки, рецепта, Ф.И.О. больного, способ применения. Наклеивают предупредительные этикетки: «Хранить в прохладном и защищенном от света месте», «Приготовлено асептически», «Беречь от детей». Оценка качества. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 Отклонение в объеме 10,0 (от 9 до 11 мл) в соответствии с требованиями приказа МЗ РФ № 305 от 16.10.97 г. № 63. Recipe: Solutionis Соllargoli 2,0% - 10ml Da. Signa: Капли в нос для новорожденного 4. Характеристика лекарственной формы. Жидкая лекарственная форма для новорожденного, представляющая собой коллоидный раствор препарата оксида серебра, защищенного белком, светочувствительный. Данные капли предназначены для наружного применения. По дисперсологической классификации - свободная всесторонне - дисперсная система с жидкой дисперсионной средой. 5. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием. Рабочее место № 309. Изготовление ведут № 308. ППК №214. Раствор готовят в асептических условиях в массообъемной концентрации. Колларгол содержит 70-80% серебра оксида, остальное количество - продукты гидролиза белка. В ступку помещают колларгол и растирают с небольшим количеством воды очищенной простерилизованной (воду предварительно стерилизуют, так как потом раствор стерилизовать нельзя). Раствор процеживают через рыхлый стерильный тампон. Зольную бумагу использовать не рекомендуется, так как зольные элементы бумаги вызывают коагуляцию колларгола, и снижение концентрации препарата в растворе. 8. Упаковка и оформление. Приготовленный раствор помещают в отпускной флакон темного стекла (колларгол-светочувствителен), укупоривают плотно пластмассовой пробкой с навинчивающейся крышкой. Оформляют этикеткой «Наружное», предупредительными надписями «Хранить в прохладном, защищенном от света месте». «Перед употреблением взбалтывать», «Беречь от детей», «Детское», «Приготовлено асептически». Наклеивают номер рецепта. 9. Оценка качества.Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120; - Объем лекарственной формы 10,0 ± 0,8 мл, что соответствует нормам допустимых отклонений (±8%) (приказ МЗ РФ № 305 от 16.10.97 г). Применяют как вяжущее, антисептическое и противовоспалительное средство. № 64. 1. Recipe: Solutionis Glucosi 5% 50 ml Da. Signa: Для питья новорожденному. Характеристика лекарственной формы Прописана жидкая лекарственная форма, стерильный истинный раствор легкоокисляющегося вещества – глюкозы для внутреннего применения новорожденному. Паспорт письменного контроля. Лицевая сторона Оборотная сторона Дата № рецепта Глюкозы Ag. Purificatae 50,0 5,0 – 100,0 Glucosi 2,77 Х – 50 х = 2,5 V = 50 ml Глюкозы с учетом влаги 10% Приготовил (подпись)  Проверил (подпись) Cmax = 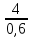 = = 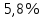 КУО не используют КУО не используютОтпустил (подпись) 7. Технология лекарственной формы с теоретическим обоснованием. Рабочее место № 309. Изготовление раствора для новорожденных ведут в соответствии с Методическим письмом ГАПУ МЗ РСФСР № 42. ППК № 214. В 50,0 мл свежеперегнанной свежепрокипяченной воды, в асептических условиях, растворяют 2,77 г глюкозы (глюкоза – легкоокисляющаяся вещество). Раствор фильтруют через стерильный фильтр, промытый водой во флакон для отпуска. Раствор просматривают на отсутствие механических включений, укупоривают «под обкатку» и стерилизуют при 121 8 мин. Стабилизаторы при изготовлении растворов для новорожденных для внутреннего применения не используются. 8. Упаковка и оформление. Флакон оформляют этикеткой зеленого цвета, на которой указывают № аптеки, рецепта, способ применения. Наклеивают предупредительные этикетки: “Для новорожденных”, “Стерильно”, “Хранить в прохладном защищенном от света месте”, “Беречь от детей”. 9. Оценка качества. Упаковка и оформление соответствуют требованиям приказа МЗ ЗФ № 120 от 05.09.07г. Раствор бесцветный, без механических включений. Отклонение в объеме 4% (от 48 до 52 мл) в соответствии с требованиями приказа МЗ РФ № 305 (от 16.10.97 г.). 10. Применение. Раствор для питья новорожденным. |