Ответы на лабы по физике. Под светом в узком смысле
 Скачать 2.8 Mb. Скачать 2.8 Mb.
|
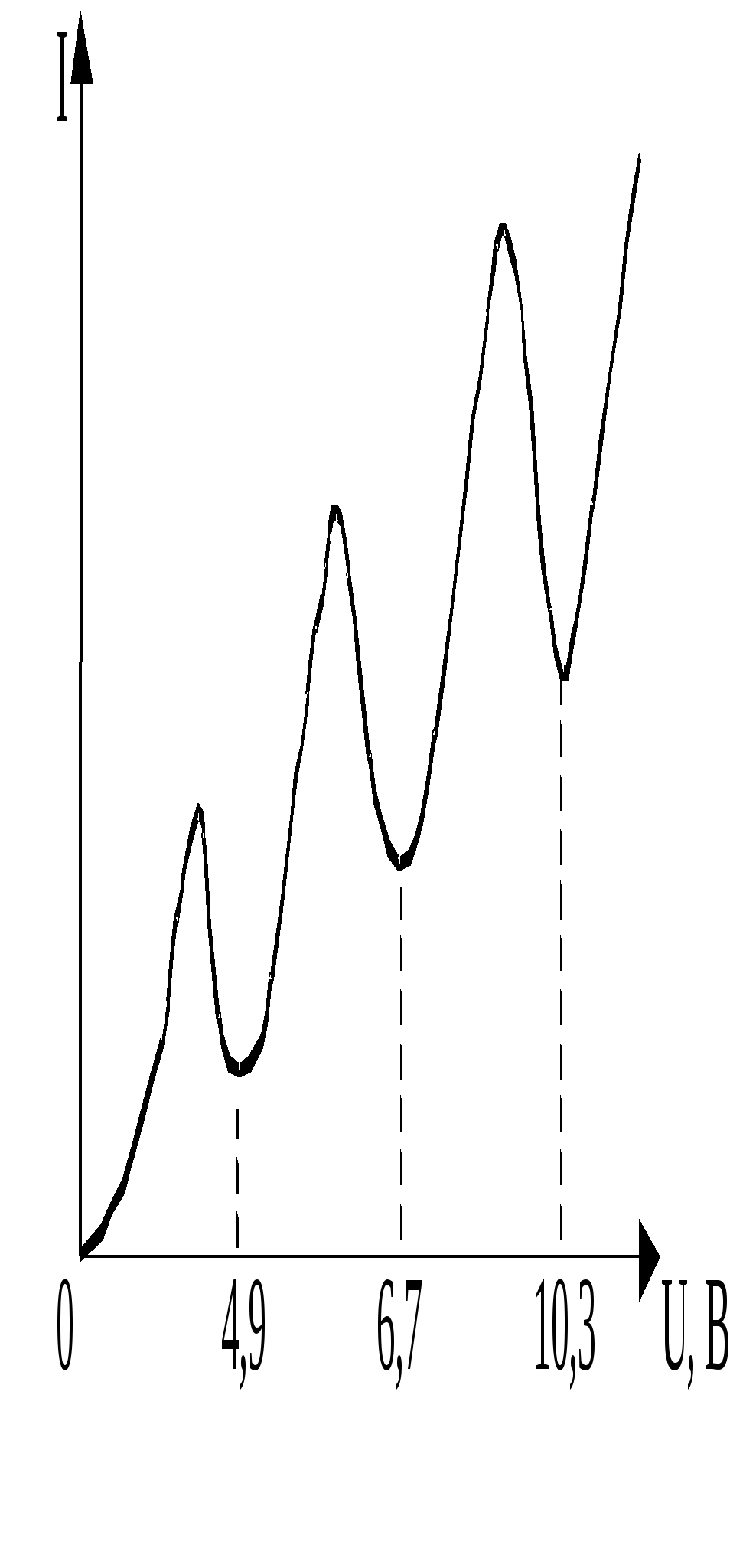
Д триод, наполненную парами ртути, они обнаружили провалы на вольтамперной характеристике I(U). Эти провалы, т. е. снижения силы тока при некоторых значениях напряжения между анодом А и сеткой С, были объяснены ими как результат неупругого соударения носителей тока – электронов с атомами ртути7. Сетка С, на которую подавался небольшой, порядка 0,5 В положительный потенциал относительно анода, «перехватывала» «ослабевшие» электроны, потерявшие свою кинетическую энергию в результате неупругих соударений с атомами ртути. Соответственно на анод попадало меньше электронов, что и проявляло себя в уменьшении анодного тока. Атомы ртути могли воспринять (забрать) от электронов лишь определенную энергию, кратную энергии их возбуждения. Если пары ртути достаточно разрежены, то столкновения ускоряемого электрическим полем электрона с атомами ртути достаточно редки. Электрон успевает накопить энергию достаточную для возбуждения атомов ртути не только в ближайшее, но и более высокие возбужденные состояния. При этом атомы ртути переходят в возбуждённые состояния, отстоящие от основного по энергии на 4,9 эВ; 6,7 эВ; 10,3 эВ… . Это говорит о том, что энергия атома ртути обладает дискретным спектром значений.В более плотных парах второй минимум тока на ВАХ объясняется тем, что электрон ускоренный до энергии, в два раза превышающей энергию возбуждения, оказывается в состоянии достаточно быстро произвести последовательное возбуждение двух атомов ртути. Поэтому первый и второй минимумы тока на ВАХ отстоят на величину, равную первому потенциалу возбуждения. 3. Чем объясняется упорядоченность линий в спектре излучения водородоподобных атомов? Почему разные серии не перекрываются друг с другом? Вытекающая из теории Бора дискретная структура энергетических уровней электрона в атоме позволяет объяснить закономерности в спектре излучения атома водорода. Из опыта известно, что спектр теплового излучения невзаимодействующих атомов имеет дискретный характер в виде совокупности отдельных спектральных линий, которые определённым образом упорядочены в некоторые группы, называемые сериями. Такая сериальная упорядоченность спектра излучения атома водорода описывается обобщённой формулой Бальмера: n - номер спектральной серии; n = 1, 2, 3 … m - номер спектральной линии в серии; m = n + 1, m + 2 … При n = 1; = При n = 2; = n 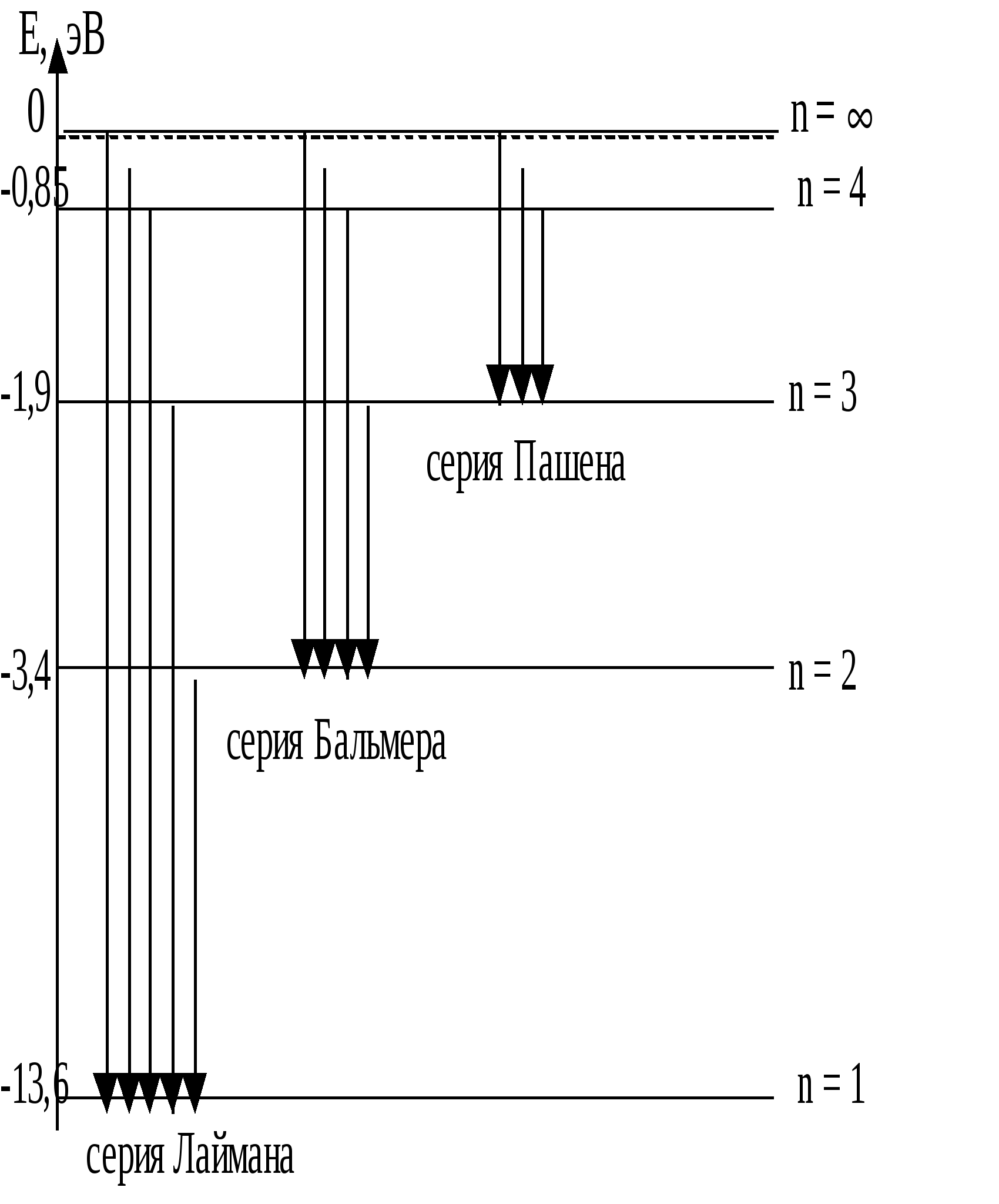 = 3; = Наглядное представление механизма образования сериально упорядоченного линейчатого спектра атома водорода дано на схеме его энергетических уровней. 4. Объясните вывод из теории Бора обобщённой формулы Бальмера. Теория Бора позволяет просто получить и саму обобщённую формулу Бальмера. Выразим из правила частот Бора 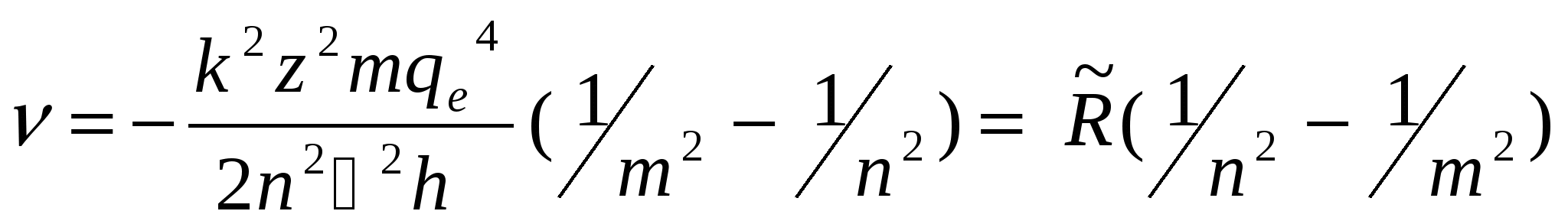 Сравнивая с формулой Бальмера, видим, что постоянная Ридберга  при Z = 1. Подставляя их значения, получим для при Z = 1. Подставляя их значения, получим для Формулу Бальмера часто записывают не для частоты , а для обратной длины волны 1/. Из = с/ 1/ = /с = ( Спектральная линия с наибольшей длиной волны в данной серии называется ее головной линией, а с наименьшей длиной волны – границей серии. 5. Каким образом по спектру излучения можно определить сорт атома? В атомарном, газообразном состоянии вещество обладает дискретным (линейчатым) спектром, как излучения, так и поглощения. Этот спектр является своего рода паспортом соответствующего химического элемента, то есть он индивидуален, неповторим для атома каждого химического элемента. Это позволяет проводить качественный спектральный анализ, то есть осуществлять идентификацию (определение) атома по его спектру. Для этого имеются специальные каталоги, в которых содержатся таблицы спектральных линий известных атомов. 6. Каков физический механизм излучения света исследуемых в работе газов в трубках? В газоразрядных трубках используется механизм возбуждения атомов газа электронным ударом (бомбардировкой). В исследуемых трубках содержится газ тех или иных атомов под пониженным давлением. К электродам трубки прикладывается достаточно высокое напряжение, вызывающее разряд в газе, то есть прохождение через него электрического тока. Ускоряемые электрическим полем электроны, соударяясь с атомами газа, возбуждают их, переводя в состояния с повышенной энергией. Такое состояние является неустойчивым, и атомы самопроизвольно возвращаются в исходное состояние с меньшей энергией, отдавая энергию возбуждения в виде квантов света. 7. Дайте объяснение полученным в работе результатам, включая расчётное задание. Работа N 50 ОПЫТ ФРАНКА – ГЕРЦА 1. Какие проблемы атомной физики, и каким образом пытался разрешить Н. Бор с помощью своих постулатов? Резерфорд, исходя из своих опытов, выдвинул новую модель строения атома, названную ядерной или планетарной. В ней атом состоит из массивного положительного ядра малых размеров порядка В теоретическом плане ядерная модель атома, порождённая опытом, оказалась противоречащей основным положениям классической электродинамики; вращающийся вокруг ядра электрон представляет собой заряженную частицу, движущуюся с ускорением, и должен был излучать энергию в виде электромагнитных волн. Но, излучая энергию, т. е. теряя в итоге запас своей энергии, электрон спустя короткое время (по расчётам, порядка Так же, как и при анализе закономерностей теплового излучения, надо было приводить в очерёдное соответствие прежнюю теорию с новым опытом. Такое реформирование теории первоначально было проведено Н. Бором. В основу теории, исходящей из ядерной модели атома и объясняющей его основные опытные свойства и, прежде всего устойчивость и дискретный спектр излучения, Н. Бор положил два постулата (принципа): Постулат стационарных состояний8 (орбит) – в атоме существуют некоторые особые стационарные состояния, находясь в которых электрон вращается вокруг ядра по круговым орбитам и не излучает, хотя и движется с ускорением (центростремительным). Этим постулатом Н. Бор, не покушаясь на справедливость теоретических основ классической физики, допускал исключение из общего правила в виде особых состояний атома с круговыми орбитами электрона в них. Бор установил (догадкой) правило определения стационарных круговых орбит электрона – так называемое правило квантования орбит. Оно утверждает необходимость целочисленности в постоянных Планка Правило частот. Излучение и поглощение энергии атомом происходит при переходе электрона с одной стационарной орбиты на другую9. Частота излучения (поглощения) определяется из условия энергетического баланса: 2. Как де Бройль «объяснил» правило Бора квантования орбит электрона в атоме водорода? Де Бройль использовал представление о волнах (де Бройля) для наглядного представления таинственного правила квантования орбит Бора в случае одноэлектронного атома. Он рассматривал волну де Бройля, бегущую вокруг ядра по круговой орбите электрона. Если на длине орбиты 2r длина волны укладывается целое число раз, то при обходе ядра она будет всякий раз возвращаться в исходную точку с той же фазой и амплитудой. В каждой точке орбиты установится неизменный во времени колебательный режим стоячей волны (не переносящей энергию), и не возникнет излучения, что и есть условие стационарности орбиты. Исходя из этих соображений, де Бройль записал условие стационарности орбиты или правило квантования, в виде: 2r/ = n, где n = 1, 2, 3… Полагая, что = h/р и замечая, что pr = L (L – момент импульса электрона), получим: 2rр/h = n L = n 3. Охарактеризуйте физическую сущность и значимость в атомной физике опыта Франка – Герца. |