Получение и анализ качества лекарственных препаратов производных тиазина
 Скачать 1.13 Mb. Скачать 1.13 Mb.
|
|
Описание. Круглые двояковыпуклые таблетки, покрытые пленочной оболочкой белого с желтоватым оттенком цвета (для дозировки 25 мг), коричнево-розового цвета (для дозировки 50 мг), от красновато-коричневого до коричневого цвета (для дозировки 100 мг). На поперечном разрезе ядро белого или почти белого цвета. Однородность массы. Определяем путем взвешивания 20 таблеток: взвешиваем каждую единицу в отдельности с точностью до 0,001г. Далее рассчитываем среднюю массу. Oтклонения отдельной таблетки от средней массы рассчитывали в % по формуле 1: 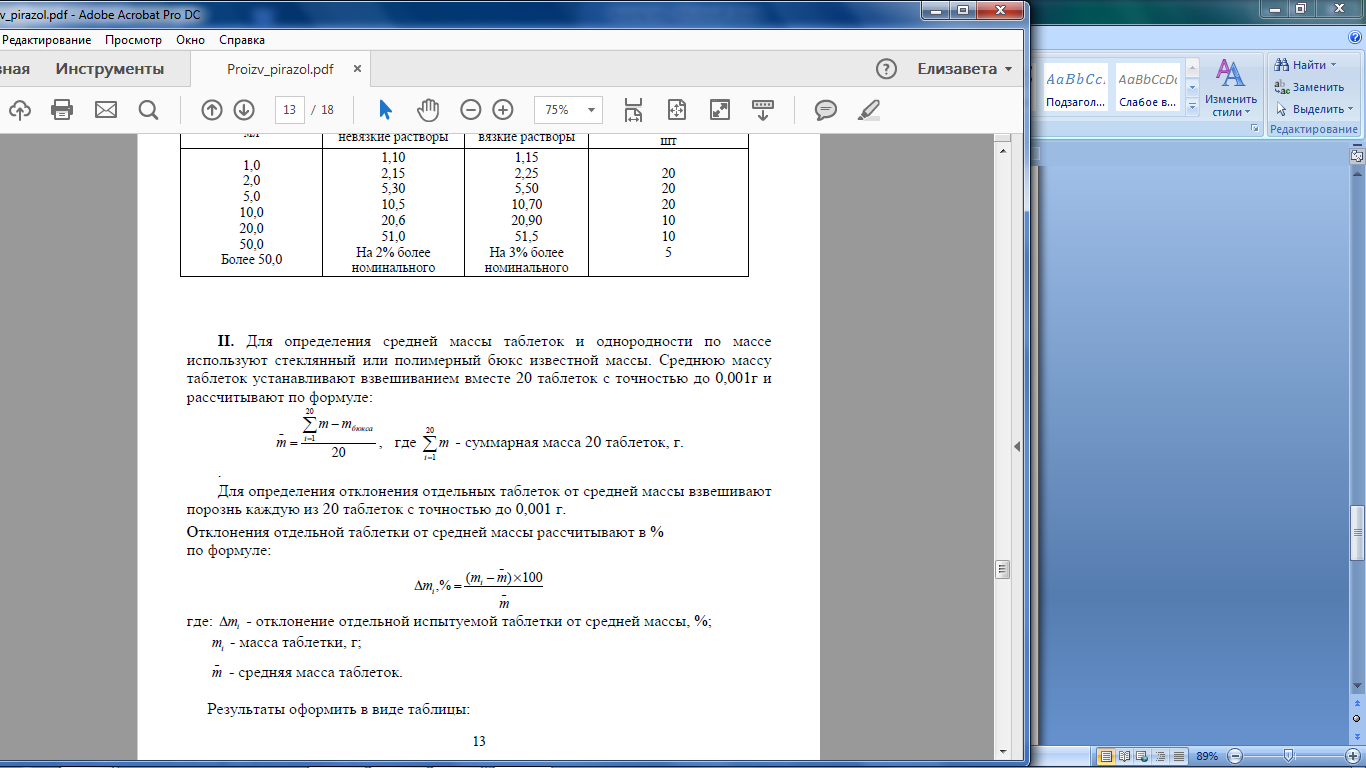 , (1) , (1)где: Δ m1- отклонение отдельной испытуемой таблетки от средней массы,%; m1- масса таблетки, г; mср - средняя масса таблеток. Допустимое отклонение от средней массы дозированных лекарственных форм составляет ±5% Анализ таблеток на подлинность. 1 Цветные реакции хлорпрмазина с бромной водой 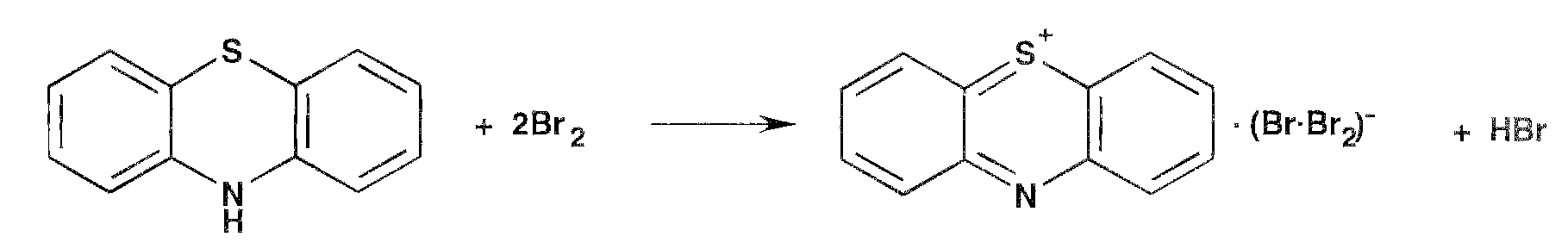 Рис. 7 Цветные реакции с бромной водой Эффект реакции Прозрачный светло – малиновый раствор 2. Реакции хлорпрмазина с азотной кислоты возникает пурпурно-фиолетовая окраска.  Количественное определение К основное титрование в неводных средах т.к. производные фенотиазина проявляют слабые основные свойства, то их можно определить кислтно-основным титрованием в неводных средах. Среда: ацетон (пропазин, аминазин), бензол (этмозин) Индикатор: м/о в ацетоне (среда ацетон), аминазин, пропазин до розового окрашивания Крист. Фиолетовый (среда ледяная H3C-COOH) Э=Мм. 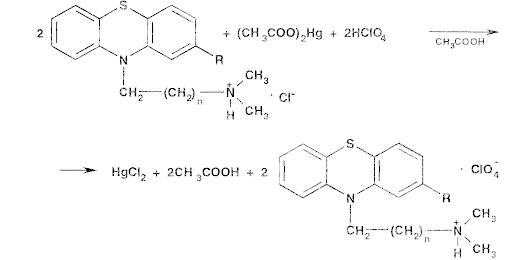 2. Алкалиметрический метод – основан на свойстве сильной минеральной щелочи вытеснять из соли более слабое органическое основание. 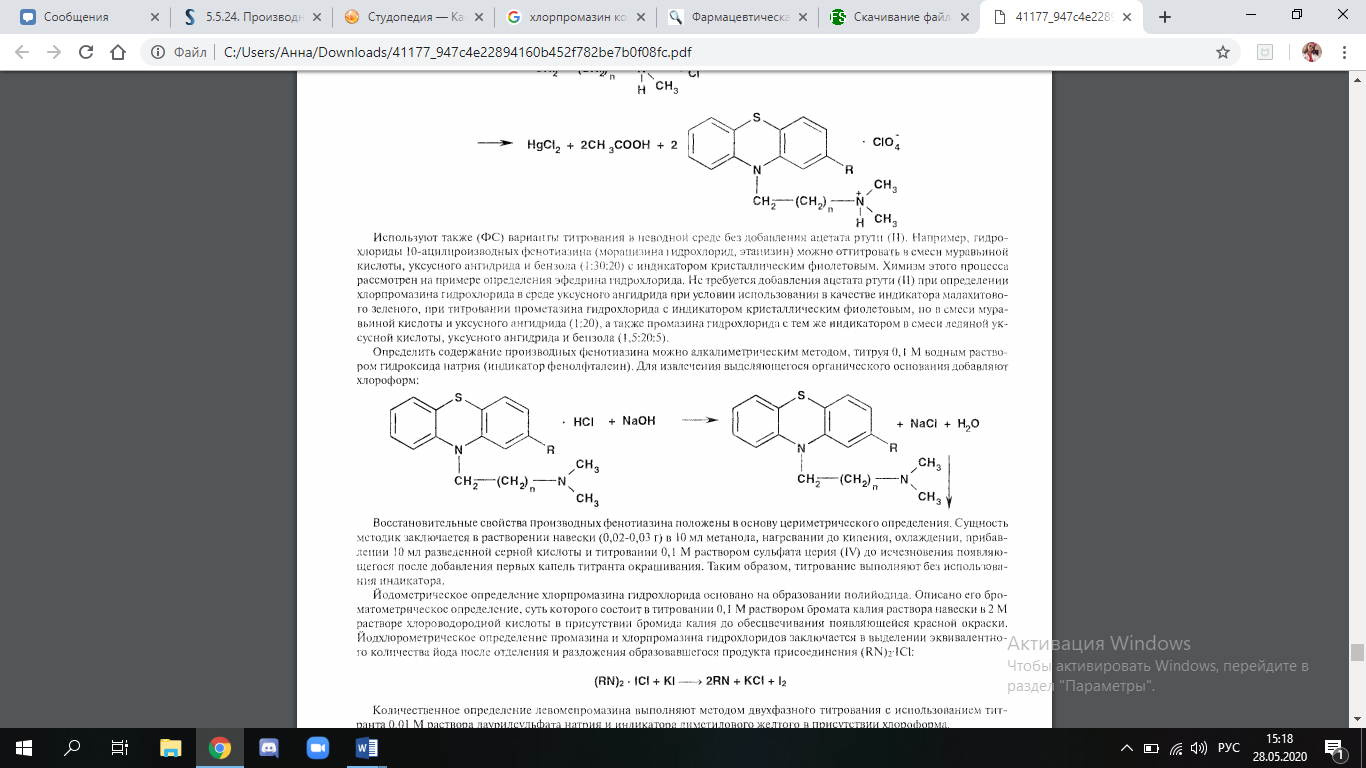 Титрант – 0,1 М раствор NaOH; Индикатор – фенолфталеин Для извлечения выделяющегося органического основания добавляют хлороформ. 3. Йодхлорометрический метод – основан на выделение эквивалентного количества йода после отделения и разложения образовавшегося продукта присоединения (RN)2 * ICl: (RN)2 * ICl + KI = 2RN + KCl + I2 4. Фотоколориметрический метод - определение основано на реакции с концентрированной серной кислотой. Фотометрирование проводят при λ = 508 нм; эталон сравнения – контрольный опыт. Расчет содержания аминазина и его метаболитов производится по калибровочному графику. 5. Спектрофотометрический метод – основан на законе Бугера-Ламберта-Бера. Ультрафиолетовый спектр снимается в диапазоне длин вол 220-400 нм на СФ-4, СФ-4А и др. при концентрации 10 мкг/мл в пересчете на основание. Максимумы абсорбции неизмененного аминазина при λmax = 254-255 нм (макс.) и λmin = 300-305 нм (мин). Основной метаболит – сульфоксид – имеет максимумы абсорбции при длинах волн 238-240, 273; 298 и 340 нм. Контроль качества таблеток «Аминазин» по показателям: упаковка, маркировка В соответствии с требованиями ГФ XIV статьи ОФС.1.4.1.0015.15. «Упаковка» , «Маркировка» [8], а также, Федеральным законом № 61-ФЗ «Об обращении лекарственных средств» на потребительской упаковке хорошо читаемым шрифтом на русском языке должны быть указаны [19]: 1.наименование лекарственного препарата (международное непатентованное или химическое и торговое наименования), 2.наименование производителя лекарственного препарата, 3.номер серии, номер регистрационного удостоверения, 4.срок годности, 5.способ применения, 6.доза и количество доз в упаковке, 7.форма выпуска, 8.условия отпуска, условия хранения. Вывод: После проведенного анализа было установлено, что лекарственный препарат отвечают требованиям ФЗ № 61 по статье 46 «Маркировка лекарственных средств». Выводы Проведено изучение связи между структурой и фармакологическим действием производных фенотиазида. Проведен анализ методов получения и свойств лекарственных препаратов, производных фенотиазида . При проведении анализа состава готовых лекарственных форм хлорпромазина было выявлено, что лекарственные препараты выпускаются в виде таблеток, раствора для инъекций, драже имеют различный состав, одинаковое количество действующего вещества, и обладают анксиолитическим действием. При сравнительной характеристике фармакопейной статьи на диазепам ГФ X и BP 2012 были выявлены некоторые различия. Также были рассмотрены причин появления примесей, указанных в ВР 12. Предложены реакции на подлинность лекарственного препарата «Аминазин» 100мг №20, содержащего в качестве действующего вещества- диазепам, а также количественный анализ таблеток. Список используемых источников 1.Анализ лекарственных средств по функциональным группам. Учебное пособие/под общей ред. Профессора Л.А. Чекрышкиной.- Пермь, 2012-123 с. 2. Арзамасцев, А.П. Большая российская энциклопедия лекарственных средств: в 2 т. / А.П. Арзамасцев, А.А. Баранов, Ю.Н. Беленков и др. – М.: Ремедиум, 2002. – 1384 с. Реестр Лекарственных средств. Режим доступа: http://www.rlsnet.ru/ 3. Беликов В.Г. Фармацевтическая химия. В 2 ч. Ч.1. Общая фармацевтическая химия. Ч.2. Специальная фармацевтическая химия: Учеб. для вузов. - изд. третье, пере раб. и доп. - Пятигорск: ПятГФА, 2003 – 720 с. Режим доступа: http://www.studmedlib.ru 4. Борисова Т.Н., Варламов А.В., Сорокина Е.А., Воскресенский Л.Г., Никитина Е.В. Основы неорганической химии. М.: МГУ. 2007. 145 с. Режим доступа: http://www.studmedlib.ru 5. Государственная фармакопея СССР. / МЗ СССР. – 11 – е издание. – М.: Медицина, 1987. – Вып. 1. – 336 с. 6. Государственная фармакопея СССР. / МЗ СССР. – 11 – е издание. – М.: Медицина, 1989. – Вып. 2. – 400 с. 7. Государственная фармакопея Российской Федерации / 13 – издание. – «Издательство «НЦЭСМП», 2008. – 704 с. 8. Дудко В.В., Тихонова Л.А. Анализ лекарственных веществ по функциональным группам. – Томск, 2004. – 137 с 9. Краснов Е.А., Блинникова А.А., Физико-химические методы в анализе лекарственных средств: Учебное пособие. – Томск, 2011. – 168 с. 10. Кулешова М.И. Анализ лекарственных форм, изготовляемых в аптеке [Текст] / Кулешова М.И Гусева Л.Н., Сивицкая О.К. 2-е изд., перераб. и доп. - М.: Медицина. Москва 2007. - 285 с.; 11. Лебедева М.И. Аналитическая химия [Текст]: учеб. пособие / Лебедева М.И. - М.: ТГТУ. Тамбов 2008. - 160 с.; 12. Лидин Р.А. Химические свойства неорганических веществ [Текст]: учеб. пособие / Лидин Р.А., Андреева А.А., Молочко В.А. 3-е изд., испр. - М.: Химия 2013. - 480 с; 13. Общие фармакопейные методы анализа [Текст]: учеб. пособие. Изд. 4-е, перераб. и доп. - Пермь 2013. - 121 с.; 14. Плетнева Т.В. Контроль качества лекарственных средств [Электронный ресурс]: учебник / под ред. Плетневой Т.В. - М.: ГЭОТАР-Медиа, 2014. - 560 с. Режим доступа: http://www.studmedlib.ru; 15. Попков В.А. Общая химия [Электронный ресурс] / В.А. Попков, С.А. Пузаков. - М.: ГЭОТАР-Медиа, 2010. - 976 с. Режим доступа: http://www.studmedlib.ru; 16. Международная фармакопея издание 3, том 2, 40с 17. Общие фармакопейные методы анализа (избранные главы). Учебное пособие. Изд. 4-е, перераб. и доп. – Пермь, 2013 г. - 121 с. 18. Тыжигирова В.В., Филиппова С.Ю.Применение ИК– и УФ– спектроскопических методов в фармацевтическом анализе. Учебное пособие по фармацевтической химии для студентов фармацевтического факультета. Иркутск, 2010. 45 с. 19. Фармацевтическая химия: Учеб. пособие/ под ред. А.П. Арзамасцева.-2-е изд., испр.- М.: ГЭОТАР – Медицина, 2008.- 640 с Режим доступа: http://www.studmedlib.ru. 20. Фармацевтическая химия учебник / под ред. Г. В. Раменской. — Эл. изд. - 470 с.). — М. : БИНОМ. Лаборатория знаний, 2015. Приложение 1 48. Aminazinum Аминазин Chlorpromazini Hydrochloridum * 2-Хлор-10- (3-диметиламинопропил) -фенотиазина гидрохлорид 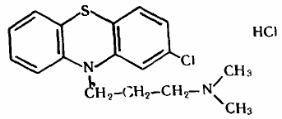 C17H19C1N2S * HC1 M. в. 355,33 Описание. Белый или белый со слабым кремовым оттенком мелкокристаллический порошок. Слегка гигроскопичен, темнеет на свету. Растворимость. Очень легко растворим в воде, легко растворим в 95% спирте и хлороформе, практически нерастворим в эфире и бензоле. Подлинность. 0,05 гпрепарата растворяют в 10 млводы, прибавляют 1 млбромной воды и нагревают до кипения; получается прозрачный светло-малиновый раствор. 0,01 гпрепарата растворяют в 1 млводы и прибавляют 2 капли концентрированной азотной кислоты. Раствор окрашивается в красный цвет и появляется белая муть. При прибавлении следующих 2-3 капель концентрированной азотной кислоты раствор становится прозрачным и бесцветным. 0,1 гпрепарата растворяют в 5 млводы и прибавляют 0,5 млраствора едкого натра, тотчас же выпадает осадок белого цвета; через 5 минут фильтруют через плотный бумажный фильтр. Фильтрат дает характерную реакцию на хлориды (стр. 747). Температура плавления 194-198° (метод 1а). Прозрачность и цветность раствора. 0.25 гпрепарата растворяют в 10 млводы. Полученный раствор должен быть прозрачным и окраска его не должна быть интенсивнее эталона № 5а. Кислотность. Раствор 0,5 гпрепарата в 10 млсвежепрокипяченной и охлажденной воды при добавлении 1 капли раствора метилового красного может окрашиваться в розовый цвет, переходящий от 0,05 мл0,05 н. раствора едкого натра в оранжево-желтый. Сульфаты. Раствор 0,2 гпрепарата в 10 млводы должен выдерживать испытание на сульфаты (не более 0,05% в препарате). Хлорфенотиазин. 0,5 гпрепарата растирают в маленьком стакане с 10 млбензола, фильтруют в делительную воронку и бензольный раствор промывают сначала 0,1 н. раствором соляной кислоты (3 раза по 2 мл),а затем водой (2 раза по 2 мл)Промытый бензольный слой фильтруют в фарфоровую чашку, выпаривают досуха на водяной бане, остаток переносят в пробирку 3 млспирта, прибавляют 1 млнасыщенной на холоду бромной воды и нагревают на кипящей водяной бане около 2 минут до исчезновения желтой окраски от брома Затем доводят раствор до 8 млспиртом. Окраска полученного раствора не должна превышать окраски эталонного раствора. Примечание. Приготовление эталонного раствора: 2 ггексагидрата хлорида кобальта (C0CI2-6H2O) растворяют в 100 млводы. Органические примеси. 0,1 гпрепарата растворяют в 1 млспирта. 0,01 млполученного раствора наносят на полоску быстрофильтруюшей бумаги для хроматографии. Хроматографируют нисходящим методом в системе н-бутиловый спирт - вода - уксусная кислота (50 : 50 : 1) до тех пор, пока фронт растворителя не пройдет 12-15 см(примерно 5 часов). Подсушенную на воздухе хроматограмму опрыскивают реактивом Дра-гендорфа. Не должно быть пятна на линии старта. Примечание. 1. Хроматограмму, проявленную реактивом Дра-гендорфа, водой не промывают. 2. Используют продольно разрезанную бумагу для хроматографии. Перед хроматографированием полоску с нанесенными веществами выдерживают в течение 30 минут в камере для насыщения. Потеря в весе при высушивании. Около 0,5 гпрепарата (точная навеска) сушат при 100-105° до постоянного веса. Потеря в весе не должна превышать 0,5%. Сульфатная зола и тяжелые металлы. Сульфатная зола из 0,5 гпрепарата не должна превышать 0,1% и должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате). Количественное определение. 0.25-0,30 гпрепарата (точная навеска) растворяют в смеси 30 млацетона и 5 млраствора ацетата окисной ртути и прибавляют 1 млнасыщенного раствора метилового оранжевого в ацетоне. Титруют 0,1 н. раствором хлорной кислоты до розового окрашивания. Параллельно проводят контрольный опыт. 1 мл0,1 н. раствора хлорной кислоты соответствует 0,03553 гC17H19CIN2S*HCI, которого в пересчете на сухое вещество должно быть не менее 99,0% и не более 101,0%. Хранение. Список Б.В банках темного стекла, плотно закрытых пробками, залитыми парафином, в сухом, защищенном от света месте. Высшая разовая доза внутрь 0,3 г.Высшая суточная доза внутрь 1,5 г.Высшая разовая доза внутримышечно 0,15 г.Высшая суточная доза внутримышечно 1,0 г.Высшая разовая доза в вену 0,05 г.Высшая суточная доза в вену 0,25 г. Нейролептическое средство. Примечание. Работу с аминазином следует проводить под тягой. в резиновых перчатках. По окончании работы руки нужно вымыть холодной водой, лучше слегка подкисленной, без мыла. Приложение 2 Chlorpromazine Hydrochloride  C17H19ClN2S,HCl 355.3 69-09-0 Action and use Dopamine receptor antagonist; neuroleptic. Preparations Chlorpromazine Injection Chlorpromazine Oral Solution Chlorpromazine Tablets DEFINITION 3-(2-Chloro-10H-phenothiazin-10-yl)-N,N-dimethylpropan-1-amine hydrochloride. Content 99.0 per cent to 101.0 per cent (dried substance). CHARACTERS Appearance White or almost white, crystalline powder. Solubility Very soluble in water, freely soluble in ethanol (96 per cent). It decomposes on exposure to air and light. About 196 °C. IDENTIFICATION First identification B, D. Second identification A, C, D. A. Ultraviolet and visible absorption spectrophotometry (2.2.25). Prepare the solutions protected from bright light and measure the absorbances immediately. Test solution Dissolve 50.0 mg in a 10.3 g/L solution of hydrochloric acid R and dilute to 500.0 mL with the same solution. Dilute 5.0 mL of the solution to 100.0 mL with a 10.3 g/L solution of hydrochloric acid R. Spectral range 230-340 nm. Absorption maximum At 254 nm and 306 nm. Specific absorbance at the absorption maximum: — at 254 nm: 890 to 960. B. Infrared absorption spectrophotometry (2.2.24). Comparison chlorpromazine hydrochloride CRS. C. Identification test for phenothiazines by thin-layer chromatography (2.3.3): use chlorpromazine hydrochloride CRS to prepare the reference solution. D. It gives reaction (b) of chlorides (2.3.1). TESTS pH (2.2.3) 3.5 to 4.5. Carry out the test protected from light and use freshly prepared solutions. Dissolve 1.0 g in carbon dioxide-free water R and dilute to 10 mL with the same solvent. Related substances Liquid chromatography (2.2.29). Carry out the test protected from light and use freshly prepared solutions. Test solution Dissolve 40 mg of the substance to be examined in the mobile phase and dilute to 100.0 mL with the mobile phase. Reference solution (a) Dissolve 4 mg of chlorpromazine impurity D CRS in the mobile phase and dilute to 10.0 mL with the mobile phase. To 1 mL of this solution add 1 mL of the test solution and dilute to 100.0 mL with the mobile phase. Reference solution (b) Dilute 1.0 mL of the test solution to 20.0 mL with the mobile phase. Dilute 1.0 mL of this solution to 10.0 mL with the mobile phase. Reference solution (c) Dissolve 4.0 mg of chlorpromazine impurity A CRS in the mobile phase and dilute to 100.0 mL with the mobile phase. Dilute 1.0 mL of this solution to 100.0 mL with the mobile phase. Reference solution (d) Dissolve 4 mg of promazine hydrochlorideCRS (impurity C) and 4.0 mg of chlorpromazine impurity E CRS in the mobile phase and dilute to 100.0 mL with the mobile phase. Dilute 1.0 mL of this solution to 100.0 mL with the mobile phase. Column: — size: l = 0.25 m, Ш = 4.0 mm, — stationary phase: base-deactivated octylsilyl silica gel for chromatography R (5 µm). Mobile phase Mix 0.2 volumes of thiodiethylene glycol R with 50 volumes of acetonitrile R and 50 volumes of a 0.5 per cent V/V solution of trifluoroacetic acid R previously adjusted to pH 5.3 with tetramethylethylenediamine R. Flow rate 1.0 mL/min. Detection Spectrophotometer at 254 nm. Injection 10 µL. Run time 4 times the retention time of chlorpromazine. Relative retention With reference to chlorpromazine (retention time = about 8 min): impurity A = about 0.4; impurity B = about 0.5; impurity C = about 0.7; impurity D = about 0.9; impurity E = about 3.4. System suitability Reference solution (a): — resolution: minimum 2.0 between the peaks due to impurity D and chlorpromazine. Limits: — impurity A: not more than the area of the corresponding peak in the chromatogram obtained with reference solution (c) (0.1 per cent); — impurities B, C, D: for each impurity, not more than 0.6 times the area of the principal peak in the chromatogram obtained with reference solution (b) (0.3 per cent); — impurity E: not more than the area of the corresponding peak in the chromatogram obtained with reference solution (d) (0.1 per cent); — any other impurity: for each impurity, not more than 0.2 times the area of the principal peak in the chromatogram obtained with reference solution (b) (0.1 per cent); — total: not more than twice the area of the principal peak in the chromatogram obtained with reference solution (b) (1.0 per cent); — disregard limit: 0.1 times the area of the principal peak in the chromatogram obtained with reference solution (b) (0.05 per cent). |
