Микробиология. практикум микробиология ворд. Практикум министерство науки и высшего образования российской федерации
 Скачать 3.98 Mb. Скачать 3.98 Mb.
|
Лабораторная работа № 10Определение чувствительности бактерий к антибиотикамОсновные теоретические положенияИстория антибиотиков началась в XX в. Первыми обнаружил антибактериальные свойства экстрактов плесневых грибов италья- нец Винченцо Тиберио, но его открытие не приняли во внимание. Первооткрывателем первого антибиотика пенициллина считается Александр Флеминг. Свое открытие он сделал фактически случай- но в 1928 г., но не смог выделить достаточно чистый пенициллин. Только в 1940–1941 гг. Эрнсту Чейзу и Говарду Флори удалось вы- делить чистый пенициллин в достаточном количестве и успешно пролечить пациента. После этого производство пенициллина было поставлено на поток, а ученые по всему миру стали искать веще- ства, обладающие подобными свойствами. В 1945 г. Флемингу, Чейзу и Флори была присуждена Нобелевская премия в области физиологии и медицины за открытие пенициллина и его целеб- ного воздействия при различных инфекционных болезнях. Массовое применение пенициллина во Вторую мировую войну и позже спасло миллионы жизней. Но вскоре обнаружилось, что бактерии способны приобретать устойчивость к антибиотикам. Осо- бенности генетической системы бактерий, способность к гори- зонтальному переносу генов и неконтролируемый прием антибио- тиков людьми привели к быстрому распространению устойчивых к антибиотикам возбудителей различных заболеваний. И до сих пор продолжается «гонка вооружений» между учеными, ищущими новые антибиотики и модифицирующими старые, и бактериями, успешно к этим антибиотикам приспосабливающимися. Именно поэтому вопрос о методах определения чувствительности бактерий к антибиотикам очень актуален. Обычно данные методы используются для достижения двух целей: Определение чувствительности клинических изолятов для на- значения адекватной антибиотикотерапии. Определение чувствительности музейных штаммов и клини- ческих изолятов для тестирования перспективных противомикроб- ных препаратов. Антибиотиками в классическом смысле называют вещества природного происхождения, способные в малых концентрациях подавлять рост микроорганизмов или вызывать их гибель. Также существуют синтетические антибактериальные средства, отличаю- щиеся от антибиотиков происхождением. Как видно из определе- ния, антибиотики могут обладать бактериостатическим (подав- лять рост микроорганизмов) и бактерицидным (вызывать гибель микроорганизмов) действием. Антибиотики классифицируют по механизму действия следую- щим образом: Подавляющие синтез клеточных стенок бактерий – бета-лак- тамы (пенициллины, цефалоспорины), гликопептиды (ванкомицин). Нарушающие функции цитоплазматической мембраны – по- лимиксины. Нарушающие синтез белка – аминогликозиды, тетрацикли- ны, макролиды, фениколы. Подавляющие синтез нуклеиновых кислот – фторхинолоны, сульфаламиды. Основной целью определения чувствительности является вы- явление минимальной ингибирующей (подавляющей) концентра- ции антибиотика – МИК (МПК). Методы определения чувстви- тельности к антибиотикам подразделяют на несколько групп: Диффузные, основанные на миграции антибактериально- го препарата, обычно с твердотелой фазы на питательные среды с бактериями. 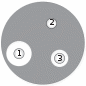 Метод дисков. На твердую среду в чашке Петри вносят оп- ределенный объем бактериальной культуры (обычно соответ- ствующий 0,5 стандарту мутности по МакФарланду, что равно 1–2 108 КОЕ/мл). Затем помещают на поверхность этой среды диски с известными концентрациями раствора антибиотика. Далее происходит диффузия антибиотика в агар. Если бактерия чув- ствительна к такой концентрации данного антибиотика, то ее рост останавливается, то есть вокруг диска образуется зона подавления роста микроорганизмов (рис.16). Чем она больше, тем большей эф- фективностью обладает антибиотик. Отсутствие зоны подавления роста говорит о полной резистентности данного штамма микро- организма к конкретной концентрации исследуемого антибиотика. Рис. 16. Диско-диффузионный метод определения чувствительности к антибиотику: 1и 3– зоны подавления роста микроорганизма; 2– отсутствие зоны подавления роста E-тесты основаны на том же принципе, что и метод дисков, разница лишь в том, что на один отрезок бумаги нанесены антибио- тики с возрастающей концентрацией. Рост бактерий вокруг зоны с низкой концентрацией антибиотика ничем не ограничен, но по мере приближения к высоким концентрациям из-за диффузии антибио- тика в агар зона роста эллипсоидно уменьшается (рис. 17). В месте окончания зоны роста, то есть ее пересечения с полоской E-теста, находится минимальная ингибирующая концентрация данного ан- тибиотика к данному изоляту бактерий. Е-тесты используются только для выяснения чувствительнос- ти неизвестных изолятов к известным антибиотикам. В отличие от диско-диффузионного метода, их можно купить только в готовом виде с уже нанесенным антибиотиком. 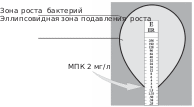 Рис. 17. Метод Е-тестов Методы разведения, основанные на последовательном раз- ведении раствора исследуемого вещества и исследовании его дей- ствия на жидкие или твердые культуры микроорганизмов. В слу- чае с жидкими культурами готовят серию разведений антибиотика в питательной среде, после чего в эту питательную среду вносят сус- пензию культуры клеток (обычно соответствующую стандарту мут- ности 0,5 МакФарланда). Среды инкубируют сутки при 37 °С и смот- рят на их помутнение. При его наличии делают вывод, что данная концентрация антибиотика неэффективна против данного штам- ма микроорганизма. Первая же незамутненная пробирка указыва- ет на минимальную ингибирующую концентрацию антибиотика. Цель работы: освоить различные методы выявления чувстви- тельности к антибиотикам. Оборудование и реактивыСтерильные растворы антибиотиков. Чашки Петри с питательной средой. Пробирки с жидкой стерильной питательной средой. Стерильные бумажные диски. Культуры грамположительных и грамотрицательных бактерий. Ход работыПриготовление стандарта мутности 0,5 по МакФарланду. Приготовить 0,5 мл BaCl2 в концентрации 0,048 моль/л (1,175 % раствор BaCl2· 2H2O). Перемешивая, медленно добавить 99,5 мл раствора 0,18 моль/л (1 %) H2SO4 до получения однородного раствора. Проверить правильность приготовления раствора на спектро- фотометре: кювета 1 см, длина волны 625 нм. В таких условиях поглощение должно составлять 0,08–0,1. Разлить полученный раствор по 5 мл в пробирки с плотно за- крывающимися крышками во избежание испарения. Пробирки должны быть такого же диаметра, как и те, в которых будет нахо- диться суспензия исследуемой культуры. Установление чувствительности диско-диффузионным методом. В асептических условиях равномерно рассеять суспензию ис- следуемой культуры по поверхности чашек Петри. Следует исполь- зовать инокулюм, соответствующий по оптической плотности 0,5 по стандарту МакФарланда. В контрольной чашке Петри без добав- ления антибиотиков через сутки должен вырасти «газон» – культу- ра должна покрыть всю поверхность питательной среды. Стерильным пинцетом поместить диски с различными кон- центрациями антибиотиков на поверхность чашек Петри. Диски не должны располагаться ближе 20 мм от края чашки. Их следует аккуратно прижать пинцетом к поверхности агара и не перемещать после нанесения. Перевернуть чашки Петри и инкубировать их в термостате при 35 °С сутки. На следующий день просмотреть чашки Петри на наличие зон отсутствия роста бактерий вокруг дисков, сравнить с контрольны- ми образцами. Измерить диаметр этих зон, занести данные рабо- чую тетрадь. Построить график зависимости диаметра зоны отсутствия рос- та бактерий от концентрации антибиотика, рассчитать МИК. Внес- ти данные в табл. 5. Т а б л и ц а 5 МИК определенных антибиотиков для бактерий
2. Установление чувствительности методами разведения. Приготовить серию разведений рабочего раствора антибиоти- ка в питательной среде. Для этого самплером добавить 0,5 мл ис- ходного раствора антибиотика к 0,5 мл жидкой питательной среды, тщательно перемешать, поменять наконечник и повторить проце- дуру со следующей пробиркой. Из последней пробирки 0,5 мл сле- дует удалить. Приготовить суспензию культуры клеток, эквивалентную 0,5 по стандарту мутности МакФарланда. В асептических условиях инокулировать каждую пробирку с пи- тательной средой и антибиотиком 0,5 мл изготовленной суспензии. 69 Инкубировать пробирки в термостате при 37 °С 18–24 ч. По- ставить отрицательный контроль для каждого антибиотика и хра- нить его в холодильнике при +4 °С. Каждую пробирку визуально на свету сравнить с контрольной, хранившейся в холодильнике. Отметить МИК данного антибиоти- ка по отношению к данному штамму бактерии по отсутствию види- мого помутнения среды, внести данные в таблицу (табл. 5). По результатам работы написать отчет. Вопросы для самоподготовкиВ чем причины появления бактерий, устойчивых к антибиотикам? Какими действиями по отношению к бактериям обладают анти- биотики? Что такое Е-тест?  |
