Микробиология. практикум микробиология ворд. Практикум министерство науки и высшего образования российской федерации
 Скачать 3.98 Mb. Скачать 3.98 Mb.
|
МЕТОДЫ КАЧЕСТВЕННОГОИ КОЛИЧЕСТВЕННОГО ИЗУЧЕНИЯ МИКРООРГАНИЗМОВ В данный раздел входят процедуры, затрагивающие базовые основы и правила работы в микробиологических лабораториях: методы асептики, приготовление мазков микробиологических пре- паратов, техника и разновидности микроскопии, методы количе- ственного учета микроорганизмов. Студентам необходимо освоить данные методики, так как в дальнейшей учебе и карьере подоб- ные навыки востребованы. Лабораторная работа № 1 Микроскопирование микробиологических препаратов. Препараты живых микроорганизмовОсновные теоретические положенияМикроскопия до сих пор остается основным методом изуче- ния микроорганизмов. Развиваясь, человечество предлагало все больше разнообразных способов модернизации как световой, так и электронной микроскопии. Некоторые из этих методов, наиболее часто использующихся в микробиологии, будут рассмотрены далее. Методсветлого полявпроходящемсвете– классический ме- тод микроскопии, применяется для изучения объектов с неравно- мерной поглощающей способностью. Метод неэффективен, если объект прозрачен. Метод темного поля в проходящем свете используется для изу- чения прозрачных и живых объектов. Свет в данном случае подает- ся косыми лучами, поэтому фон у получаемого изображения темный. Попадая на объект, косые лучи преломляются, изменяют свою тра- екторию и попадают в объектив. Таким образом, объекты фактичес- ки светятся на темном фоне. Особенно удобно использовать этот метод для изучения микроорганизмов с естественной окраской. Метод фазово-контрастноймикроскопиитакже использу- ется для изучения прозрачных объектов. При прохождении света через прозрачный объект не изменяются его интенсивность и дли- на волны, но изменяется фаза. Однако человеческий глаз не спо- собен это изменение уловить. Для работы методом фазового кон- траста необходимо модифицировать микроскоп и добавить фазо- вую пластинку в объектив и кольцевую диафрагму под конденсор. С помощью этих модификаций изменение фазы световой волны преобразуется в изменение амплитуды (яркости), что повышает контрастность объекта. Данный метод не увеличивает разрешаю- щую способность микроскопа, но позволяет изучать прозрачные объекты. В методе люминесцентной микроскопии используется спо- собность некоторых молекул светиться при воздействии на них света определенной длины волны. Изначально использовалась ес- тественная биолюминесценция – многие вещества живых организ- мов способны светится сами по себе (хлорофилл и другие пигмен- ты, порфирины). Следующий этап – обработка биообъектов флуорохромами. Флуорохромы – красители, не вызывающие сильной окраски объек- тов в обычном свете, но флуоресцирующие при облучении ультра- фиолетовыми/синими/фиолетовыми лучами. Из флуорохромов в микробиологии используют акридин оранжевый, корифосфин, при- мулин, родамин и др. Например, акридин оранжевый, проникнув в клетку, связывается с нуклеиновыми кислотами. Под действием ультрафиолетового излучения акридиновый оранжевый окрашива- ет РНК в оранжевый цвет, ДНК – в зеленый. С развитием иммунологии появилась возможность присоеди- нять флуорохромные маркеры к антителам. Антигены, обработан- ные иммунными сыворотками с антителами, мечеными флуорохро- мами, способны светиться в ультрафиолете люминесцентного микро- скопа. Таким образом, появилась возможность «подсвечивать» отдельные молекулы. Изменения также касаются и устройства микроскопа. Вместо обычных источников света используются ртутно-кварцевые или галогено-кварцевые лампы, испускающие ультрафиолетовые лучи. На пути пучка света устанавливаются светофильтры, ограничиваю- щие свет ненужных длин волн. Этот тип микроскопии за счет све- чения позволяет увидеть объекты, величиной меньшие, чем разре- шающая способность микроскопа. Препаратыживыхмикроорганизмов: Препарат «раздавленная капля» – наиболее стандартный для изучения микроорганизмов в микробиологии. Суспензия мик- роорганизмов при этом находится под покровным стеклом. Препарат «висячая капля» используется для наблюдения про- цессов в микробиологии – движения и деления. Микроорганизмы в данном препарате находятся в своих естественных условиях. Препарат «отпечаток» изготавливается путем прикладывания предметного стекла к верхней части колонии (например, для ис- следования спороношения стрептомицетов) или к ткани, пищевым продуктам, кожным покровам или слизистым. Препарат «микрокультура» создается методом выращивания микроорганизмов сразу на предметном стекле, предварительно по- крытом агаризованной питательной средой. Это позволяет наблю- дать непосредственно за развитием колонии, ее структурой и рас- положением клеток. Цели работы: сформировать представление о методах микро- скопии и живых препаратах микроорганизмов; вспомнить правила работы с микроскопами; обнаружить бактерии различных морфоти- пов в готовых фиксированных препаратах и приготовленных живых. Оборудование и реактивыМикроскоп, иммерсионное масло. Предметные и покровные стекла, штатив к ним. Спиртовки и зажигалки. Микробиологические петли. Фильтровальная бумага и вата. Источник микроорганизмов – молочные продукты, вода из во- доемов, рассолы, протухшее мясо, пиво. Готовые фиксированные препараты различного происхож- дения. Стекла с лункой для препаратов «висячая капля». З а д а н и е 1Микроскопирование готовых фиксированных препаратов Студенту предлагаются готовые препараты чистых микро- биологических культур с бактериями различных морфотипов. Основ- ная задача данного этапа – оценить размеры бактерий, пронаблю- дать и описать (зарисовать) различные их морфотипы. В качестве примеров могут служить фиксированные препараты из медицин- ской практики и препараты естественных источников микроорга- низмов – пива, кефира, рассолов. З а д а н и е 2Приготовление препарата «раздавленная капля» В асептических условиях с помощью микробиологической пет- ли нанести на предметное стекло каплю воды. Затем с помощью микробиологической петли внести культуру микроорганизмов в каплю. В случае работы с жидкими культурами можно наносить на стекло каплю культуры. Воды и культуры нужно добавлять не более необходимого, то есть столько, чтобы после накрывания покровным стеклом жид- кость не выступала за его края (в случае обратного – аккуратно убрать излишки фильтровальной бумагой). Клеток микроорганиз- мов не должно быть слишком много, они не должны заслонять друг друга, иначе препарат придется переделывать. Покровное стекло следует подвести к капле ребром и, посте- пенно наклоняя, аккуратно опустить на каплю, стараясь не допус- кать образования пузырей воздуха. Микроскопировать полученный препарат с помощью «сухих» объективов, то есть без иммерсии. Отметить подвижность и фор- му клеток (рис. 2). 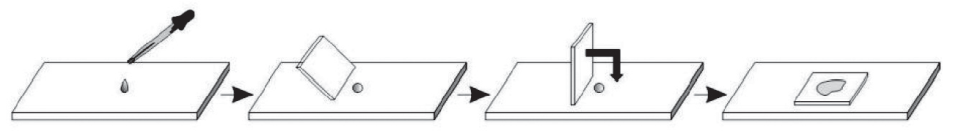 Рис. 2. Приготовление препарата «раздавленная капля» З а д а н и е 3Приготовление препарата «висячая капля» Смазать вазелином края и дно лунки на специальном пред- метном стекле с углублением. В асептических условиях микробиологической петлей отобрать суспензию микроорганизмов из пробирки с протухшим мясом. Нанести каплю на покровное стекло. Аккуратно перевернуть покровное стекло каплей вниз и помес- тить на предметное стекло с лункой таким образом, чтобы капля не касалась ни стенок, ни дна лунки, а висела свободно. Пронаблюдать движение микроорганизмов, отметить разницу между двумя типами препаратов – висячей и раздавленной капли (рис. 3). 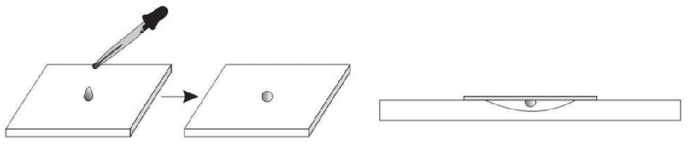 Рис. 3. Приготовление препарата «висячая капля» Рассмотреть и отметить морфологическое строение исследуе- мых культур. В рабочей тетради написать отчет о проделанной работе, в нем описать препараты живых микроорганизмов, кото- рые наблюдали, зарисовать форму микроорганизмов и процедуру приготовления препарата «висячая капля». Вопросы для самоподготовкиДля чего в биологии используется фазово-контрастная микроскопия? В чем преимущества и недостатки живых препаратов? Что такое витальные красители, где они используются? |
