Микробиология. практикум микробиология ворд. Практикум министерство науки и высшего образования российской федерации
 Скачать 3.98 Mb. Скачать 3.98 Mb.
|
Лабораторная работа № 2Окрашенные и фиксированные препараты микроорганизмовОсновные теоретические положенияБольшинство клеток микроорганизмов в естественных усло- виях не окрашены и поэтому плохо видны в световой микроскоп, с трудом поддаются изучению. В связи с этим Р. Кох первым стал пробовать окрашивать микроорганизмы для их изучения. В настоя- щее время можно выделить следующие виды окраски: Окраска прижизненная (витальная). Для нее используют только витальные красители, не вызывающие гибель клеток. Та- ковыми являются, например, водные растворы в концентрации 0,2–0,001 % метиленового синего, конго красного. Окраскафиксированныхпрепаратов. В отличие от «живых» препаратов, фиксированные нет смысла изучать без окраски. Фик- сация включает в себя и «убийство» клеток, поэтому возможности для применения различных окрасок не ограничены. Приготовле- ние фиксированного препарата проходит в несколько стадий: при- готовление мазка, высушивание мазка, фиксация мазка в пламени горелки либо в специальных фиксирующих жидкостях, окраска. Фиксация препаратов имеет несколько целей: во-первых, как уже говорилось выше, это «убийство» микроорганизмов, во-вторых, обеспечение лучшего прилипания клеток к стеклу, а в-третьих, уве- личение восприимчивости клеток к окраске за счет (опять же) их «убийства», так как мертвые клетки окрашиваются лучше живых. Также для рассмотрения фиксированных препаратов можно ис- пользовать иммерсию и иммерсионный объектив. Кроме этого, окраску подразделяют на следующие виды: Простая, проходящая в одну стадию с использованием одно- го красителя; в качестве красителей обычно используют метиле- новый синий, водный раствор фуксина, водный раствор сафранина. Сложная, когда окраска производится минимум двумя кра- сителями с этапом отмывки между ними. Классический пример сложной окраски – окраска по Граму (с использованием трех краси- телей), другой пример, использующийся в медицинской практике, – окраска по Цилю – Нельсону. Дифференцированная, при которой прокрашиваются опре- деленные части микроорганизмов – капсула, нуклеоид, включения, жгутики и т. д. В рамках данной лабораторной работы необходимо ознако- миться с методом окраски живых препаратов дрожжей раствором Люголя для выявления включений, окраской методом негативного контрастирования живых препаратов клеток, содержащих капсулу, а также со способом приготовления фиксированного окрашенного препарата. Включения– довольно обширное понятие, под которым объеди- няются все везикулы, существующие в бактериальных клетках. Они могут содержать в себе питательные вещества – полисахари- ды, полифосфаты, липиды, серу. Помимо запасающей функции, включения могут регулировать осмотическое давление клетки. Кро- ме того, везикулы могут содержать фотосинтетические пигменты зеленых бактерий (хлоросомы) и цианобактерий (фикобилисомы). Некоторые водные микроорганизмы имеют газовые вакуоли. Окра- шиваются включения опять-таки в зависимости от их содержи- мого – это раствор Люголя для полисахаридов, судан III либо су- дан черный для липидных гранул, метиленовый синий для поли- фосфатов (волютин). Капсулы– структура, вырабатываемая бактериями на поверх- ности клеток. Она служит еще одним защитным слоем как от фи- зических, так и от иммунологических воздействий. По природе своей гидрофильна, состоит из большого количества воды, связан- ной с полисахаридами и полипептидами. Капсула вследствие сво- их свойств практически не окрашивается. Окраску капсул можно провести методами негативного окрашивания с помощью туши – методами окраски мазка по Хиссу, Бурри – Гинсу или Дюгиду. Также существуют методы окраски по Романовскому – Гимзе и Михину с использованием красящих веществ. Цель работы: изучить методы окраски микроорганизмов и спо- собы приготовления фиксированного окрашенного препарата. Оборудование и реактивыМикроскоп, иммерсионное масло. Предметные стекла, штатив к ним. Спиртовки и зажигалки. Микробиологические петли. Фильтровальная бумага, вата, хозяйственное мыло. Чистые культуры микроорганизмов, в том числе образующих капсулу. Суспензия пекарских дрожжей. Красители: водный раствор сафранина, метиленовый синий, тушь, раствор Люголя. З а д а н и е 1 Окраска включенийВ асептических условиях внести на покровное стекло каплю культуры дрожжей. Внести в суспензию клеток каплю раствора Люголя. Накрыть препарат покровным стеклом и микроскопировать. Покровным стеклом нужно накрывать аккуратно, не допуская по- явления воздушных пузырей. Отметить окрашивание гликогеновых включений дрожжей, внести в рабочую тетрадь процесс приготовления препарата и по- лучившийся результат. З а д а н и е 2 Окраска капсулНанести на предметное стекло каплю туши; промыть и про- жечь петлю. В асептических условиях внести в тушь каплю исследуемых микроорганизмов, имеющих капсулы. Распределить полученную смесь по стеклу петлей. Накрыть покровным стеклом. На темном фоне должны быть видны клетки, окруженные не- прокрашенной капсулой. Внести в рабочую тетрадь процесс приготовления препарата и получившийся результат. З а д а н и е 3Фиксированный окрашенный препарат Обезжирить чистое предметное стекло мылом. В асептических условиях нанести на него каплю воды, в кото- рую петлей (также в асептических условиях) внести культуру бак- терий (аналогично препарату «раздавленная капля»). Этой же петлей распределить полученную суспензию макси- мально тонким слоем по поверхности стекла. Высушить мазок, желательно при комнатной температуре. Если все было сделано правильно на этапе приготовления мазка (то есть было нанесено небольшое количество воды и распределено тон- ким слоем), то высушивание происходит быстро. Зафиксировать мазок. Взять предметное стекло двумя пальца- ми и, держа предметное стекло мазком вверх, провести его через верхнюю часть пламени спиртовки (наиболее горячую) три раза.  Важно! Проводить предметное стекло через пламя необходи- мо и не слишком быстро (в этом случае не произойдет фикса- ция), и не слишком медленно (в этом случае велик шанс дефор- мировать клетки). Важно! Проводить предметное стекло через пламя необходи- мо и не слишком быстро (в этом случае не произойдет фикса- ция), и не слишком медленно (в этом случае велик шанс дефор- мировать клетки).Поместить препарат в штатив для окрашивания и нанести на него краситель. Выдержать 1 мин. (время может варьироваться в зависимости от красителя). По истечению времени промывать препарат водой до тех пор, пока стекающая вода не обесцветится. Микроскопировать с объективом 100 с использованием им- мерсионного масла. Отметить морфологию исследуемых клеток, сравнить окрашенный фиксированный и препарат с прижизненной окраской (рис. 4). Внести в рабочую тетрадь процесс приготовления фиксиро- ванного окрашенного препарата. Подобная методика является ба- зовой для приготовления наиболее распространенных сложных окрасок. 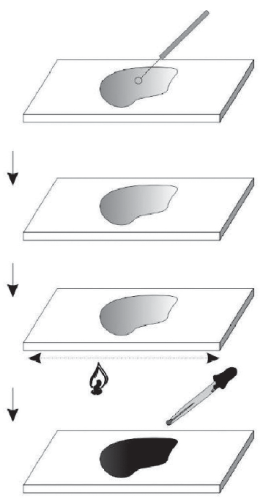 Рис. 4. Приготовление фиксированного окрашенного препарата Рис. 4. Приготовление фиксированного окрашенного препаратаВопросы для самоподготовкиКакие процессы входят в понятие фиксации препарата? Какие преимущества и недостатки есть у фиксированных препаратов? Назовите основные функции капсул у бактерий. |
