Практикум по АХ-2003,часть1. Практикум по аналитической химии в 2 ч. Учебное пособие. Ч. Омск Омский госуниверситет, 1998. 176 с
 Скачать 1.29 Mb. Скачать 1.29 Mb.
|
6.5. РАСЧЕТ РЕЗУЛЬТАТОВ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗАПрактическое занятие № 5 Теоретические сведенияРезультаты титриметрического анализа рассчитывают по одной из нескольких известных формул, основанных на законе эквивалентов. Способ расчета не зависит от типа химической реакции, протекающей в ходе титрования, а также от метода нахождения точки эквивалентности (типа индикатора или прибора). При выборе формулы следует различать два случая: а) расчет массовой доли компонента (процентного содержания в пробе); б) расчет его концентрации в исследуемом растворе. Выбор формулы зависит и от того, какой способ титрования (прямое, обратное, заместительное) применяют в ходе анализа. Во всех случаях нужно заранее установить с необходимой точностью VT - oбъем затраченного титранта в миллилитрах и Ст - концентрацию титранта в моль/литр. Наиболее просто выглядят расчетные формулы, если концентрации определяемого компонента и титранта выражаются числом молей их эквивалентов в литре соответствующих растворов, т.е. когда используются нормальные концентрации (Nx и NT). Только в комплексонометрии и некоторых других методах, где 1 моль определяемого вещества реагирует с 1 молем титранта, нормальные концентрации совпадают с обычными молярными концентрациями (Cx и СТ), а поэтому при расчете результатов соответствующих анализов нормальные концентрации и эквиваленты применять нецелесообразно. В этих случаях массу определяемого вещества лучше рассчитывать по формуле, в которую входит величина Мх - молярная масса Х: mx = СT·VT·Мx.. (25) Во всех остальных случаях рекомендуется применять нормальные концентрации, которые в отличие от обычных молярных концентраций определяются с учетом химизма реакции, протекающей в ходе титрования. Для данного раствора нормальная концентрация либо равна молярной, либо превосходит ее в несколько (2,3,4....) раз. Один и тот же раствор может иметь несколько нормальных концентраций, смотря по тому, в каком процессе мы его испольуем, какая реакция протекает. Например, молекула фосфорной кислоты при ее нейтрализации щелочью отдает либо 1, либо 2, либо 3 протона; ион перманганата в разных условиях принимает от 1 до 5 электронов и т.д. Поэтому при записи уравнения реакции, указании эквивалентов и нормальных концентраций следует учитывать условия, в которых протекает титрование, и свойства применяемого индикатора (пример 1). Расчет результатов прямого или заместительного титрованияМасса (в мг) оттитрованного компонента X равна: mx = NT·VT·Эx, (26) где Эx - молярная масса эквивалента Х, соответствующая одному протону (в кислотно-основных реакциях), одному электрону (в окислительно-восстановительных реакциях), одному монодентатному лиганду (в комплексометрии) и т. п. Для расчета Эх молярную массу Х умножают на фактор эквивалентности, меньший или равный единице (см. [2, с.182]). Так, в методе нейтрализации Эх = Мх / nH, где nH - число протонов, которое молекула Х принимает (отдает) в ходе данной реакции. В методе редоксметрии Эх = Мх / ne, где в знаменателе стоит число электронов, которое молекула Х принимает (отдает) в ходе данной реакции. Аналогично рассчитывается Эх в других методах. Из (26) следует, что массовая доля Х в навеске пробы равна: %X = NT·VT·Эx·100 % / m, (26а) где m - масса навески в мг (пример2). Если титруют не всю навеску, а некоторую ее часть (аликвоту), то в расчетах используется дополнительный коэффициент К, равный отношению объема аликвоты к объему раствора, в который перевели навеску и из которого отбирали аликвоты для титрования (пример3): К = V0 /Valiq. При определении концентрации раствора по способу прямого (или заместительного) титрования применяется общеизвестная формула: Nх · Vх = NT · VT. (27) Расчет результатов обратного титрованияВ этом случае, кроме титранта, используется вспомогательный реагент R, который вводят в избытке, в виде раствора с точно известной нормальной концентрацией NR, причем объем этого раствора (VR) точно измерен. Непрореагировавший с Х избыток вспомогательного реагента оттитровывают. Поскольку реагент R реагирует и с определяемым компонентом Х, и с титрантом Т, то в соответствии с законом эквивалентов: nR = nX + nT. Отсюда для расчета массы Х и массовой доли Х в пробе можно вывести достаточно удобные формулы: mX = Эx (NR · VR - NT ·VT). (28) %Х = Как и в предыдущих случаях, считаем, что все массы выражены в миллиграммах, а объемы - в миллилитрах. При определении концентрации раствора Х по способу обратного титрования (пример 4) следует использовать соотношение: Nx = (NR · VR - NT · VT) / Vx. (29) Другие способы расчетаПриведенных формул вполне достаточно для расчета результатов анализа, однако в заводских лабораториях часто пользуются другими способами расчета, в частности, применяют поправочные коэффициенты к нормальным концентрациям (см. [2, c.184]), рассчитывают титры (с.185) и т. п. Особенно распространен и действительно удобен способ расчета, в котором применяют условный титр рабочего раствора («титр по определяемому веществу»). Он показывает6, какая масса определяемого вещества Х соответствует одному миллилитру раствора титранта mx = Tусл · VT = Т Т/ Х · VT. (30) Титр по определяемому веществу можно рассчитать теоретически: Т Т/ Х = NT · ЭХ, (30а) однако на практике его устанавливают эмпирически, не применяя нормальных концентраций. Для этого после приготовления рабочего раствора титруют им несколько различных навесок вещества Х (или стандартных образцов с известным содержанием Х); зная mx и Vx, рассчитывают Т Т/Х по формуле (30) и усредняют полученные значения. Затем при анализе проб с неизвестным содержанием Х подставляют найденную (усредненную) величину Т Т/ Х в формулу (30) и рассчитывают mx, как это иллюстрируется в примере 5. Не рекомендуется проводить расчеты методом пропорций, рассчитывая массу веществ по уравнению реакции («школьный способ»). Такой путь решения расчетных задач нерационален и обычно не дает требуемой точности. Иногда студенты пытаются решать задачи на обратное титрование поэтапно, т.е. вначале рассчитывают, сколько миллилитров вспомогательного реагента пошло на реакцию с титрантом, сколько осталось на реакцию с определяемым компонентом, а уже затем подсчитывают массу этого компонента. Этот путь решения нерационален. Точность результатов титриметрического анализаЕсли предположить, что конечная точка прямого титрования идеально совпадает с точкой эквивалентности7, и вычислять массу Х по формуле (26), то относительную погрешность титриметрического анализа следует рассчитывать по формулам сложения случайных погрешностей [ 6, c. 90]: 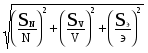 . (31) . (31)Погрешности исходных данных (SN, SV, SЭ) следует оценивать с учетом воспроизводимости соответствующих величин, а при отсутствии этой информации в качестве нижнего предела погрешности каждой величины брать единицу последнего разряда (это справедливо только при правильно сделанной записи исходных данных). Например, в качестве Sv можно взять цену деления бюретки, из которой проводилось титрование, хотя правильнее было бы провести несколько параллельных титрований и рассчитать SV, как это принято при статистической обработке данных. Полученная величина, как правило, превышает цену деления бюретки в несколько раз. При вычислениях по формуле (31) погрешностью в определении молярной массы эквивалента (третьим слагаемым) можно пренебречь (пример 6). Если титруется не вся проба, а аликвота (часть пробы), под корнем в (31) появятся новые слагаемые - относительные погрешности двукратного измерения объемов, и неточность анализа в целом увеличится. Ухудшится точность анализа и в том случае, если проводить анализ по способу обратного титрования, под корнем в этом случае также окажутся дополнительные слагаемые, связанные с погрешностями определения концентрации вспомогательного реагента и измерения его объема. Примеры решения типовых задач1. Рассчитать массу карбоната натрия в навеске технической соды, содержащей лишь инертные примеси, если ее титровали фиксанальным 0,1000 н раствором HСl и на титрование затрачено 24,7 мл раствора. В качестве индикатора применяется фенолфталеин. Решение. Расчет результатов прямого титрования следует вести по формуле (26). Масса Na2CO3 (в мг) равна произведению нормальной концентрации титранта, его объема (в мл) и молярной массы одного эквивалента карбоната натрия. Проблема лишь в том, что карбонат натрия может с кислотами реагировать до различных продуктов Na2CO3 + HCl = NaHCO3 + NaCl Na2CO3 + 2 HCl = H2CO3 + 2 NaCl и поэтому величина Эх может иметь различные значения. Если карбонат реагирует по первому уравнению, рН раствора гидрокарбоната, присутствующего в точке эквивалентности, практически совпадает с рТ фенолфталеина. Молярная масса эквивалента Na2CO3 при его титровании до гидрокарбоната (с фенолфталеином) равна молярной массе этой соли (105,989). При протекании второй реакции, когда на каждую молекулу карбоната натрия расходуется по два протона, молярная масса его эквивалента (далее будем называть ее просто эквивалентом, хотя это не совсем соответствует правилам) равен половине молярной массы (52,9945). Присутствие в точке эквивалентности угольной кислоты фиксируется по окраске соответствующего индикатора, например метилового оранжевого. Таким образом, при титровании карбонатов с разными индикаторами его эквивалент может различаться. В рассматриваемом примере: mNa2CO3 = 0,1000 · 24,7 · 105,989 = 261,79283 262 (мг). 2. Рассчитать массу карбоната натрия в навеске технической соды, содержащей лишь инертные примеси, если ее титровали 0,1000 н. раствором HСl, и на титрование затрачено 49,0 мл раствора. В качестве индикатора применяется метиловый оранжевый. Решение. Так как переход окраски метилового оранжевого происходит в кислой среде и свидетельствует о переходе карбонатов в угольную кислоту (см. предыдущий пример), эквивалент карбоната натрия в этом титровании равен 52,9945. Масса оттитрованного карбоната натрия равна: mNa2CO3 = 0,1000 · 49,0 · 52,9945 = 259,7 260 (мг). Как и в предыдущем примере ответ округляется до трех значащих цифр, так как с такой точностью измерен объем титранта. 3. Рассчитать процентное содержание СН3СООН в техническом продукте (ледяной уксусной кислоте), если навеску массой 0,1342 г растворили в 10 мл воды и оттитровали 0,0976 н. раствором едкого натра с индикатором фенолфталеином. На титрование затрачено 21,5 мл титранта. Решение. Прежде всего запишем уравнение реакции: СН3СООН + NaOH = CH3COONa + H2O. Поскольку молекула СH3СООH в ходе реакции отдает один протон, ее эквивалент равен молярной массе, т.е. 60,045. Величину молярной массы при расчете эквивалентов либо берут из справочника, либо подсчитывают по формуле через атомные массы, но в любом случае вычислять и записывать эквивалент следует как можно точнее (с 4-5 значащими цифрами). Проверим, можно ли считать затраченный в ходе титрования объем титранта соответствующим точке эквивалентности, т.е. правильно ли выбран индикатор. В точке эквивалентности рН раствора определяется присутствием продукта (в данном примере - ацетат-ионов). Ацетат-ионы создают слабощелочную среду, и это соответствует рT использованного индикатора (фенолфталеина). Следовательно, индикатор выбран верно и индикаторные ошибки в ходе решения данной задачи учитывать не следует. Поскольку титрование прямое и рассчитывается процентное содержание компонента, применяем формулу (26а). Массу навески, которая в условии дана в граммах, переводим в миллиграммы. % CH3COOH = mCH3COOH · 100% / m= NT VT ЭТ · 100% / m= = 0, 0976 · 21,5 · 60,045 · 100 % / 134,2 = 93,888539 % 93,9 %. Результат округляем до трех значащих цифр, поскольку столько их имеется в наиболее неточном из сомножителей (объеме титранта). Обратите внимание: объем воды, в котором растворили навеску технического продукта перед титрованием, не имеет значения. 4. Для определения содержания серы в нефтепродукте его навеску (0, 8450 г) сожгли в колбе, заполненной кислородом, в присутствии специального катализатора (метод Шенигера), продукты сгорания были поглощены водой. При этом серосодержащие соединения полностью окисляются до серной кислоты. Полученный раствор довели до метки в колбе на 100,0 мл и из него отбирали аликвоты объемом по 10,0 мл. Аликвоты титровали раствором BaCl2 до BaSO4 с помощью микробюретки, точку эквивалентности определяли по изменению электропроводности раствора. На титрование каждой аликвоты было затрачено в среднем 1,47 мл 0,0498 М раствора BaCl2. Рассчитать содержание серы в нефтепродукте. Решение. Обратите внимание, по условию требуется установить содержание серы, а в реакции титрования участвует серная кислота, анализ идет по методу замещения. Один моль серы дает в результате окисления один моль серной кислоты, на титрование которого расходуется один моль хлорида бария: H2SO4 + BaCl2 = BaSO4 + 2 HСl. Фактор эквивалентности равен единице, в таких случаях нормальными концентрациями пользоваться нецелесообразно. Для расчета массы серы применяем формулу (25), но, поскольку титровали не всю пробу, а аликвоты, - вводим дополнительно коэффициент аликвирования. При вычислении процентного содержания серы масса навески нефтепродукта предварительно должна быть выражена в тех же единицах, что и масса серы, т.е. в миллиграммах. mS = K·CBaCl2 ·VBaCl2 ·MS = %S = mS · 100% / m = 23, 5 мг · 100 % / 845,0 мг = 2,78 %. 5. Вычислить, какую процентную концентрацию имеет раствор KBr, если для анализа по методу Фольгарда к 25,0 мл этого раствора добавили 50,0 мл 0,1012 н. раствора AgNO3, а избыток серебра оттитровали 0,1000 н. раствором KSCN, причем на титрование было затрачено 6,2 мл. Решение. Очевидно, поскольку анализ проводится путем обратного титрования, надо вначале вычислить нормальную (или молярную, в этом случае они равны между собой) концентрацию KBr по формуле (29), NKBr = (NAg·VAg - NSCN ·VSCN) / VKBr = (0,1012·50,0 - 0,1000·6,2) / 25,0 = = 0,1776 0,178 (моль/л). Считая, что плотность () раствора KBr равна единице, переводим молярную концентрацию в процентную (см. [8, c.172]): С% = NKBr · MKBr / 10= 0,178 · 119,002 / 10 2,12 %. 6. При определении серы по методу Шенигера (см. пример 4) использовали раствор хлорида бария. Чтобы определить его условный титр (титр по сере), взяли навеску (106,4 мг) стандартного дизельного топлива, где содержание серы известно и составляет 1,45%. На титрование продуктов окисления затрачено 12,1 мл титранта. Затем взяли навеску (85,7 мг) другого нефтепродукта - с неизвестным содержанием серы. После окисления его в таких же условиях на титрование полученной серной кислоты пошло 7,6 мл титранта. Рассчитайте процентное содержание серы в исследуемом нефтепродукте. Решение. Прежде всего рассчитаем титр раствора BaCl2 по сере, пользуясь формулой (30). Подставляем в нее данные первого титрования: T BaCl2 / S = mS / VBaCl2 = Теперь по данным второго титрования определим массу серы в навеске исследуемого нефтепродукта и процентное содержание серы в нем. mS = 0,128 · 7,6 = 0,97 (мг S); %S = 0,97 · 100% / 85,7 = 1,1 %. 7. Рассчитайте относительную случайную погрешность титриметрического определения СH3COOH в техническом продукте. Технические данные возьмите из приведенного выше примера 3. Решение. Расчет ведут по формуле (31). Для оценки погрешности исходных данных будем считать, что в условии задачи все исходные данные записаны метрологически правильно. Тогда в каждом случае величина абсолютной погрешности будет соответствовать единице последнего разряда в записи соответствующего числа. В частности, будем считать объем титранта (21,5 мл) измеренным с точностью до 0,1 мл и т.п. Тогда относительная погрешность при определении массы СH3COOH равна:  = =Так как взвешивание на аналитических весах - гораздо более точная операция, чем измерение объема, пренебрежем дополнительной погрешностью взвешивания исходной навески и будем считать, что относительная погрешность анализа в целом также будет величиной порядка 0,5%. Контрольные вопросы1. Что такое эквивалент и как рассчитывается его величина в разных случаях? 2. Что такое нормальная концентрация? В каких единицах она выражается? Почему один и тот же раствор может иметь несколько разных нормальных концентраций? 3. Раствор некоторого вещества приготовили в мерной колбе по точной навеске. Как рассчитать его молярную и нормальную концентрацию? 4. Нормальная концентрация раствора KMnO4, рассчитаная для редокститрований в кислой среде, равна 0,100. Чему равна концентрация этого раствора, если титрование проводить в нейтральной среде? 5. Как рассчитать концентрацию металла в растворе по объему комплексона III, затраченному на прямое титрование? 6. Как выбрать число значащих цифр, с которым требуется записать результат анализа, полученный путем прямого титрования ? 7. Чем отличаются понятия «титр раствора» и «титр раствора по определяемому веществу»? Как они связаны математически? 8. Как оценить относительную погрешность результата титрования, если концентрация исследуемого раствора рассчитывается по формуле (27) ? 9. Какую относительную погрешность результатов мы обычно получаем при титровании? Почему гравиметрический анализ, как правило, точнее титриметрического? |
