Практикум по биофармации А.И. Тихонов 2003 г. — копия. Практикум по биофармации учебное пособие для студентов высших учебных заведений
 Скачать 2.44 Mb. Скачать 2.44 Mb.
|
|
ЭКСПЕРИМЕНТАЛЬНОЙ РАБОТЫ ПО ОПРЕДЕЛЕНИЮ ВЛИЯНИЯ ПРИРОДЫ МАЗЕВОЙ ОСНОВЫ НА СКОРОСТЬ ВСАСЫВАНИЯ СТРЕПТОЦИДА ИЗ МАЗЕЙ В КРОВЬ ЖИВОТНЫХ 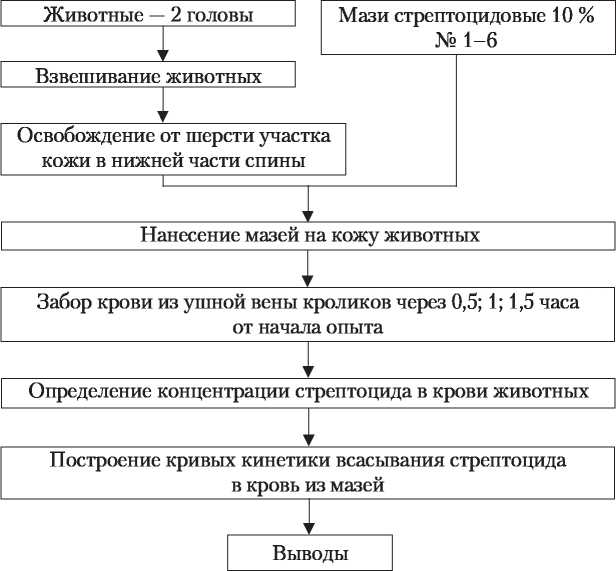 очищенную до метки при постоянном перемешивании. В 1 мл такого раствора Б содержится 15 мкг стрептоцида. Для построения калибровочного графика в ряд пробирок вносят 0,5; 1,0; 1,5; 2,0; 2,5; 3 мл раствора Б и, прибавляя воду очищенную 3,5; 3; 2,5; 2; 1,5; 1 мл соответственно, доводят растворы до общего объема 4 мл. Содержимое всех пробирок перемешивают и добавляют по 1 мл 15 % раствора трихлоруксусной кислоты. Из каждой пробирки отбирают 2,5 мл раствора, переносят в чистые сухие пронумерованные пробирки, к каждой пробе прибавляют при энергичном встряхивании 0,1 мл 0,5 % раствора натрия нитрита и через 10 минут 0,1 мл 40 % раствора мочевины. Все дальнейшие операции проводят аналогично описанным в определении стрептоцида в крови. Измерив оптическую плотность растворов, строят калибровочный график (рис. 3). По оси абсцисс откладывают известные концентрации стрептоцида в растворе (м кг/мл), а по оси ординат — соответствующие им показания оптической плотности раствора. 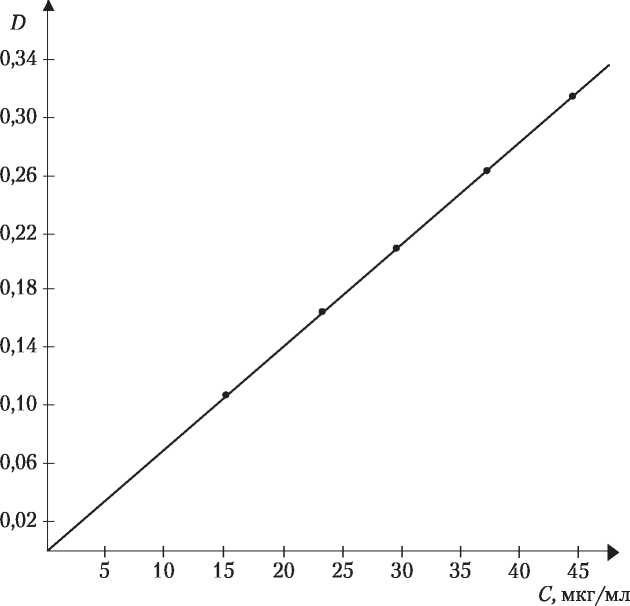 Рис. 3. Калибровочный график для количественного определения стрептоцида в крови Определение стрептоцида в крови В центрифужные пробирки для осаждения белков добавляют 4,8 мл 5 % раствора трихлоруксусной кислоты, микропипеткой добавляют 0,2 мл крови, взятой из ушнойвены кролика, перемешивают, ополаскивая микропипетку содержимым пробирки 2-3 раза, и оставляют на несколько минут до полного гемолиза. Пробирки центрифугируют в течение 10 минут при 6000 об/мин. В химические пробирки наливают 2,5 мл центрифугата, 0,1 мл 0,5 % раствора натрия нитрита и тщательно перемешивают. По истечении 10 мин прибавляют 0,1 мл 40 % раствора мочевины и вновь перемешивают. Через 10 мин к пробам добавляют по 1,5 мл насыщенного раствора натрия ацетата и 0,25 мл 0,5 % раствора резорцина и оставляют на 15 минут, содержимое тщательно перемешивают стеклянной палочкой или взбалтывают. Оптическую плотность раствора измеряют с помощью прибора ФЭК-56 ПМ (синий светофильтр № 4, кюветы с толщиной слоя 10 мм). Параллельно проводят фотоколориметрирование контрольной пробы, не содержащей стрептоцида, обработанной аналогично опытным образцам. Концентрацию стрептоцида (X, мкг/мл) в крови опытных животных определяют по формуле: V{а ’ где С — концентрация вещества, определенная по калибровочному графику (м кг/мл); V — общий объем центрифугата (мл); Vi— количество центрифугата, взятое для определения стрептоцида (мл); а — количество крови, взятое на анализ (мл); К — количество крови, на которое производится расчет (обычно на 1 или 100 мл, в нашем опыте на 1 мл). Пример расчета Мазь №2.10 % стрептоцидовая мазь (на вазелин-ланолиновой основе). 0,5 часа = 25 (м кг/мл); 2,5-2 4 1 час ,7-5-1 ч ——-— = 47 (м кг/мл); 1,5 часа 2,5-2 Полученные результаты внесите в табл. № 7. Таблица 7 ВЛИЯНИЕ ВСПОМОГАТЕЛЬНЫХ ВЕЩЕСТВ НА ВСАСЫВАНИЕ СТРЕПТОЦИДА В КРОВЬ ИЗ МАЗЕЙ
Используя данные, приведенные в таблице № 7, постройте кривые кинетики всасывания стрептоцида в кровь в зависимости от природы используемой основы в координатах: концентрация вещества (м кг/мл) по оси абсцисс, а по оси ординат — время (t, ч). После выполнения задания сформулируйте выводы о влиянии природы мазевой основы на скорость всасывания стрептоцида в кровь животных. Сравните данные эксперимента, полученные методами «in vivo» и «in vitro». Сделайте вывод о корреляции этих методов. Занятие № 3 Тема: ВЛИЯНИЕ ЛЕКАРСТВЕННОЙ ФОРМЫ НА ПРОЦЕСС ВЫСВОБОЖДЕНИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ИЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Выбор лекарственной формы определяет не только товароведческие характеристики лекарственного препарата, но, в первую очередь, оказывает существенное влияние на фармакотерапию. Вопрос о влиянии вида лекарственной формы на фармакологическое действие лекарственного препарата является одним из основных в биофармацевтических исследованиях, т. к. лекарственная форма оказывает существенное влияние на процессы всасывания лекарственных веществ, а иногда и проявление ими нежелательного побочного действия. Назначение лекарственного средства в виде наиболее рациональной лекарственной формы позволяет обеспечивать оптимальный терапевтический эффект, регулировать скорость и длительность его наступления. Так, например, инъекционные лекарственные препараты являются, как правило, ургентными, а мази, капсулы, таблетки могут быть использованы для пролонгирования лечебного действия. Кроме того, вид лекарственной формы предполагает путь введения лекарственных веществ в организм, что во многих случаях немаловажно в связи с физическим состоянием лекарственных веществ и простой химической модификацией. Таким образом, изучение данной темы является весьма актуальным для формирования у провизора-технолога научно обоснованного представления о роли лекарственной формы в фармакотерапии и возможности замены, в случае необходимости, одной лекарственной формы другой. Цель занятия: Формирование знаний, умений, практических навыков по изучению влияния вида лекарственной формы на процесс высвобождения лекарственных веществ из лекарственных препаратов. Для этого необходимо: Знать физико-химические свойства входящих в пропись ингредиентов и уметь находить их в АНД. Заполнять капсулы лекарственным средством. Знать способы приготовления мазей и суппозиториев с учетом физико-химических свойств лекарственных веществ. Владеть методами «in vitro» для определения высвобождения лекарственных средств из лекарственных форм. Пользоваться методами «in vivo» для определения концентрации лекарственных веществ в крови животных. Вводить различные лекарственные формы животным (мази, суппозитории и др.) и делать забор крови. Проводить количественное определение сульфаниламидных препаратов фотоколориметрическим методом. Строить кривые зависимости концентраций лекарственных веществ в крови животных от времени. Обобщать полученные данные и делать выводы о зависимости терапевтического эффекта от вида лекарственной формы. ЩЗД Теоретические вопросы, на основании которых возможно выполнение целевых видов деятельности Методы получения таблеток. Влияние фармацевтических факторов на терапевтическую активность таблеток. Желатиновые капсулы, получение и методы заполнения. Влияние фармацевтических факторов на их терапевтическую активность. Понятие о растворимости лекарственных препаратов. Фармакопейный тест определения растворимости. Влияние вида лекарственной формы на скорость всасывания лекарственного вещества, его концентрацию в биологических жидкостях и стабильность препаратов. Понятие о фармакодинамике и фармакокинетике лекарственных препаратов. Виды биологической доступности лекарственных препаратов. Определение абсолютной и относительной биологической доступности лекарственных препаратов. Расчет площади под фармакокинетической кривой. Константы всасывания и элиминации. Отличительные особенности в реактивности различных видов животных на введение биологически активных веществ. Корреляция методов «in vitro» и «in vivo» при определении высвобождения и биодоступности лекарственных веществ. Аудиторная самостоятельная работа ОБУЧАЮЩИЕ ЗАДАНИЯ Задание № 1 Установить влияние вида лекарственной формы на процесс высвобождения фенольного гидрофильного препарата прополиса методом «in vitro». Методические рекомендации к выполнению задания Влияние лекарственной формы на процесс высвобождения лекарственных веществ можно проследить на различных лекарственных формах: таблетках, капсулах, микстурах, мазях, свечах, растворах для инъекций и др. Для сравнения можно использовать 2 и более лекарственные формы одного и того же лекарственного вещества. Объектом исследования служат таблетки, покрытые оболочкой, и капсулы «Прополтин» по 0,05. Приготовление таблеток: Покрытые оболочкой таблетки «Прополтин» используют готовые. Их опытные образцы получены на ОЗ ГНЦЛС методом прямого прессования. Приготовление капсул «Прополтин» Для заполнения используют желатиновые капсулы № 4, полученные также методом прессования в заводских условиях. Капсулы заполняют ручным способом по 0,1 смеси фенольного гидрофильного препарата прополиса со вспомогательными веществами. В состав смеси входят те же вспомогательные вещества, что и в таблетках. Перед выполнением задания ознакомьтесь с алгоритмом экспериментальной работы к заданию № 1 (приложение 7). Приложение 7 | |||||||||||
