Практикум по биофармации А.И. Тихонов 2003 г. — копия. Практикум по биофармации учебное пособие для студентов высших учебных заведений
 Скачать 2.44 Mb. Скачать 2.44 Mb.
|
р ,АЛГОРИТМ ЭКСПЕРИМЕНТАЛЬНОЙ РАБОТЫ ПО ОПРЕДЕЛЕНИЮ ВЛИЯНИЯ СТЕПЕНИ ДИСПЕРСНОСТИ СТРЕПТОЦИДА НА ПРОЦЕСС ЕГО ВЫСВОБОЖДЕНИЯ ИЗ МАЗЕЙ МЕТОДОМ «АГАРОВЫХ ПЛАСТИНОК* 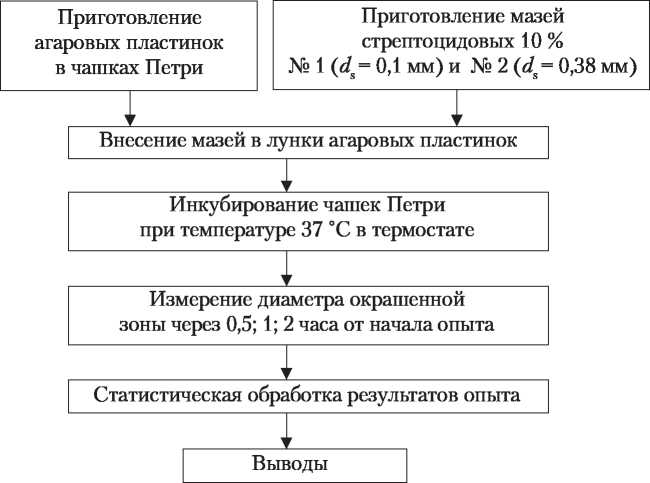 Приготовление геля и агаровых пластинок Агаровый гель готовят 2 % концентрации в предварительно старированном стеклянном стакане, плотно закрытом крышкой. Измельченный агар (ГОСТ 6470 - 53) заливают водой очищенной и оставляют на 30 мин для набухания. Набухший агар нагревают до кипения, доводят до необходимой массы и к теплому гелю добавляют 5 % реактива Эрлиха. Состав реактива Эрлиха: п-диметиламинобензальдегида 0,5 г, концентрированной кислоты хлороводородной и этанола 95 % по 15 мл, н-бутанола 90 мл. Приготовленный агаровый гель разливают в чашки Петри (диаметр 98-100 мм, высота 20 мм), которые расставляют на столе, предварительно выверенном по горизонтальному уровню с помощью ватерпаса. Агар разливают в чашки двумя порциями по 10 и 15 мл. После застывания первой порции агара на ее поверхность в каждую чашку помещают три цилиндра из нержавеющей стали или стекла (наружный диаметр 8 мм, высота до 10 мм) и заливают второй слой агара. После застывания агара цилиндры осторожно вынимают. Технология мазей Для получения фракций различной степени дисперсности 50 г стрептоцида просеивают через набор сит, отделяя частицы размером 0,38 мм. Стрептоцид с частицами менее 0,38 мм дополнительно измельчают в ступке с 95 % спиртом в течение 10 мин и просеивают через сита, отбирая фракцию с размером частиц 0,1 мм. Мази готовят 10 % концентрации с использованием любой имеющейся в наличии мазевой основы (например, вазелина), часть которой предварительно подплавляют и смешивают с определенной фракцией стрептоцида. Во избежание нежелательного дальнейшего измельчения частиц дисперсной фазы, мазевую основу подплавляют и смешивают с веществом, используя пропеллерную мешалку (1500 об/мин). При отсутствии пропеллерной мешалки мазь можно приготовить следующим образом: в ступку помещают стрептоцид с определенным размером частиц и смешивают по правилу Дерягина с половинным количеством расплавленной основы, а затем добавляют оставшуюся нерасплавленную основу и перемешивают. Определение скорости высвобождения лекарственных веществ из мазей Мази, содержащие лекарственное вещество с различной степенью дисперсности, помещают в лунки двух чашек с агаром. Чашки нумеруют или указывают степень измельчения. Мазь в лунки вносят с помощью стеклянной палочки, осуществляя контроль за тем, чтобы был хороший контакт с агаром. Чашки помещают в термостат с температурой 37 °C. Лекарственное вещество, высвобождаясь из мази, диффундирует в агаровый гель, взаимодействуя с реактивом Эрлиха и образуя окрашенную зону. Через 0,5; 1; 2 часа с помощью линейки измеряют диаметр окрашенной зоны. В случае образования эллипса измеряют больший и меньший диаметр и определяют среднее значение диаметра окрашенной зоны. Статистическую обработку полученных результатов проводят по методу Монцевичюте-Эрингене. Ошибку среднего арифметического вычисляют по формуле: т - ± Z а • k, где т — ошибка среднего арифметического диаметров окрашенных зон; Z — сумма; а — цифровые значения отклонений диаметров зон от среднего арифметического со знаком «плюс» или «минус»; k — величина, зависящая от числа вариантов, т. е. количества опытов (п) для каждого образца мази (табл. 1). Пример расчета Мазь № 1. (d = 0,1 мм). 1 час d. - 20 мм 20 + 20 + 21 d2 = 20 мм б/ср = + + = 20,3 (мм) 3 - 21 мм
а - | + 0,3 | + | +0,3 | + | - 0,7 | - 1,3 (значения ««» суммируются без учета алгебраических знаков); т= 1,3-0,29004 = 0,38; d - 20,3 ± 0,38 (мм). Полученные данные внесите в табл. № 1. Таблица 1 ДИФФУЗИЯ СТРЕПТОЦИДА С РАЗЛИЧНОЙ СТЕПЕНЬЮ ДИСПЕРСНОСТИ ИЗ МАЗЕЙ
После выполнения задания сформулируйте выводы о влиянии степени дисперсности стрептоцида на его высвобождение. Задание № 2 Установить влияние степени дисперсности стрептоцида на процесс его высвобождения из мазей методом диализа через полупроницаемую мембрану. Методические рекомендации к выполнению задания Для оценки степени высвобождения лекарственных веществ из мазей используют метод прямой диффузии, при которой лекарственное вещество из мазевой основы диффундирует в среду, отделенную от мази полупроницаемой мембраной. В качестве мембраны используют целлофан толщиной 45 мкм. Средой является вода очищенная. Перед выполнением задания ознакомьтесь с алгоритмом экспериментальной работы к заданию № 2 (приложение 2). Приложение 2 АЛГОРИТМ ЭКСПЕРИМЕНТАЛЬНОЙ РАБОТЫ ПО ОПРЕДЕЛЕНИЮ ВЛИЯНИЯ СТЕПЕНИ ДИСПЕРСНОСТИ СТРЕПТОЦИДА НА ПРОЦЕСС ЕГО ВЫСВОБОЖДЕНИЯ ИЗ МАЗЕЙ МЕТОДОМ ДИАЛИЗА 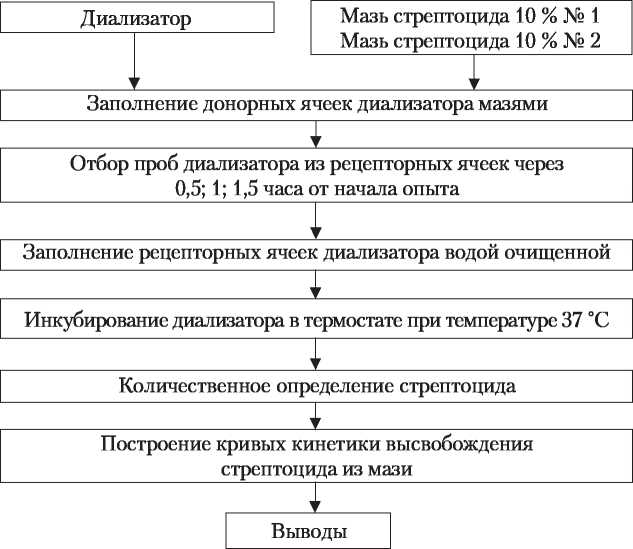 Определение степени высвобождения стрептоцида из мазей Для эксперимента используют камеру для диализа с двумя ячейками, состоящую из двух частей. Ячейки нумеруют, в 1-ю донорную ячейку помещают стрептоцидо- вую мазь с диаметром частиц 0,1 мм, во 2-ю — с диаметром частиц 0,38 мм. Ячейки должны быть заполнены доверху. На поверхность накладывают целлофан и собирают диализатор (рис. 1). С помощью пипетки с тонким концом или шприца с иглой в рецепторные ячейки вносят по 15 мл воды очищенной. Диализатор помещают в термостат при температуре 37 °C.  а б Рис. 1. Диализатор в собранном виде (а) и разобранном (б) Отбор проб диализата из рецепторных ячеек проводят через 0,5; 1; 1,5 часа от начала опыта, восполняя водой очищенной отобранное количество раствора. Образец пробы диализата анализируют на содержание стрептоцида. Количественное определение стрептоцида В мерную колбу на 100 мл вносят 2 мл анализируемого диализата, содержащего 0,05-0,5 мг стрептоцида, прибавляют 8 мл воды очищенной и 2,5 мл 10 % раствора кислоты хлороводородной. Колбу помещают на 10 минут в ванну со льдом, затем прибавляют 5 мл 0,5 % свежеприготовленного раствора натрия нитрита. Через 5 мин прибавляют 1 г мочевины и взбалтывают. Спустя 15 мин прибавляют 1 мл свежеприготовленного 0,5 % раствора тимола в 10 % растворе натрия гидрооксида и 5 мл 10 % раствора натрия гидрооксида. Через 10 мин содержимое колбы доводят водой до метки. Содержание стрептоцида определяют на фотоэлектроколориметре КФМ-Ц-2 с синим светофильтром (максимум пропускания 400 нм) в кювете с толщиной слоя 10 мм. В качестве контроля используют смесь всех реактивов, обработанную аналогично. Фотоэлектроколориметр КФ М-Ц-2 предварительно калибруют по стандартному раствору. Приготовление стандартного раствора В мерную колбу на 1000 мл вносят 0,05 г (точная навеска) стрептоцида, растворяют в 10 мл спирта этилового и доводят водой очищенной до метки. В 1 мл раствора содержится 0,05 мг стрептоцида. В мерную колбу на 100 мл вносят 6 мл приготовленного раствора стрептоцида, прибавляют 4 мл воды очищенной. Далее поступают, как указано в разделе количественного определения стрептоцида. Приготовленный стандартный раствор используют для калибровки фотоэлектроколориметра КФМ-Ц-2, устанавливая масштаб таким образом, чтобы показания прибора численно совпадали с концентрацией вещества в пределах ±2 единицы счета (0,3 ± 0,02). Расчет количества стрептоцида (X, мг), высвободившегося из мази за определенный промежуток времени, проводят по формуле: CV X =JT | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мазь | Количество высвободившегося стрептоцида, мг | ||
| 0,5 часа | 1 час | 1,5 часа | |
| №1 | | | |
| №2 | | | |
1^ст
где Соп — концентрация глюкозы в опытной пробе
(м моль/л);
Сст — концентрация глюкозы в стандартной пробе (м моль/л);
Е — оптическая плотность опытной пробы;
— оптическая плотность стандартного раствора.
Приложение 3
АЛГОРИТМ
ЭКСПЕРИМЕНТАЛЬНОЙ РАБОТЫ ПО ИЗУЧЕНИЮ ВЛИЯНИЯ ПОЛИМОРФНЫХ МОДИФИКАЦИЙ ПРЕПАРАТОВ ИНСУЛИНА НА СКОРОСТЬ ЕГО ВЫСВОБОЖДЕНИЯ
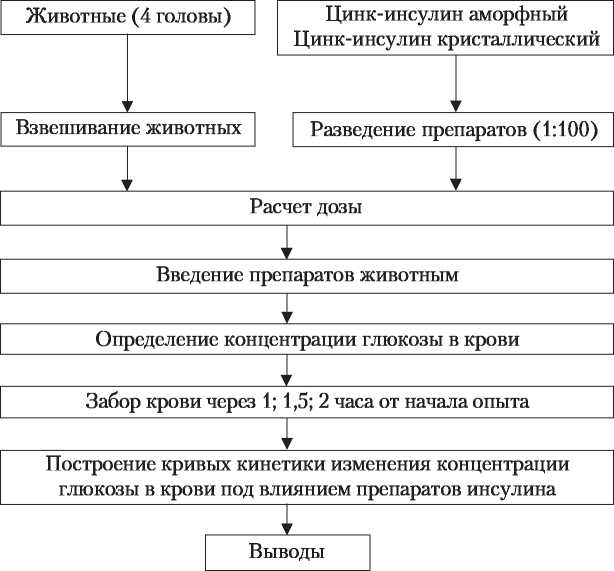
Полученные экспериментальные данные внесите в таблицу № 3 и на их основании постройте график в координатах: по оси ординат — концентрация глюкозы в крови (С, м моль/л); по оси абсцисс — время (t, ч).Таблица 3
КОНЦЕНТРАЦИЯ ГЛЮКОЗЫ В КРОВИ БЕЛЫХ КРЫС
ПОД ВЛИЯНИЕМ ПРЕПАРАТОВ ИНСУЛИНА
В ДОЗЕ 1 ЕД/кг
| Маркировка | Масса животного, кг | Препарат | Концентрация глюкозы в крови, м моль/л | |||
| исходная | 1 час | 1,5 часа | 2 часа | |||
| | | | | | | |
После выполнения задания сформулируйте выводы о влиянии полиморфных модификаций цинк-инсулина на уровень сахара в крови
.Занятие № 2
