ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО ХИМ ТЕРМОДИНамиКЕ. Практикум по химической термодинамике учебное пособие для студентов всех специальностей
 Скачать 2.28 Mb. Скачать 2.28 Mb.
|
1.2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬОсновы калориметрии Разработка методов экспериментального определения тепловых эффектов химических реакций, теплот фазовых превращений, теплот растворения и теплоемкостей составляет предмет калориметрии. Основной частью калориметрических установок является калориметр (от лат. calor – тепло и греч. metron – метр) – прибор для измерения количества теплоты, выделяющейся или поглощающейся в каком-либо физическом, химическом или биологическом процессе. Термин «калориметр» был предложен А. Лавуазье и П. Лапласом (1780), а прибор изобретен Хуго Юнкерсом. Это прибор, представляющий собой сосуд, наполненный жидкостью с известной теплоемкостью (калориметрическая жидкость), окруженный теплоизолирующей оболочкой (вместо калориметрической жидкости может быть использовано массивное твердое тело). Исследуемый процесс проводится так, чтобы теплота, выделяющаяся в реакции, быстро и, по возможности, полностью передавалась калориметрической жидкости (или отнималась от нее в эндотермических процессах). Основной измеряемой величиной является изменение температуры калориметрической жидкости (Т). Зная теплоемкость калориметрической жидкости (С), можно легко рассчитать тепловой эффект реакции Е  сли же теплота не полностью отдается калориметрической жидкости и часть ее идет на нагрев других частей калориметра, а также окружающей среды, то для расчетов используют не теплоемкость калориметрической жидкости, а величину, называемую константой калориметра (К). Эту величину определяют заранее, проводя в том же калориметре реакцию, тепловой эффект которой известен заранее с большой точностью. В этом случае Типы калориметров Калориметры можно разделить на две большие группы: с постоянной температурой и с переменной температурой калориметрической жидкости. Калориметры с переменной температурой бывают диатермическими (изотермическими) и адиабатическими. В первом случае строго учитывается теплообмен с калориметрической жидкостью. При адиабатическом способе измерения обычно калориметрической жидкостью является сама регулирующая система, например, раствор, теплоизолированный от окружающей среды. Этот способ и используют в данной работе (рис. 1.1). ТРЕБОВАНИЯ БЕЗОПАСТНОСТИ ТРУДА При выполнении работы следует неукоснительно соблюдать правила работы в химической лаборатории. Работа №1.Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализацииЦель: Определить содержание кислоты в растворе по ее теплоте нейтрализации. Задачи работы 1. Определить постоянную калориметра. 2. Определить количество тепла, выделившегося при нейтрализации кислотой неизвестной концентрации щелочи. 3. Определить теплоту разведения кислоты. 4. Определить содержание кислоты в растворе. Обоснование При взаимодействии моль-эквивалента сильной кислоты с сильным основанием в разбавленных водных растворах выделяется почти одинаковое количество теплоты: 55,9 кДж/моль Постоянство теплот нейтрализации связано с тем, что при взаимодействии сильных кислот и оснований, полностью диссоциированных в водных растворах, из ионов Н+ (точнее из ионов гидроксония Н3О+) кислоты и ионов основания ОН- образуются молекулы воды: H+ +Cl- + K+ + ОН- = Cl- + K+ + H2O В тепловой эффект, наблюдаемый при нейтрализации, входят теплоты разведения кислоты щелочью и щелочи кислотой. Порядок выполнения работы 1. Определить постоянную калориметра. Для этого в стакан, в который налито 100 см3 дистиллированной воды, устанавливают в калориметр и закрывают крышкой с укрепленным в ней датчиком температуры. В отверстие крышки вставляют специальную пробирку, в которую предварительно насыпано 2 г измельченной соли с известной теплотой растворения NH4Cl. Затем в течение 5-7 минут фиксируют каждые 30 сек температуру предварительного периода. Проводят растворение соли. Затем в течение 7-10 минут фиксируют через каждые 30 сек температуру. Графическим методом в координатах время – температура определяют изменение температуры при растворении соли и рассчитывают постоянную калориметра. Постоянная калориметра в данном случае будет равна отклонению величины теоретической теплоты растворения от экспериментальной для данного количества соли. Пример расчета при определении постоянной калориметра Определим моляльную концентрацию раствора, образующегося при растворении 2г NH4Cl. Молярная масса NH4Cl – М = 53,5г/моль. 2 г NH4Cl составляют В справочнике для NH4Cl.даны интегральные теплоты растворения: при m=0,1, ∆Нm=15,1 кДж/моль, при m=0,2, ∆Нm=15,19 кДж/моль. Методом интерполяции определяем интегральную теплоту растворения для m = 0,37 моль/кг. Увеличение ∆Нm при увеличении моляльности на 0,1 составляет 15,19-15,1=0,09, тогда увеличение ∆Нm на 0,37-0,1=0,27 равно 0,09·0,27/0,1=0,243 кДж/моль. Отсюда интегральная теплота растворения NH4Cl при образовании раствора с m = 0,37 моль равно 15,1+0,243/53,5=287Дж/г. При растворении 2 г NH4Cl поглотилось Q=287·2 =574 Дж теплоты. Теплоемкость (Cp) раствора приблизительно равна 4,18Дж/г·К. Определяют графически рис. 2 изменение температуры растворения NH4Cl в координатах время – температура. Изменение температуры ∆Т1 = −1,1 К (С0). Постоянная калориметра К = –Q/∆Т1 – (m1+m2)Cp = –574/1,1 – (100+2)·4,18 = 102,96Дж/К. К=102,96Дж/К 2. Определить теплоту нейтрализации кислоты + теплоту разведения. Для определения теплоты нейтрализации и разведения в качестве калориметрической жидкости используют 0,15 М раствор NaOH. В стакан наливают 100 см3 щелочи и устанавливают его в калориметр. Затем в течение 5-7 минут фиксируют каждые 30 с температуру предварительного периода. Нейтрализацию проводят раствором HCl неизвестной концентрации. В медицинский шприц набирают 3 см3 кислоты и устанавливают шприц в крышку калориметра и приливают кислоту. Определяют теплоту нейтрализации Q1, приливая к большому объему щелочи небольшой объем кислоты. Затем в течение 7-10 минут фиксируют через каждые 30 с температуру. Определяют графически изменение температуры нейтрализации щелочи кислотой в координатах время – температура. Изменение температуры ∆Т2 = К (С0). Q1= К·∆Т2=Дж
Для определения теплового эффекта разведения HCl в стакан наливают 100 см3 воды и устанавливают его в калориметр. В медицинский шприц набирают 3 см3 кислоты и устанавливают шприц в крышку калориметра. Затем в течение 5-7 минут фиксируют каждые 30 сек температуру предварительного периода. Определяют теплоту разведения Q2, приливая к большому объему щелочи небольшой объем кислоты. Затем в течение 7-10 минут фиксируют через каждые 30 с температуру. Определяют графически изменение температуры разведения кислоты в координатах время – температура. Изменение температуры ∆Т3 = К (С0). Q2 =К·∆Т3 = Дж Тепловой эффект нейтрализации равен Q = Q1 - Q2 = Дж.
Энтальпия нейтрализации сильной кислоты ∆Нк-та = 55,9 кДж/моль. Число молей кислоты n = Q/∆Нк-та = моль. Концентрация кислоты определяется по формуле: CM = n/V = моль/л (V = 3 мл = 0,003 л). Работа №2.Исследование тепловых эффектов химических реакций.Для исследования тепловых эффектов реакций взаимодействия 1 н растворов CH3COOH и NaOH, HCl и NH4OH проводят измерения температуры смеси растворов с течением времени согласно п. 1 и п. 2 не менее 3 раз для каждой пары растворов: CH3COOH + NaOH = CH3COONa + H2O (реакция 2) HCl + NH4OH = NH4Cl + H2O (реакция 3) Результаты измерений сводятся в таблицу 1.2. Таблица 1.2
Графическая обработка результатов эксперимента 1. Определение изменение температуры в ходе химической реакции. Типичный вид температурной кривой правильно поставленного калориметрического опыта при измерении экзотермического эффекта показан на рис. 1.2. Расчет величины изменения температуры в ходе химической реакции T с учетом теплообмена по закону Ньютона производится графическим методом. Н 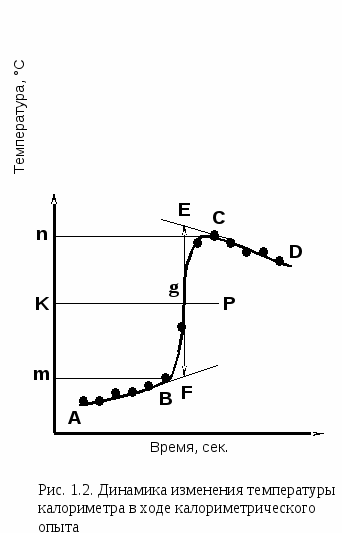 а миллиметровой бумаге построить зависимость температуры (С) от времени (с). На оси абсцисс откладывается время в масштабе 1 с = 1 мм, на оси ординат – температура в масштабе 1С = 5 см (рис. 1.2). После того как на график нанесены все экспериментальные точки, получается кривая ABCD. Участок AB называется начальным периодом, BC - главным, CD - конечным. Чтобы определить T, не искаженное тепловым обменом, происходящим в течение времени главного периода, продолжают линии AB и CD до пересечения с вертикальной прямой EF. Для этого точки m и n, соответствующие начальной и конечной температурам главного периода, наносят на ось ординат. Через середину отрезка mn проводят линию KP. Пересечение этой линии с кривой BC дает точку g, определяющую положение прямой EF. Отрезок EF будет равен T. Характер линии BC зависит от условий протекания теплового процесса (например, от смешивания), наклон кривой AB и CD зависит от характера теплообмена с окружающей средой. Результаты эксперимента необходимо представить в виде таблицы 1.3. Таблица 1.3
2. Расчет систематической погрешности Систематическая погрешность проведенных измерений возрастания температуры раствора в ходе реакции при доверительной вероятности 0,95 определяется по формуле: где Θj систематическая погрешность всех использованных средств измерения:
3. Расчет погрешности в определении теплового эффекта реакции Погрешность в определении теплового эффекта исследуемой реакции определяется как погрешность косвенных измерений из выражения Погрешность в определении теплового эффекта калибровочной реакции, известного с большой точностью может быть близкой к нулю. Погрешности в определении возрастания температуры раствора в ходе реакции нейтрализации (Т0) и (Т1,2), как показывает практика, определяется систематической погрешностью . Таким образом, погрешность в определении теплового эффекта может быть рассчитана по формуле Содержание и оформление отчета Отчет о проведенной работе должен включать:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
