ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО ХИМ ТЕРМОДИНамиКЕ. Практикум по химической термодинамике учебное пособие для студентов всех специальностей
 Скачать 2.28 Mb. Скачать 2.28 Mb.
|
2.2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬРабота №1.Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методомЦель: определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом. Оборудование и химические реактивы: глицериновая баня, штатив, термометр, колба коническая, измерительный цилиндр, стеклянная палочка; навеска электролита, вода дистиллированная. Порядок выполнения работы Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом производится с применением установки, схема которой представлена на рис. 2.4. 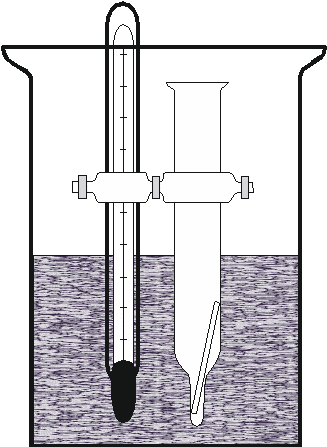 Рис. 2.4. Схема установки для проведения эксперимента
Таблица 2.1
ТРЕБОВАНИЯ БЕЗОПАСТНОСТИ ТРУДА При выполнении работы следует неукоснительно соблюдать правила работы в химической лаборатории. Работа №2Определение молекулярной массы вещества криоскопическим методомЦель: Определение молекулярной массы вещества криоскопическим методом. Оборудование и химические реактивы: криостат, дифференциальный термометр Бекмана, лупа, исследуемые растворы глюкозы, мочевины, глицерина различных концентраций, хлорид натрия технический, вода дистиллированная, лед. Порядок выполнения работы Определение температуры замерзания растворов производится в криостате, схема которого представлена на рис. 2.5.  Рис. 2.5. Криостат
3 – проволочная мешалка; 4 – внешний сосуд криостата
Термометр Бекмана представляет собой точный измерительный прибор с большим резервуаром ртути, благодаря чему по шкале можно отсчитать сотые доли градуса. При этом на шкале термометра укладывается интервал лишь в 50С. Поэтому предусмотрена настройка термометра на рабочий интервал путем переливания ртути из нижнего резервуара в верхний резервуар. В нашем случае в пределах шкалы должен оказаться интервал от 0 до –30С. Термометр устанавливается преподавателем или лаборантом. Его необходимо переносить без сотрясения и не наклоняя, чтобы из капилляра в верхний резервуар не упала капелька ртути. Это может произойти, когда термометр еще не охлажден. Устанавливая термометр, убеждаются в правильности погружения резервуара в воду: он не должен выступать из воды и касаться стенок сосуда.
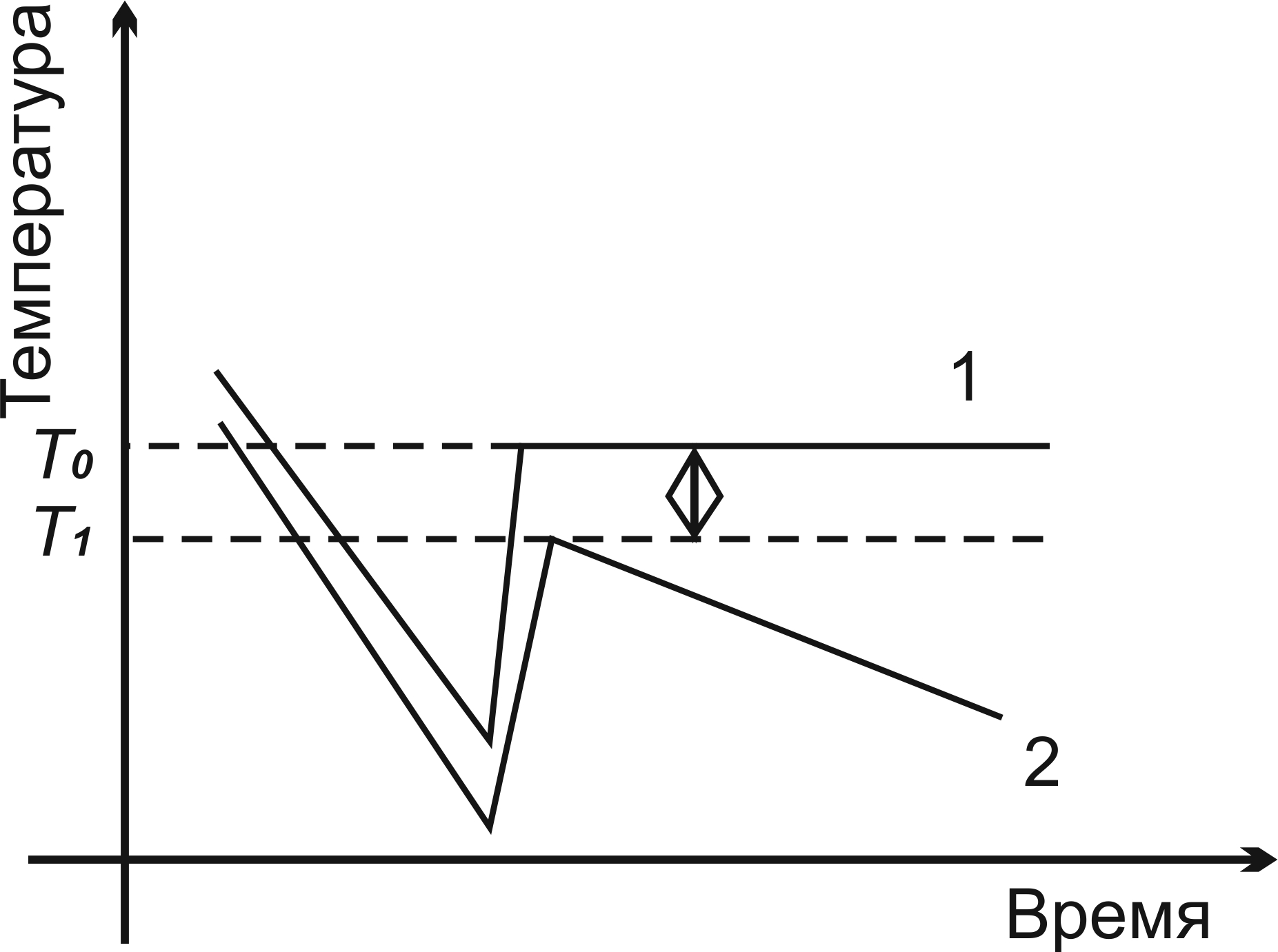 Рис. 2.6. Кривые охлаждения воды (1) и раствора (2). Т0 – температура замерзания воды, Т1 – температура замерзания раствора При работе с раствором особенно важно непрерывное перемешивание, препятствующее сильному переохлаждению жидкости. Дело в том, что по мере вымерзания воды из раствора концентрация последнего увеличивается, и температура замерзания дополнительно понижается. Поэтому после резкого скачка температуры вверх вновь начинается медленное понижение температуры (рис. 2.6). Обработка результатов эксперимента Таблица 2.2.
1. По уравнению М = Kк·g·1000/G∙ΔTзамерз рассчитывают молекулярную массу вещества. 2. Узнав у преподавателя (или лаборанта), какое вещество было дано для эксперимента, находят абсолютную и относительную ошибку эксперимента. Под абсолютной погрешностью измерения понимают разность между полученным в ходе измерения и истинным значением физической величины: Без сравнения с измеряемой величиной абсолютная погрешность ничего не говорит о качестве измерения. Одна и та же погрешность в 1 мм при измерении длины комнаты не играет роли, при измерении длины тетради уже может быть существенна, а при измерении диаметра проволоки совершенно недопустима. Поэтому вводят относительную погрешность, показывающую, какую часть абсолютная погрешность составляет от истинного значения измеряемой величины. Относительная погрешность представляет собой отношение абсолютной погрешности к истинному значению измеряемой величины: Относительная погрешность обычно выражается в процентах. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ТРУДА При выполнении работы следует руководствоваться правилами работы в химической лаборатории, представленными на экспериментальном стенде. Работа №3Определение осмотического давления раствора неэлектролитаЦель: Определение осмотического давления раствора неэлектролита. Оборудование и химические реактивы: осмометр, мерный стакан, сосуд с водой, линейка, фломастер, сахар, краситель (зеленка, тушь, чернила). Порядок выполнения работы Осмометр представляет собой целлофановый мешочек и закрепленную в нем стеклянную трубку. Целлофан является полупроницаемой пленкой, пропускающей только молекулы растворителя (воды), мешочек заполняют водным раствором сахара, подкрашивают и погружают в воду. В данном случае мешочек является моделью живой клетки, а полупроницаемая пленка моделью клеточной мембраны, через которую поступает вода. О поступлении воды можно судить по подъему раствора в трубке. Вода поступает через полупроницаемую пленку под действием осмотического давления и будет поступать до тех пор, пока осмотическое давление не уравновесится гидростатическим, создаваемым жидкостью в трубке.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ТРУДА При выполнении работы следует руководствоваться правилами работы в химической лаборатории, представленными на экспериментальном стенде. | |||||||||||||||||||||||||||||
