ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО ХИМ ТЕРМОДИНамиКЕ. Практикум по химической термодинамике учебное пособие для студентов всех специальностей
 Скачать 2.28 Mb. Скачать 2.28 Mb.
|
2. ИДЕАЛЬНЫЕ РАСТВОРЫ И ИХ СВОЙСТВА2.1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬРастворы Если в каком-либо веществе (среде) распределено в виде очень мелких частиц другое вещество, то такая система называется дисперсной. Наибольшее значение для химии имеют дисперсные системы, в которых средой является жидкость. Свойства дисперсных систем, в первую очередь их устойчивость, сильно зависят от размеров распределенных частиц. Если последние очень велики по сравнению с молекулами, дисперсные системы непрочны и распределенное вещество довольно быстро оседает (или, если оно удельно легче вещества среды, поднимается вверх). Подобные малоустойчивые дисперсные системы со сравнительно крупными распределенными частицами называются взвесями (размер таких частиц превышает 100 нм). Наоборот, если распределенное вещество находится в виде отдельных молекул, системы получаются вполне устойчивыми. Такие системы называются молекулярными растворами (обычно – просто растворами) и размер частиц не превышает 1 нм. Промежуточную область занимают коллоидные растворы, в которых размеры распределенных частиц находятся между размерами частиц взвесей и молекулярных растворов (от 100 до 1 нм). Молекулярные растворы представляют собой гомогенные системы, состоящие из растворителя и растворенного вещества. Эти два понятия в значительной мере условны. Выбор одного из компонентов за растворитель обычно связан с преобладанием его концентрации в растворе. Несмотря на то, что эквивалентные соотношения между растворенным веществом и средой (растворителем) при растворении не соблюдается, растворы нельзя рассматривать просто как механические смеси. По некоторым признакам они близки к химическим соединениям. В частности, при растворении всегда поглощается или выделяется энергия (теплота растворения) и происходит изменение объема. При образовании раствора происходит изменение свойств, как растворителя, так и растворенного вещества. Совокупность всех процессов, протекающих в результате введения в растворитель растворенного вещества, называется сольватацией. В результате сольватации в растворе могут возникнуть различные соединения переменного состава, включающие в себя частицы, как растворителя, так и растворенного вещества. Такие соединения называют сольватами. В результате взаимодействия между растворителем и растворенным веществом изменяется соответственно их структура, следовательно, свойства раствора должны отличаться от свойств чистого растворителя. Образование сольватов может быть рассмотрено как протекание химических реакций и, как и любой химический процесс. Как было отмечено выше, оно сопровождается тепловыми и объемными эффектами. Однако в ряде случаев тепловые и объемные эффекты при образовании раствора отсутствуют. Такие растворы называются идеальными. Идеальные растворы Соотношения между составом и свойствами жидких растворов оказываются в общем случае очень сложными. Для определения свойств реальных растворов допускают заведомую неточность, считая раствор идеальным. Идеальные растворы по своим свойствам близки к идеальным газам, то есть системам, получаемым простым механическим перемешиванием компонентов на молекулярном уровне. В этом случае силами взаимодействия между частицами разных веществ (А и В) можно пренебречь по сравнению с силами взаимодействия каждого из компонентов (А-А и В-В). Наиболее близкими по своим свойствам к идеальным растворам являются растворы веществ, близких по своему строению и свойствам (например, растворы толуола в бензоле, метилового спирта в этиловом и др.). Кроме того, как идеальные можно рассматривать сильно разбавленные растворы неэлектролитов. В первом случае взаимодействие между частицами растворенного вещества и растворителя примерно одинаково, а во втором – незначительность концентрации растворенного вещества и отсутствие электростатических зарядов у продуктов его взаимодействия с растворителем – приводят к тому, что изменения в строении растворителя носят локальный характер. Частицы растворенного вещества в сильно разбавленном растворе неэлектролита находятся друг от друга на значительном расстоянии, их взаимодействие между собой можно пренебречь, и растворитель практически не изменяет своего строения и свойств. Свойства идеальных растворов Понижение давления насыщенного пара растворителя Изучение свойств идеальных растворов начинают с установления зависимости между давлением компонента и его концентрацией в растворе. С поверхности жидкого или твердого тела при любой температуре происходит испарение частиц. С другой стороны, происходит и уменьшаем этим число теле понента, умноженному на его мольную долю, в растворе.льно его и обратный процесс захвата поверхностью частиц из газопаровой фазы (адсорбция). Между этими процессами устанавливается динамическое равновесие и давление паров над жидкостью или твердым телом при фиксированной температуре является вполне определенной величиной. Пар, находящийся в равновесии с жидкостью или твердым телом называется насыщенным. Переход одного из компонентов раствора (например, растворителя) в газообразную фазу тем значительнее, чем больше относительное содержание молекул данного вещества, давление компонента над раствором должно быть пропорционально его мольной доле в растворе, т. е. РА = const NА. Коэффициент пропорциональности определяется из начального условия: если NА = 1, то РА0 = const, т. е. постоянная равна давлению чистого компонента. Парциальное давление компонента идеального раствора равно давлению чистого компонента, умноженному на его мольную долю, в растворе:
Растворяя небольшое количество какого-нибудь вещества в данном растворителе, мы, естественно понижаем концентрацию молекул последнего в единице объема (т. е. уменьшается N1) и уменьшаем этим число молекул, вылетающих в единицу времени из жидкой фазы в парообразную (т. е. уменьшается значение Р1). В результате равновесие между жидкостью и паром установится при меньшей концентрации пара, т. е. при меньшем его давлении. Следовательно, давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем. При этом понижение давления пара будет тем больше, чем больше концентрация растворенного вещества в растворе. Обозначим буквой А растворитель, а буквой В – растворенное вещество. Концентрация растворенного вещества в растворе при выражении ее в мольных долях этого вещества NB связана с NA простым соотношением NA + NB =1. Определяя отсюда NА и подставляя в (2.1), получаем
В графической форме это соотношение представлено на рисунке 2.1. Точка Р0А отвечает давлению пара над чистым компонентом А, а точка РА – давлению насыщенного пара компонента А над раствором. Из этого соотношения следует, что
Разность (Р0А - РА) называется понижением давления насыщенного пара, а отношение (Р0А - РА)/Р0А относительным понижением давления насыщенного пара. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе. Это соотношение называется законом Рауля (1887). 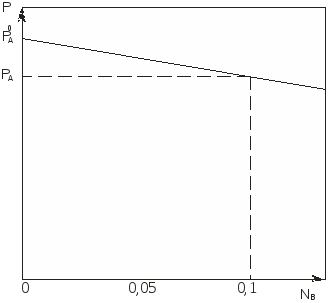 Рис. 2.1. Понижение давления пара растворителя над раствором По мере повышения концентрации в большинстве растворов возникают отклонения от этой зависимости, различные как по величине, так и по направлению. Систематические отклонения другого характера обнаруживают водные растворы солей, кислот и оснований как концентрированные, так и разбавленные. Вследствие электролитической диссоциации в этих растворах находится в действительности большее число частиц, чем было бы недиссоциированных молекул, что вызывает всегда большее понижение давления пара. Отклонения от закона Рауля могут быть положительными и отрицательными. Положительные отклонения объясняются тем, что сила взаимодействия между частицами растворенного вещества и растворителя (А-В) мала по сравнению с силами взаимодействия между частицами одного и того же вещества (А-А и В-В). В этом случае связывание компонентов в растворе уменьшается, а летучесть – возрастает. Образование такого раствора обычно сопровождается увеличением объема и выделением тепла (например, раствор этилового спирта и диэтилового эфира). Для растворов с отрицательным отклонением от закона Рауля характерно уменьшение давления паров над раствором, по сравнению с идеальными растворами. Эти отклонения связаны с более сильным взаимодействием между частицами компонентов раствора по сравнению с чистыми компонентами. Отрицательные отклонения наблюдаются для растворов, склонных к образованию сольватов, ассоциатов и т. п. Образование таких растворов сопровождается обычно уменьшением объема и выделением тепла. Парообразование с поверхности такого раствора затруднено, что и вызывает отрицательные отклонения. Если растворенное вещество нелетучее или малолетучее, то при относительно невысоких концентрациях в растворе можно пренебречь давлением его паров над раствором. Следовательно, Р0 = Р1 + Р2 = Р0∙N1, N1 + N2 = 1. То есть давление паров растворителя над раствором всегда ниже, чем над чистым растворителем, так как его доля в растворе всегда меньше единицы. Данная закономерность известна как другая формулировка закона Рауля, согласно которой относительное понижение давления паров растворителя над раствором (∆Р) по сравнению с чистым растворителем равно мольной доле растворенного вещества (N2):
На рис. 2.2 приведены кривые, иллюстрирующие влияние концентрации растворенного вещества на давление насыщенного пара над поверхностью раствора. Известно, что жидкость закипает при той температуре, когда давление насыщающих паров над ней достигает внешнего (например, атмосферного) давления. Следовательно, чем ниже давление насыщающих паров над раствором, тем при более высокой температуре он будет закипать (дополнительное повышение температуры необходимо для того, чтобы достичь внешнего давления). 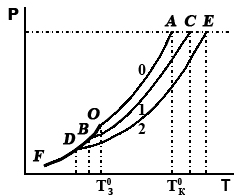 Рис. 2.2. Зависимость температуры кипения и отвердевания растворов от их концентрации. Кривая 0 соответствует зависимости давления насыщающих паров растворителя от температуры для чистого растворителя, а кривые 1 и 2 - для различных растворов. При этом концентрация 2-го раствора (кривая 2) выше концентрации 1-го раствора (кривая 1). Температура кристаллизации разбавленных растворов Раствор, в отличие от чистой жидкости, не отвердевает целиком при постоянной температуре. Кристаллы начинают выделяться при какой-то одной температуре; по мере понижения температуры количество их растет, пока, наконец, весь раствор не отвердеет. Таким образом, отвердевание раствора происходит обычно не при одной температуре, а на протяжении некоторого интервала температур. Температурой начала кристаллизации раствора (или температурой замерзания раствора) называют температуру, при которой в результате охлаждения раствора начинается образование кристаллов. Опыт показывает, что разбавленный раствор замерзает при температуре более низкой, чем чистый растворитель. Так, морская вода замерзает не при 00С, а при несколько более низкой температуре. Введем для характеристики температур замерзания растворов величину понижения температуры замерзания ∆Тзамерз., определяя ее как разность между температурами замерзания чистого растворителя Тзамерз. р-рителя и раствора Тзамерз. р-ра: ∆Тзамерз. = Тзамерз. р-рителя - Тзамерз. р-ра Для вывода основных закономерностей рассмотрим Т - р диаграмму (см. рис. 2.2) и примем, что растворителем является вода. Кривая ОА представляет зависимость давления насыщенного пара чистой воды от температуры, а кривые ВС, DE и т. д. – давления насыщенного пара над растворами различных составов (они должны расположиться, очевидно, ниже кривой ОА, так как раствор обладает меньшим давлением насыщенного пара). Кривая ОF выражает температурную зависимость давления насыщенного пара льда. Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давления насыщенного пара растворителя над кристаллами и над раствором одинаковы, т. е. когда кривая ОF пересечет кривую давления пара раствора данной концентрации. Температура, отвечающая этому условию, должна быть более низкой, чем температура замерзания чистого растворителя. Как видим из рисунка, понижение температуры кристаллизации раствора пропорционально понижению давления паров чистого растворителя. Поэтому раствор всегда замерзает при более низкой температуре, чем чистый растворитель:
где С – концентрация растворенного вещества, выражаемая в молях на 1000 г растворителя, т.е. моляльность; K – коэффициент пропорциональности (криоскопическая постоянная), зависящий только от природы растворителя (для воды К = 1,86, для бензола К = 5,07). Моляльная концентрация может быть определена по формуле:
где g – масса растворенного вещества (г); M – молекулярная масса растворенного вещества (г/моль); G – масса растворителя (г). Физический смысл криоскопической константы ясен из выражения (2.5). К представляет собой изменение температуры, происходящее при введении в раствор 1 моля вещества на 1 кг растворителя. Теоретически значение криоскопической константы может быть вычислено по формуле:
где Тс – температура кристаллизации чистого растворителя; R – универсальная газовая постоянная; F – удельная теплота плавления чистого растворителя. Температура кипения разбавленных растворов Если рассматривать растворы нелетучего вещества в летучих растворителях, то температуры кипения таких растворов всегда выше температуры кипения чистого растворителя при том же давлении. Повышение температуры кипения будет тем большим, чем выше концентрация раствора, и для разбавленных растворов его можно считать пропорциональным концентрации. Приближенно эту закономерность можно вывести, пользуясь той же Т – р диаграммой (см. рисунок 2.2). Температура кипения жидкости зависит от внешнего давления: жидкость начинает кипеть после того, как давление ее насыщенных паров достигает величины внешнего давления, действующего на поверхности жидкости. Температура кипения жидкости при давлении 101,3 кПа (1 атм) называется нормальной температурой кипения. Например, нормальная температура кипения воды равняется 1000С. Замерзают (кристаллизуются) чистые жидкости также при строго определенной температуре. По сравнению с чистыми растворителями растворы кипят при более высокой, а замерзают, как было указано выше, при более низкой температуре. Повышение температуры кипения (Т0кип) и понижение температуры замерзания (Т0зам) растворов соответствуют принципу Ле Шателье. Рассмотрим это на примере кипения раствора. При 1000С установилось равновесие между жидкостью и паром. Н2О (ж) = Н2О (г) Если теперь в воде растворить какой-либо нелетучий компонент, то концентрация воды в полученном растворе окажется пониженной по сравнению с чистым растворителем. Равновесие обратимой реакции, в соответствии с принципом Ле Шателье, сместиться в сторону увеличения концентрации молекул воды: Н2О (ж) = Н2О (г). Новое равновесие установится при более высокой температуре. Французский химик Рауль установил, что повышение температуры кипения и понижение температуры замерзания растворов пропорциональны моляльной концентрации растворов:
где Кэ – эбуллиоскопическая константа («эбуллио» – кипение); Кк – криоскопическая константа («криос» – холод). Эбуллиоскопическая и криоскопическая константы зависят только от природы растворителя. Каждый растворитель характеризуется своей эбуллиоскопической и криоскопической константами. Например, для воды Кэ = 0,520С; Кк =1,86 0С. Таким образом, изменение температуры кипения и замерзания растворов зависит от природы растворителя и концентрации раствора. Физический смысл эбуллиоскопической, как и криоскопической константы, можно установить следующим образом. Если концентрацию раствора принять равной единице (С = 1 моль/кг), то t0кип = Кэ, а t0зам = Кк. Отсюда очевидно, что криоскопическая константа равна понижению температуры замерзания одномоляльного раствора, а эбуллиоскопическая константа – повышению температуры кипения одномоляльного раствора. Изотонический коэффициент Растворы неэлектролитов (веществ, распадающихся в растворителе на молекулы) идеально подчиняются закону Рауля. Растворы электролитов (кислот, солей и гидроксидов), диссоциирующих в молярных растворителях на ионы, подчиняются закону Рауля лишь с определенной поправкой. Для растворов электролитов этот закон приобретает следующий вид:
где i - поправочный или изотонический коэффициент. Некоторые физические свойства растворов зависят только от концентрации частиц растворенного вещества и не зависят от индивидуальных свойств растворенного вещества. Эти свойства называются коллигативными. К их числу относятся повышение температуры кипения и понижение температуры затвердевания растворов. В растворе электролита благодаря диссоциации на ионы, всегда больше частиц, чем в растворе неэлектролита равной концентрации. Роль изотонического коэффициента заключается в том, что он учитывает увеличение концентрации частиц в растворах электролитов. Изотонический коэффициент численно всегда больше единицы. Если бы электролиты полностью распадались на ионы, то число частиц в растворе увеличивалось бы в целое число раз и изотонический коэффициент был бы целым числом - 2,3 и т.д. В действительности изотонический коэффициент всегда нецелое число и для раствора каждого электролита имеет свое значение. Значит, электролит диссоциирует в растворе частично, и каждый электролит - в разной степени. Степень диссоциации зависит от природы растворителя и растворяемого вещества. Диссоциация веществ на ионы может произойти только в полярном растворителе (наиболее полярным растворителем является вода). Чем более полярной является химическая связь в молекулах растворяемого вещества, тем выше степень его диссоциации. Молекулы солей связаны ионной связью, поэтому все соли - сильные электролиты. Степень диссоциации () показывает, какая часть растворенного электролита продиссоциировала на ионы:
где C - число молей вещества, продиссоциированных на ионы; Cо - общее число молей данного вещества в растворе. По степени диссоциации все электролиты подразделяются на слабые и сильные. Слабые электролиты диссоциируют частично (30%), в их растворах находятся в равновесии ионы и молекулы: HCNS H+ + CNS-; NH4OH NH4++ OH- Диссоциация слабых многоосновных кислот и гидроксидов протекает ступенчато: Н3РО4 Н+ + Н2РО4-; Н2РО4- Н+ + НРО42-; НРО42- Н+ + РО43-. Сильные электролиты диссоциируют полностью (30%), необратимо. Молекулы в растворе сильных электролитов отсутствуют: NaCl Na++ Cl-; H2SO4 2H++ SO42-. Таким образом, истинная степень диссоциации сильных электролитов равна 1 (или 100%). Вследствие значительной концентрации ионов в растворах сильных электролитов среднее расстояние между ионами незначительно и движение ионов стеснено их взаимными притяжением друг к другу. Чем концентрированнее раствор, тем сильнее тормозящее действие ионов друг на друга. В результате во всех процессах могут принимать участие не все ионы, находящиеся в растворе. Часть ионов, принимающих участие в протекающих в растворе процессах, называется кажущейся степенью диссоциация сильных электролитов (каж), которая всегда меньше единицы и уменьшается с повышением концентрации раствора из-за усиления тормозящего действия ионов друг на друга. Таким образом, кажущаяся степень диссоциации сильных электролитов всегда меньше и изотонический коэффициент также является нецелым числом. Эти две величины - степень диссоциации и изотонический коэффициент i связаны между собой соотношением:
где n - число ионов, на которые диссоциирует данный электролит. Соотношение (2.11) позволяет вычислить степень диссоциации, если известен изотонический коэффициент, а его легко вычислить по данным эбуллиоскопических или криоскопических измерений:
Явление осмоса Осмос – это переход молекул растворителя из области с более высокой их концентрацией в область с более низкой концентрацией через полупроницаемую мембрану. Осмос – особый вид диффузии. Во всех биологических системах растворителем служит вода. Некоторые мембраны (их называют обычно полупроницаемыми) пропускают только молекулы растворителя, задерживая все молекулы или ионы растворенного вещества. Однако мембраны живых клеток пропускают определенные молекулы или ионы содержащихся в растворителе веществ, проявляя в этом отношении избирательность, которая зависит от природы мембраны. Такие мембраны называют не полупроницаемыми, а дифференциально (избирательно) проницаемыми. Допустим, что водяной раствор А с высокой концентрацией растворенного вещества отделен избирательно проницаемой мембраной от водного раствора В с низкой концентрацией этого вещества. Раствор А по отношению к раствору В является гипертоническим, а раствор В по отношению к раствору А гипотоническим (растворы с одинаковым осмотическим давлением называются изотоническими). В этих условиях будет наблюдаться реальное перемещение молекул воды (растворителя) через полупроницаемую мембрану. Это будет происходить до тех пор, пока не наступит равновесие, после чего реального перемещения воды наблюдаться уже не будет - растворы станут изотоническими (равными по концентрации). Если какой-либо раствор отделен избирательно проницаемой мембраной от чистой воды, то гидростатическое давление, которое необходимо приложить, чтобы предотвратить осмотическое поступление воды в раствор, называют осмотическим давлением этого раствора. Чем выше концентрация раствора, тем выше его осмотическое давление. Измерить осмотическое давление какого-либо раствора как реальное давление можно только в приборе, который называется осмометром. В обычных условиях осмотическое давление раствора - это потенциальное давление, поэтому вместо термина «осмотическое давление» часто употребляют термин «осмотический потенциал». Осмотический потенциал, обозначаемый греческой буквой π (пи), принято выражать отрицательной величиной. Для молярного раствора сахарозы, например, при 200C осмотическое давление равно 3510 Па, а осмотический потенциал равен - 3510 Па. Чем выше концентрация раствора, тем выше осмотическое давление и тем ниже его осмотический потенциал. Осмотическое давление можно измерить на опыте по высоте поднятия раствора в трубке с полупроницаемой пленкой (рис. 2.3). Поместим раствор в маленький сосуд В, затянутый снизу полупроницаемой пленкой - бычьим пузырем и снабженный высокой трубкой С (достаточно широкой, чтобы можно было не учитывать явление капиллярности). 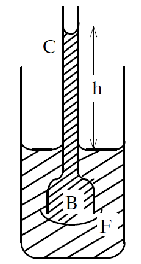 Рис. 2.3. Осмометр. Сосуд В погрузим в больший сосуд F, заполненный водой. Тогда раствор начнет подниматься по трубке и остановится на некоторой высоте h. Объяснение этому явлению такое: в момент опускания сосуда В в воду число молекул в 1 см3 в сосуде В меньше, чем в сосуде F: молекулы воды начнут диффундировать туда, где концентрация молекул воды меньше, т.е. в сосуд В. В результате возникнет гидростатическое давление жидкости в трубке (р'). Когда давление, оказываемое водой на пленку, в сосуде В возрастет от р' до р (р – давление со стороны молекул воды в сосуде F), преимущественный переход воды в раствор прекратиться. Но р = р' +Росм, следовательно р - р' = ρgh = Росм. Сравнивая эти формулы, находим:
где ρ - плотность раствора, h - разность уровней жидкости в сосуде и трубке В. Таким образом, измерив высоту столба жидкости в трубке, можно рассчитать осмотическое давление раствора. Теорией растворов занимался голландский химик Вант-Гофф. В частности, он предположил, что в случае слабых растворов молекулы растворенного вещества настолько удалены друг от друга, что силовое взаимодействие между ними практически отсутствует; поэтому их можно уподобить молекулам идеального газа, движущимся не в вакууме, а в растворителе. Поэтому, по Вант-Гоффу, для вычисления осмотического давления можно воспользоваться уравнением Менделеева-Клапейрона:
где V - объем, занимаемый раствором; m - масса растворенного вещества; М - его молекулярный вес; Т - абсолютная температура; R – универсальная газовая постоянная (8,314 Дж/моль·К). Применение законов идеальных растворов Из приведенных в предыдущем разделе соотношений, в зависимости от того, какие характеристики раствора известны, а какие нет, можно получить следующую информацию:
М= Kк·g·1000/G∙ΔTзамерз. или М= Kэ·g·1000/G∙ΔTкип.
К=Т/С
i=ΔT/К·С
α =(i - 1) /n –1
С= ΔTзамерз./К 6) определить осмотическое давление растворов неэлектролитов: |
