фармхимия часть1. Препараты галогенпроизводных углеводородов
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
Препараты галогенпроизводных углеводородовПроизводные предельных и непредельных УВ, в молекуле которых один или несколько атомов замещены на галоген. Наличие галогена определяет химические свойства вещества. Вещества различны по агрегатному состоянию. Введение галогена сообщает препарату наркотические свойства ( от F к I уменьшающиеся), противомикробную, противопаразитическую активность. Br – седативное действие, алифатические йодпроизводные – противомикробное действие, ароматические – рентгеноконтрастные. Связь углерод-галоген – ковалентная, при этом полярность и легкость разрыва ум. от F к I; это связано с ЭО (ум. от F к I), размерами атома (C-F-короткая, С-J – длинная рвется легче). Методы минерализацииДля серосодержащих препаратов1. Восстановительный (метод Файгля) - спекание с твердым HCOONa (формиат натрия). S S2- Na2S + H+ H2S (запах). Na2S + Pb2+ PbS + 2Na+ (черный осадок) 2. Окислительный: Нагревание со смесью концентрированных азотной и соляной кислот. Иногда с одной из них. Это метод «мокрой» минерализации. “S” + конц. HNO3, HCl SO42- Ba2+ + SO42- BaSO4 Для азотсодержащих препаратов1. Спекание с K2CO3, Na2CO3 или их смесью (безводные): “N” CN- 2. Спекание с безводным Na2S2O3 и K2CO3: “N” Для галогенсодержащих препаратовПредварительная проба Бельштейна: При нагревании галогенсодержащих препаратов в сухом виде на медной проволоке пламя окрашивается: для хлора – в желтый, для брома и йода – в синевато-зеленый цвет, т.к. при увеличении температуры образуются летучие галогениды меди. Не обнаруживается F-, т.к. его галогенид нелетуч. Пробой Бельштейна можно обнаружить как ковалентные галогены, так и галогены ионного типа. Неорганические галогениды не дают пробы Бельштейна. Выбор способа отщепления ковалентно связанного галогена зависит от природы галогена и структуры органической молекулы. Для мышьяксодержащих препаратовСпекание с K2CO3 и KNO3 (или Na2CO3 и NaNO3) в различных соотношениях. “As” Далее с магнезиальной смесью дает белый осадок: AsO43- + Mg2+ + NH4+ MgNH4AsO4 Для фосфорсодержащих препаратовМокрая минерализация: “P” Способы отщепления ковалентно-связанного галогена с целью перевода его в ионное состояние
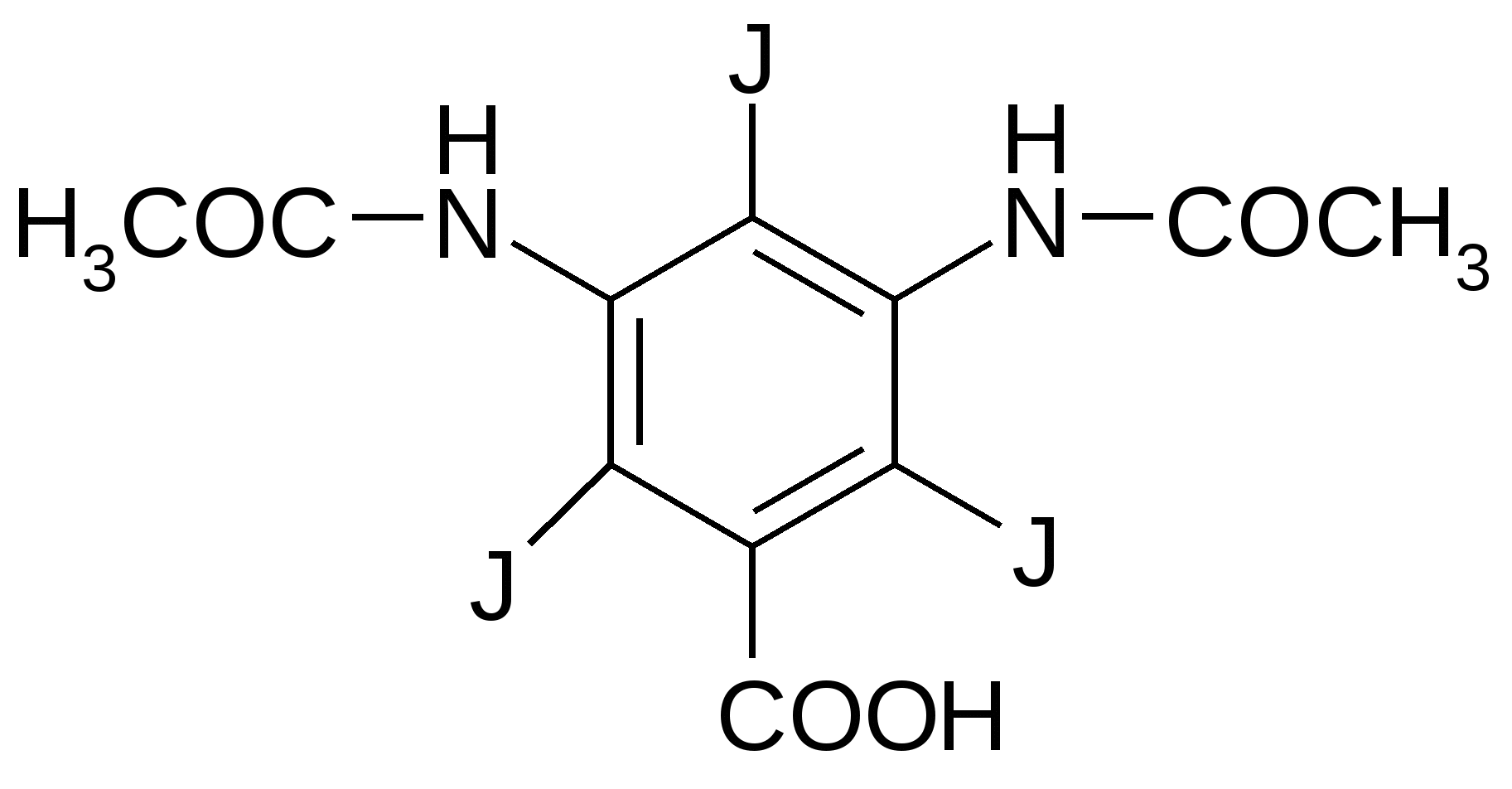
Достоинства: можно определить все галогениды, серу и фосфор, это метод количественного элементного анализа (фотоколориметрия). Суть метода: окислительное расщепление. Элемент переводится в неорганический ион. Используется для анализа плоскодонная коническая термостойкая колба со шлифом и пробкой. В колбу наливают поглощающую жидкость, точную навеску анализируемого вещества помещают в бумажный пакетик, который затем на нихромовом держателе вносят в колбу. Заполняют колбу чистым кислородом. Поджигают кончик бумажки. Колбу накрывают полотенцем и придерживают рукой. После окончания горения оставляют на 1 час, постоянно перемешивают, чтобы продукты реакции перешли в раствор. А из раствора определяют эти продукты титрованием, параллельно проводят контрольный опыт с пустым пакетиком. Определение хлора и брома1. Поглощающая жидкость – 6% раствор перекиси водорода: RCl 2. Нейтрализуют щелочью с бромфеноловым синим до синего окрашивания. pT = 3 – 6: HCl + NaOH 3. Прибавляют 0,3% HNO3 до желтого окрашивания. pH = 3: NaCl + HNO3 HCl + NaNO3 4. Проводят прямую меркуриметрию с дифенилкарбазоном. Титрант: 0,1M Hg(NO3)2; pH=2-3 (HNO3). Индикатор: дифенилкарбазон: Ph-N=N-CO-NH-NH-Ph Навеску растворяют в воде и титруют до образования сине-фиолетового окрашивания. Hg(NO3)2 + 2HCl HgCl2 + 2HNO3 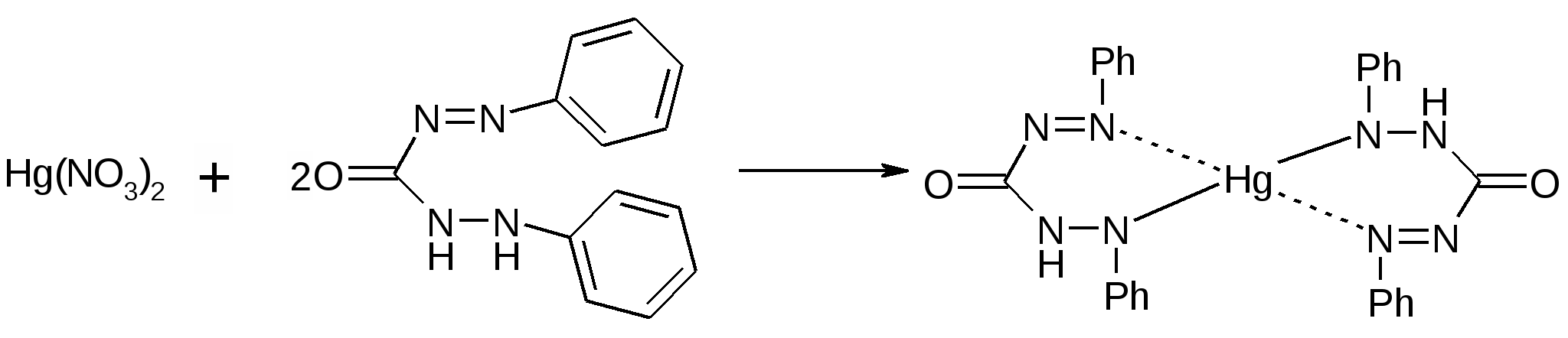 f(NaCl)=1; Определение йода1. Поглощающая жидкость – 0,2М раствор NaOH: RI Чтобы доокислить ион йода добавляют ацетатный буфер и бромную воду (по каплям) в избытке (до желтого окрашивания): 2NaI + Br2 I2 + 2NaBr NaI + Br2 NaIO3 2. Избыток брома удаляют с помощью HCOOH: HCOOH + Br2 HBr + CO2 + H2O 3. Проводят косвенную йодометрию. К раствору прибавляют кристаллический KI, 0,05M H2SO4, ставят в темное место на 5 минут. Титруют тиосульфатом с индикатором крахмалом. 2HIO3 + 10KI + 5H2SO4 6I2 + 5K2SO4 + 6H2O I2+2Na2S2O3 2NaI + Na2S4O6 f(J)=1/6; Определение фтора1. Титриметрический метод: Поглощающая жидкость - H2O: R-F К раствору прибавляют индикатор ализариновый красный (1,2 – дигидрокси – антрохинон трисульфокислоты натриевая соль) и щелочь по каплям до красно-малиновой окраски. рТ=4,6 – 6,0. HF + NaOH NaF + H2O Прибавляют HNO3 до ярко-желтой окраски (pH <4): NaF + HNO3 HF + NaNO3 Прибавляют хлорацетатный буфер (рН=3-3,5) и титруют плавиковую кислоту (HF) 0,005М раствором Th(NO3)4 (образуется бесцветный комплекс). 4HF + Th(NO3)4 + (2HF) H2[ThF6] или [ThF4] + HNO3 Избыточная капля титранта окрашивает индикатор в розовый цвет. 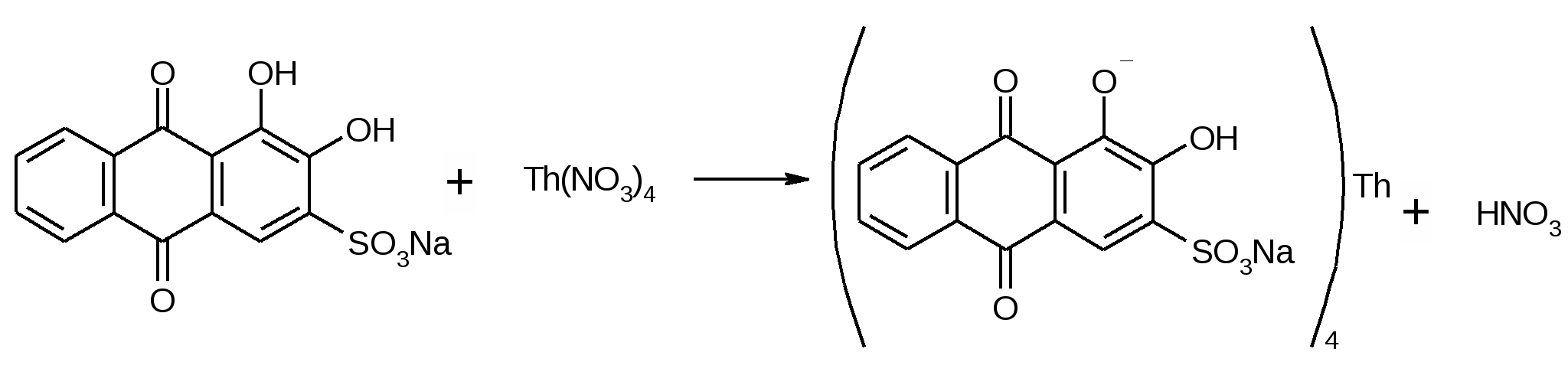 f(F)=1/4; 2. Физико-химический: R-F Раствор переносят в м.к. на 100 мл, прибавляют индикатор неотропин, точный титрованный объем 0,005М Th(NO3)4, доводят водой до метки и оставляют на 30 мин. Затем проводят фотоколориметрию при 580 нм. Содержание F определяют по калибровочному графику. 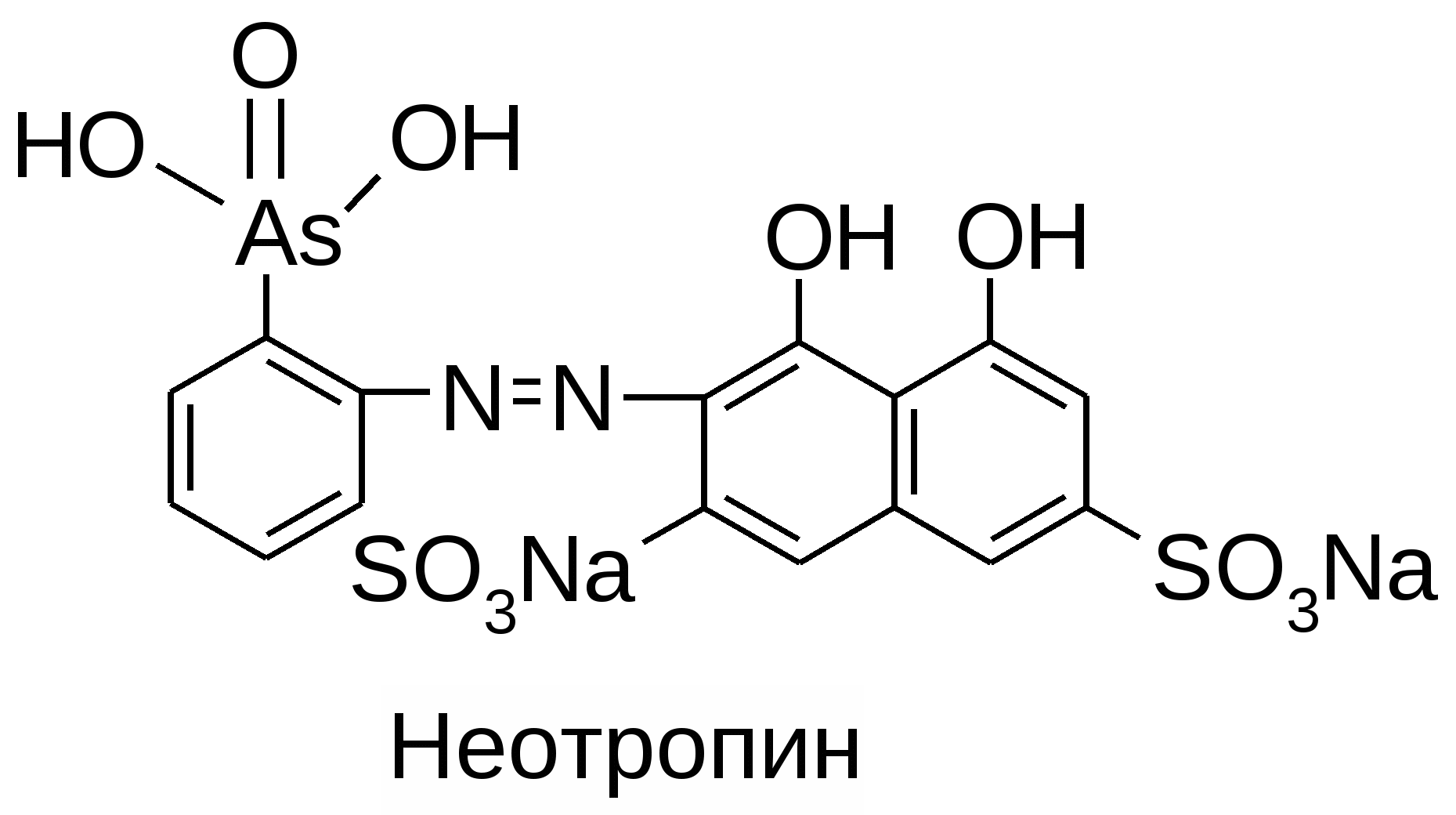 2-[(1,8-дигидрокси-3,6-дисульфо)-нафтил-2-азо]-фениларсоновая кислота Определение серыПоглощающая жидкость – 6% H202. Титриметрический анализ. В растворе образуется H2SO4. Затем смесь нагревают до разложения избытка перекиси, прибавляют CH3COOHр, спирт и индикатор торин (2-[(2-гидрокси-3,6-дисульфо)-нафтил-1-азо]-фениларсоновая к-ту). Титруют 0,01М Ba(NO3)2 с метиленовой синью от желто-зеленой до розовой окраски: H2SO4 + Ba(NO3)2 BaSO4 + HNO3. Лишняя капля Ba(NO3)2 дает розовое окрашивание индикатора из-за образования комплекса. 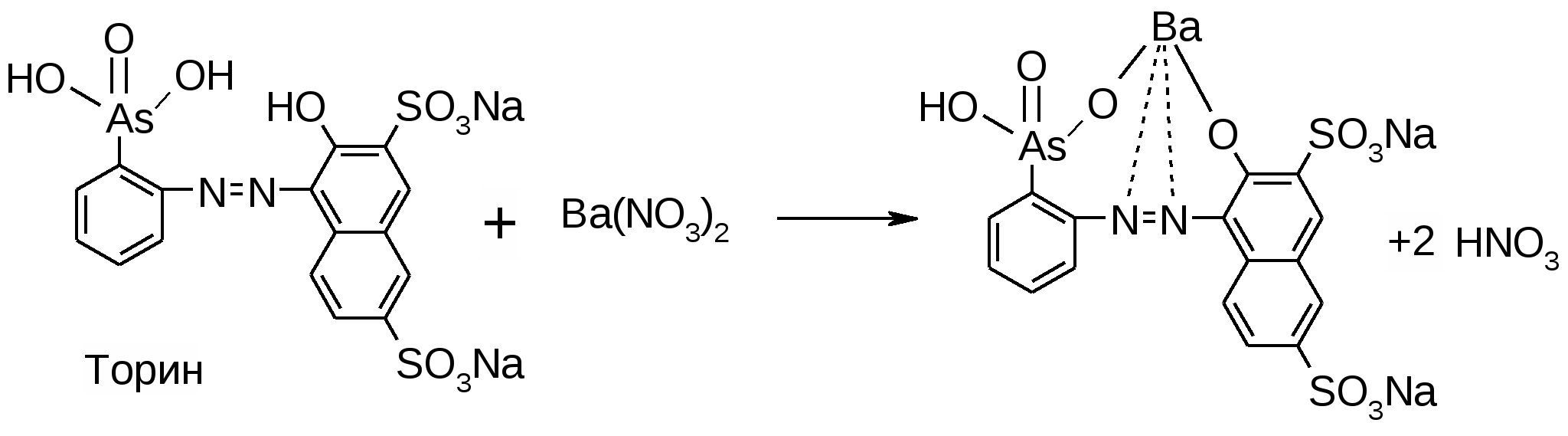 Определение фосфора. Поглощающая жидкость – H2SO4. PPO43- Добавляем воду, нагреваем до удаления H2SO4 и добавляем нас. раствор Na2CO3 по ФФ до розового окрашивания (среда щелочная) и реактив Фриде (молибдат аммония – (NH4)6Mo7O24x4H2O). Фосфаты образуют с реактивом Фриде фосфорно-молибденовую кислоту желтого цвета. Прибавляют восстановитель – п-метиламинофенол, который восстанавливает фосфорно-молибденовую кислоту до молибденовой сини (Mo5O14). Затем проводят фотоколориметрию раствора при 750 нм. Сод. определение по калибровочному графику.
RI + KMnO4 + H2SO4к 2KMnO4 + 3NaNO2 + 3H2SO4 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O 2NaNO2 + H2N-CO-NH2 + H2SO4 2N2 + CO2 + H2O + Na2SO4 KIO3 + 5KI изб. + 3H2SO4 3I2 + 3K2SO4 + 3H2O I2 + 2Na2S2O3 f (RIn) = 1/6n, n – число атомов I в молекуле.
2С2H5OH + 2Na H2 + 2C2H5ONa Zn + NaOH H2 + Na2ZnO2 Zn + CH3COOH H2 + Zn(CH3COO)2 Препараты:Aethylii chloridum. CH3-CH2-Cl – хлорэтилОписание: Прозрачная, бесцветная, летучая жидкость со своеобразным запахом, горит зеленым пламенем. Растворимость: Трудно растворим в воде, со спиртом и эфиром смешивается во всех соотношениях. Подлинность: CH3-CH2-Cl + сп.KOH CH3-CH2-Cl + AgNO3 Чистота: Ткип = 12-13С, плотность < 1. Определяют кислотность, спец. недопустимая примесь – этиловый спирт. По реакции образования йодоформа не д.б. осадка и окрашивания: C2H5OH + 6NaOH + 4I2 CHI3 + 5NaI + HCOONa + 5H2O Количественноеопределение: отсутствует. Хранение: По списку Б в ампулах или склянках с затвором в прохладном и защищенном от света месте. Применение: местный антисептик, для охлаждения. Iodoformium. СHI3 – йодоформОписание: Мелкие блестящие пластинчатые кристаллы или мелкокристаллический порошок лимонного цвета. Летуч при комнатной температуре, перегоняется с водяным паром. Препарат быстро разлагается на свету с выделением йода. Растворимость: Практически нерастворим в воде, трудно в спирте, растворим в эфире и хлороформе. Мало растворим в глицерине и эф. маслах. Подлинность: 1) Пиролиз в сухой пробирке (фиолетовые пары йода). 4CHI3 + O2 2) Мокрая минерализация CHI3 + H2SO4 3) CHI3 + 3AgNO3 + H2O 3AgI + 3HNO3 + CO Чистота: Контролируется Тпл, примесь красящих веществ, кислотность и щелочность. Общие: Сl-, SO42-. Количественноеопределение: Метод Фольгарда. Растворяется в спирте (ср. спиртоводная). H2O + CHI3 + 3AgNO3(избыток) Охлаждают, избыток AgNO3 оттитровывают NH4SCN с индикатором FeNH4(SO4)2 + контрольный опыт. AgNO3 + NH4SCN КТТ: (бурое окрашивание) 3NH4SCN + FeNH4(SO4)2 f = 1/3, Хранение: По списку Б в склянках с затвором в прохладном и защищенном от света месте. Применение: Антисептик, присыпка, мазь, стоматологическая паста. Phthorothanum seu Halotanum. F3C-CHClBr – Фторотан (1,1,1-трифтор-2-хлор-2-бром-этан)Описание: прозрачная, бесцветная, подвижная, летучая ж. с характерным запахом. Не воспламеняется. Растворимость: Мало растворим в воде, смешивается с безводным спиртом, также с маслами, хлороформом, трихлорэтиленом. Чистота: Контролируется плотность, Ткип, кислотность, щелочность, хлориды, бромиды, содержание тимола не должно превышать норму. Не должно быть свободного хлора и брома - с KI при добавлении крахмала не должно быть синего окрашивания. Подлинность: 1) Минерализация (сплавление с металлическим Na) F3C-CHClBr + Na + H2O Затем добавляют ледянцю уксусную кислоту и комплекс циркония с алазариновым красным. 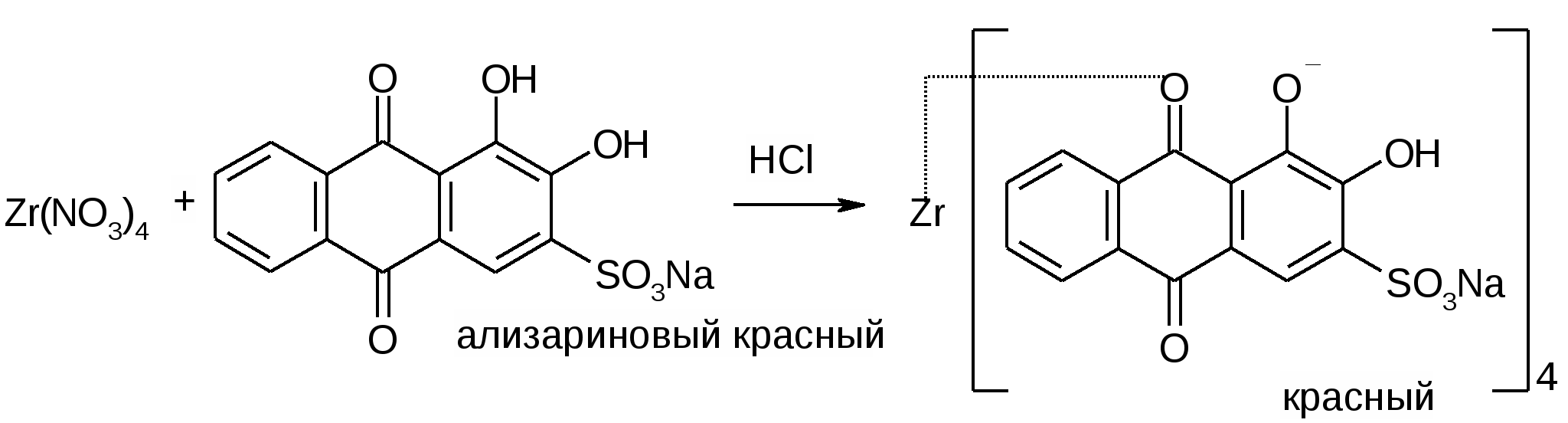 NaF 2) ИК- спектр. 3) Для подтверждения плотности (>1,8) добавляют H2SO4к и фторотан опускается на дно. Количественноеопределение: ИК Применение: средство для ингаляционного наркоза. В качестве консерванта и стабилизатора – 0,01% тимола. Хранение: По списку Б. В склянках оранжевого стекла, хорошо укупоренных, качество проверяют каждые 6 месяцев. В прохладных, темных местах. Chloroformium. CHCl3 – хлороформОписание: Это бесцветная прозрачная, тяж., подвижная, летучая жидкость с хар. запахом. Растворимость: В воде мало растворим, со спиртом и эфиром смешивается в любых соотношениях. Подлинность: 1) Бензоидонитрильная проба: Ph-NH2 + CHCl3 2) CHCl3 + 3KOH 3KCl + HCOOK + H2O Хранение: по списку Б, в заполненных доверху и закупоренных бутылках из оранжевого стекла в прохладном месте. Применение: средство для наркоза, токсичен, растворитель. Bromcamphora. 3-Бром-1,7,7-триметил-бицикло [2,2,1] гептанон-2.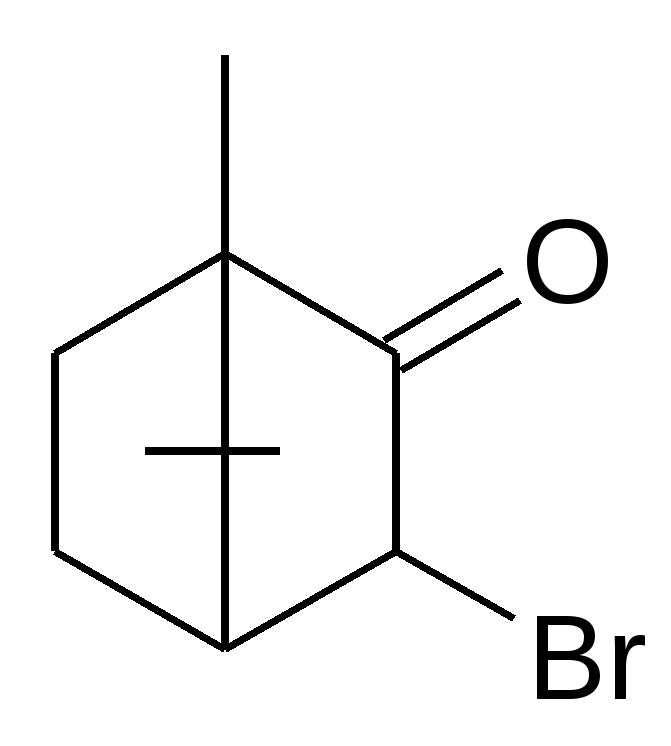 Описание: Бесцветные кристаллы, белый кристаллический порошок характерного вкуса. Растворимость: Мало растворим в воде, легко в спирте, эфире, хлороформе. Подлинность: БК + 3NaOH + Zn Количественноеопределение: Определяют по NaBr по методу Фольгарда после минерализации. БК + 3NaOH + Zn NaBr + AgNO3 точн. избыток AgNO3 + NH4SCN КТТ (бурое окрашивание): 3NH4SCN + FeNH4(SO4)2 f(NaBr)=1; Хранение: В хорошо ук. банках оранжевого стекла в защищенном от света месте, в прохладе. Применение: Средство, успокаивающее ЦНС Bilignostum seu Adipiodon. Бис-(2,4,6-трийод -3-карбокси)анилид адипиновой к-ты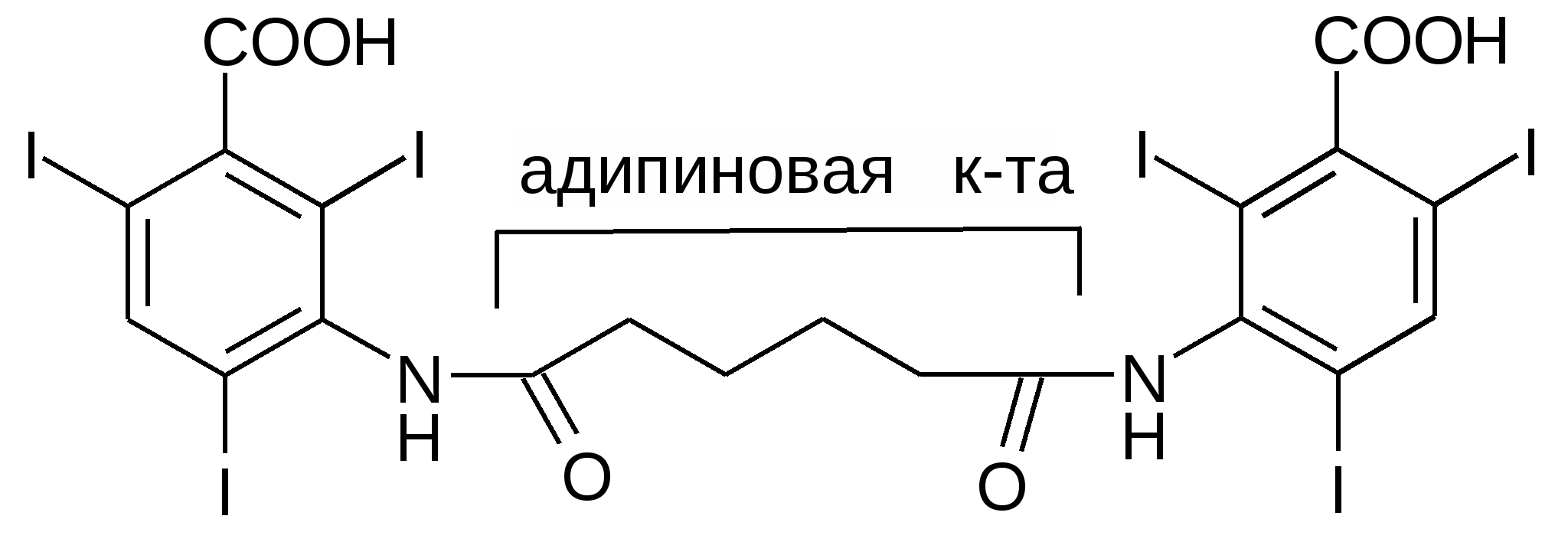 Описание: Белый мелкокристаллический порошок без запаха солоновато-горького вкуса. Растворимость: Практически нерастворим в воде, спирте, эфире и хлороформе. Легко растворим в диметилформамиде, в растворах едких щелочей и аммиака. Подлинность: 1) УФ спектр в 0,1М NaOH в области 230-300 нм должен иметь 1 мах – 236+-2нм 2) При нагревании с H2SO4 выделяются пары I2 фиолетового цвета. Количественное определение: ГФХ – косвенная йодометрия после минерализации. RI + KMnO4 + H2SO4к 2KMnO4 + 3NaNO2 + 3H2SO4 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O 2NaNO2 + H2N-CO-NH2 + H2SO4 2N2 + CO2 + H2O + Na2SO4 KIO3 + 5KI изб. + 3H2SO4 3I2 + 3K2SO4 + 3H2O I2 + 2Na2S2O3 f=1/36; По новой статье: 1) Аргентометрия по Фаянсу после расщепления цинком в щелочной среде. f(Б)=1/6; f(I)=1; 2) Обратная алкалиметрия. Препарат + избыток титров. раствора NaOH + Ind (метил. красный, метил. синий). Избыток NaOH оттитровывается HCl до перехода окраски из зеленой в серо-зеленую. Параллельно проводят контрольный опыт. fБ=1/2; Хранение: Список Б ,в хорошо закупоренных банках оранжевого цвета, в защищенных от света местах. Применение: В виде водных растворов в качестве рентгеноконтрастных средств. Bromisovalum. (CH3)2CH-CHBr-CO-NH-CO-NH2Описание: Белый кристаллический порошок горьковатого вкуса со слабым запахом. Растворимость: Мало растворим в воде, хорошо в 95% спирте. Подлинность: (CH3)2CH-CHBr-CO-NH-CO-NH2 + 4NaOH (CH3)2CH-CHBr-CO-NH-CO-NH2 + кH2SO4 (CH3)2CH-CHOH-COOH запах + (NH2)2C=O•H2SO4 Ph-SO2-N(Na)Cl + NaBr Количественноеопределение: по Фольгарду. Хранение: По списку Б Применение: успокаивающее и снотворное действие. T |