фармхимия часть1. Препараты галогенпроизводных углеводородов
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
Препараты сложных эфиров азотной кислотыПрепараты:Nitroglycerinum. НитриглицеринОписание: бесцветное, бледно-желтое масло, тяжелая вязкая жидкость. Растворим в спирте, органических растворителях, мало растворим в воде. Получение: пропусканием глицерина через нитрующую (HNO3к + H2SO4к) смесь при 12оС. Лекарственныеформы: 1. Concentratum Nitroglycerini 1% pro infusionibus 2. Tabulettae Nitroglycerini 0,0005 3. Solutio Nitroglycerini 1% oleosa in capsullis 0,0005 et 0,001 4. Инъекционные формы: Perlinganit, Nitro-pol, Nitro-mak. 5. Мази, пленки 6. Аэрозоли – Nitrolingual spray 8. Полимерные таблетки из микрокапсул – Sustac, Nitrolong Подлинность: 1. Гидролиз с последующей идентификацией глицерина С3H5(NO2)3 + 3KOH C3H5(OH)3 + 3KNO3 C3H5(OH)3 + H2SO4 CH2=CH-CHO (запах акролеина) + 2H2O 2. Синее окрашивание с дифениламином RONO2 + 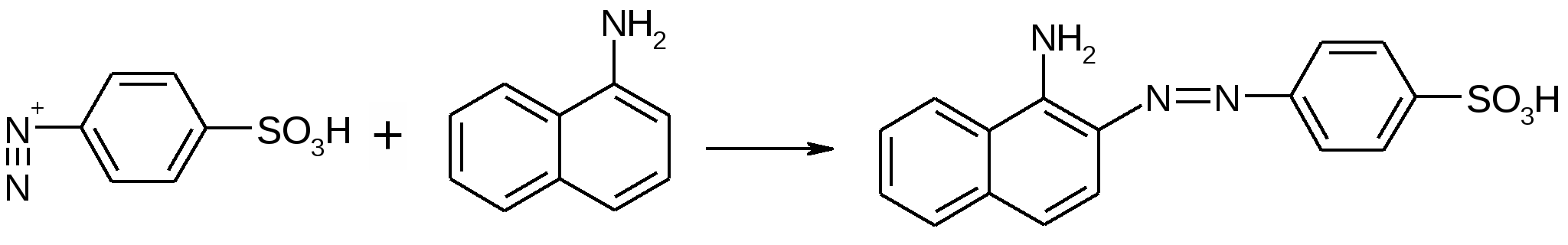 Примеси: частные специфические – этиленгликоля динитрат (ТСХ) Количественноеопределение: 1.Обратная алкалиметрия: НГ + 5KOH Избыток КОН оттитровывают HCl с индикатором крезоловым красным или бромкрезоловым пурпурным. f=1/5; 2. Фотоколориметрия: Нитроглицерин   желтая окраска желтая окраскаИзмеряют D при 408-410 нм, результаты сравнивают с KNO3 по графику. 3. Спектрофотометрия 4. Со сплавом Деварда (Cu-50%, Al-45%,Zn-5%): Нитроглицерин + NaOH Глицерин + 3NaNO3 NaNO3 + 4Zn + NaOH NH3 + Na2ZnO2 + H2O 2NH3 + H2SO4 изб (NH4)2SO4 избыток H2SO4 оттитровываем щелочью с метиленовым красным. f=1/3. Контроль. Препараты карбоновых кислот и их солейRCOOH(Me, R’) – увеличение растворимости, уменьшение токсичности, Н обеспечивает раздражающее действие и антимикробную активность. Получение: 1. Окислением спиртов 2. Из галогенпроизводных УВ. Физическиесвойства: от подвижной жидкости через вязкие до твердых веществ Растворимость: падает с увеличением Mr, в спирте хор. растворимы, для солей – наоборот. Химическиесвойства: 1. Кислотность: Ка = 10-4-10-5. Способны образовывать соли с Ме, оксидами Ме, растворами едких щелочей, гидроксидами Ме, карбонатами Ме. Соли подвергаются гидролизу – рН>7. 2. Образуют комплексные соединения с солями тяжелых Ме – Fe(III), Cu(II). 3. Вступают в реакции этерификации Препараты:Kalii acetas. Калия ацетат. CH3COOKОписание: Белый, кристаллический порошок со слабым запахом уксусной кислоты, гигроскопичен, на воздухе расплываются. Растворимость: ОЛР в воде, ЛР в спирте. Подлинность: CH3COO- + C2H5OH 7CH3COO- + 3FeCl3 Чистота: допускаются общие примеси, OH-, недопустима примесь восст-щих веществ. Количественноеопределение: 1. Неводное титрование в ледяной уксусной кислоте. Титрант – раствор HClO4 в ледяной уксусной, индикатор – кристаллический фиолетовый. HClO4 + CH3COOH ClO4- + CH3COOH2+ CH3COOK CH3COO- + K+ CH3COO- + CH3COOH2+ 2CH3COOH K+ + ClO4- KClO4 f=1; 2. Нефармакопейный метод: прямая ацидиметрия с индикатором треополином 00: CH3COOK + 0,1M HCl CH3COOH + KCl До перехода окраски из желтой в красноватую, рТ инд. = 1,3 – 3,2 f=1; 3. Ионообменная хроматография. Хранение: хорошо укупоренная тара, предохраняет от попадания воды. Применение: как диуретическое средство; при гипокалемии. Calcii lactas. Кальция пропионат-2-ол пентагидрат. (CH3-CHOH-COO)2Ca•5H2OОписание: белый аморфный порошок почти без запаха, на воздухе выветривается Растворимость: медленно растворим в воде, легко растворим в горячей воде, практически нерастворим в 95% спирте. Получение: окисление глюкозы в присутствии солей кальция. Подлинность: ИК-спектроскопия – характерные пики на группы COO- и OH. Реакция А на ион кальция. На лактат-ион: к раствору препарата прибавляют H2SO4 и KMnO4 до малиново-фиолетовой окраски, окраска исчезает, запах уксусного ангидрида: (CH3-CHOH-COO)2Ca + 4KMnO4 + 11H2SO4 Нефармакопейные: Ацетальдегид в прис. нитропруссида Na дает синюю окраску. С реактивом Несслера – темно-бурый осадок. Йодоформная проба Чистота: прозрачность и цветность в сравнении с эталонами, щелочность и кислотность (ФФ + NaOH). Наличие летучих и жирных кислот (при нагревании с H2SO4 не д. б. запаха жирных кислот). общие – Cl-, SO42-; частные – Ba, Mg, щелочные Me; микробиологическая чистота; потеря в массе при выслушивании 20-30% Количественноеопределение: прямая комплексонометрия с аммиачным буфером, индикатор– кислотный хром темно-синий, f=M, расчет производится на безводный препарат. Хранение: хорошо укупоренная тара Применение: источник кальция, антиаллергическое средство. Calcii gluconas. Кальция глюконат Описание: белый зернистый или кристаллический порошок без запаха и вкуса Растворимость: умеренно медленно растворим в холодной воде, легко растворим в горячей с образованием мутного раствора, практически нерастворим в спирте и эфире. Получение: окисление глюкозы в присутствии CaBr2, CaCl2 Подлинность: ИКС, характерные реакции на кальций; при добавлении к раствору препарата хлорида окисного железа появляется светло-зеленое окрашивание. Чистота: Прозрачность в сравнении с эталоном, рН 6-7, галогены – Cl-, Br-, SO42-, тяж. Ме – допустимы, потеря в массе при высушивании – 1%. Специфические – декстрин, сахароза. Препарат растворяют при нагревании в смеси из 2 мл разведенной соляной кислоты и 10 мл воды и кипятят 2 минуты. К охлажденному раствору приливают постепенно 8 мл раствора карбоната натрия и через 5 минут фильтруют (CaCO3). 5 мл фильтрата кипятят в течение 1 минуты с 2 мл реактива Фелинга; не должно наблюдаться образование красного осадка Количественноеопределение: прямая комплексонометрия. Расчет на кристаллогидрат. Хранение: сухое место Применение: источник кальция, антиаллергическое средство. Natrii citras pro injectionibus. Натрия цитрат для инъекцийОписание: белые кристаллы или кристаллический порошок без запаха, выветривающиеся на воздухе Растворимость: легко – в воде, практически нерастворим в спирте Получение: взаимодействие лимонной кислоты с карбонатом Nа. Полученную соль перекристаллизовывают из спирта. Подлинность: ИКС, реакция А на цитраты (с хлоридом кальция): 2 Осадок растворим в HCl. Реакции на Na. Нефармакопейные: 1. Реакция Б на цитраты: при нагревании цитрата с уксусным ангидридом через 20-40 секунд развивается карминово-красное окрашивание 2. Реакция Штаре: Выпадает белый кристаллический осадок. 3. С реактивом Денеже: свежеприготовленный раствор основного сульфата ртути. Чистота: раствор должен быть прозрачным и бесцветным; рН 7,8-8,3; недопустимы As (III), допустимы общие. Специфические: тартраты – насыщенный раствор + ацетатный буфер – раствор должен быть прозрачен. Оксалаты: навеску растворяют в воде, прибавляют HCl, спирт и CaCl2, оставляют на час, раствор должен остаться прозрачным. Потеря в массе при выслушивании – 25-28%, микробиологическая чистота Количественноеопределение: неводное титрование 1. HClO4 + CH3COOH ClO4- + CH3COOH2+ 2. натрия цитрат + 3CH3COOH 3Na+ + 3CH3COO- + лимонная кислота 3. CH3COO- + CH3COOH2+ 2CH3COOH 4. Na+ + ClO4- NaClO4 f=1/3 ГФX: ионобменная хроматография Цитарт натрия + [катионит]Н+ [катионит]3Na+ + лимонная кислота. Титруют NaOH с фенолфталеином. f=1/3. Нефармакопейные:
натрия цитрат + 3HCl f=1/3 2. Обратная аргентометрия: натрия цитрат + 3AgNO3 Избыток нитрата серебра оттитровывают роданометрически (NH4SCN) .f=1/3 3. Образование комплекса с медью – прямая куприметрия (CuSO4) с мурексидом. Хранение: сухое прохладное место Применение: консервант препаратов крови. Natrii oxybutyras. Натрия оксибутират. HO-CH2-CH2-CH2-COONaОписание: белый с желтоватым оттенком гигроскопичный порошок. ЛР в воде, Р в спирте, ПНР в эфире, хлороформе. Получение: из -бутиролактона (специфическая примесь) Подлинность: ИКС, Б – на Na; лактона – гидроксамовая проба Количественноеопределение: неводное титрование f=1; прямая ацидиметрия f=1. Хранение: список Б, в сухом, защищенном от света месте. Применение: снотворное, неингаляционный наркоз, порошки, ампулы, сиропы, концентрат (66,7%). Lithii oxybutyras. HO-CH2-CH2-CH2-COOLiПодлинность: окрашивает пламя в фиолетовый цвет, рефрактометрия. Количественное определение: неводное титрование. Хранение: список Б Применение: в психиатрии. |
