ответы на экзаменационные билеты. Применение изоферментов
 Скачать 6.79 Mb. Скачать 6.79 Mb.
|
|
Адреналин: активирует фосфорилазу мышц и печени, тормозит синтез гликогена (подавляет гликогенсинтетазу), стимулирует глюконеогенез из лактата, активирует распад липидов в жировой ткани  Глюкагон: активирует фосфорилазу печени, активирует глюконеогенез из аминокислот, ускоряет протеолиз, стимулирует распад жира в жировых депо, тормозит синтез жира и холестерина. Соматотропный гормон: оказывает глюкозосберегающее действие за счёт активации липолиза, осуществляет переключение на использование ВЖК, тормозит транспорт глюкозы в клетку, стимулирует секрецию инсулина и глюкагона. Глюкокортикоиды: активируют глюконеогенез из аминокислот, стимулируют гликогенолиз, тормозят потребление глюкозы тканями, вызывают распад белков в мышцах, соединительной ткани лимфоцитах, активируют распад липидов. Тироксин: усиливает всасывание глюкозы из кишечника, тормозит синтез жира из глюкозы, в больших дозах стимулирует распад белка, липидов, активирует глюконеогенез Инсулин: простой белок, молекулярная масса 60 000, содержит 51 АМК, состоит из двух полипептидных цепей: α и ß. α-цепь содержит 21 АМК, а ß -цепь – 30 АМК. Синтез инсулина: Синтезируется инсулин ß–клетками островков Лангерганса в виде проинсулина (84 АМК), который путём ограниченного протеолиза превращается в инсулин. При этом от проинсулина отщепляется С-пептид из 33АМК. Секреция инсулина: секреторная реакция ß-клеток на глюкозу является Са-зависимой, СТГ, глюкагон и другие гормоны влияют на секрецию инсулина, секреция возрастает при приёме богатой белками пищи (арг, лей). Рецепторы инсулина: обеспечивают реализацию эффектов инсулина на мишени, вызывают активацию аденилатциклазы с образование цАМФ, который при участии ионов кальция и магния регулирует утилизацию глюкозы и синтез белка. Различают свободный и связанный инсулин: Свободный инсулин - форма, которая хорошо реагирует с антителами к кристаллическому инсулину, - стимулирует поглощение глюкозы жировой и мышечной тканями. Связанный инсулин - комплекс инсулина с белками сыворотки – трансферрином и α-глобулинами, - резерв инсулина в русле крови Метаболизм инсулина: 40-60 % инсулина метаболизируется в печени при участии инсулиназы, 40% инсулина расщепляется в почках. Влияние инсулина на обменные процессы: Инсулин – анаболик, стимулирует синтез: гликогена, белков, нуклеиновых кислот, липидов и тормозит их распад. Действие инсулина: повышает проницаемость клеточных мембран для глюкозы и усиливает потребление её тканями (активация белка-транспортера глюкозы), активирует гексокиназную реакцию, индуцирует синтез глюкокиназы, активирует гликолиз, активирует синтез гликогена, тормозит его распад, активирует пентозный цикл, активирует дихотомичексий распад глюкозы, тормозит глюконеогенез, при действии инсулина снижается концентрация цАМФ, повышается концентрация цГМФ, в тканях стимулирует биосинтез нуклеотидов и нуклеиновых кислот, стимулирует биосинтез жирных кислот, нейтрального жира (из углеводов), усиливает биосинтез ДНК, РНК, АТФ, оказывает белоксберегающее действие. Значение инсулина: анаболик, противостоит группе контринсулярных гормонов, регулирует уровень глюкозы в крови – 3,3-5,5 ммоль/л. 3. В крови снижено содержание мочевины. Нарушение какого метаболического пути можно предположить, каковы возможные причины этих нарушений? Билет 18 орнитинов цикл,отсутствие ферментов Билет 19. 1. Понятие об обмене веществ. Процессы анаболизма и катаболизма, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты. Обмен веществ и энергии-совокупность процессов превращения веществ и энергии в живых организмах и обмен веществами и энергией между организмом и окружающей средой. Обмен веществ включает 3 этапа: поступление веществ в организм, метаболизм, или промежуточный обмен, выделение конечных продуктов обмена. Основные функции метаболизма: извлечение энергии из окружающей среды (в форме химической энергии органических веществ), превращение экзогенных веществ в строительные блоки, сборка белков, нуклеиновых кислот, жиров из строительных блоков, синтез и разрушение тех биомолекул, которые необходимы для выполнения различных специфических функций данной клетки. Катаболизм- ферментативный распад высокомолекулярных соединений до составляющих их мономеров и дальнейший распад мономеров до конечных продуктов: углекислого газа, аммиака, лактата. Главные реакции катаболизма – реакции окисления, поставляющие клетке энергию. Энергия может запасаться в двух формах: АТФ, НАДФН+Н - донор водорода в реакциях восстановления при синтезе ряда соединений. Анаболизм: ферментативный синтез основных макромолекул клетки, а также образование биологически активных соединений, требует затраты свободной энергии (АТФ, НАДФН+Н ). Отличия катаболизма и анаболизма: Катаболизм – распад, запасание АТФ. Анаболизм – синтез, но потребление АТФ. Пути не совпадают, разное число реакций. Отличаются по локализации. Разная генетическая и аллостерическая регуляция. Унификация питательных веществ идёт в три фазы: I . Подготовительная фаза. Высокомолекулярные соединения распадаются под действием гидролаз ЖКТ до мономеров. Протекает в ЖКТ и лизосомах. Не является поставщиком энергии (1%). II фаза. Превращение мономеров в простые соединения - центральные метаболиты (ПВК, ацетилКоА) эти продукты связывают 3 вида обмена, до 2-3 с, протекает в цитоплазме, завершается в митохондриях, даёт 20-30% энергии, поставляемой анаэробно III фаза. Цикл Кребса аэробные условия, полное окисление поступивших с пищей веществ, выделяется большое количество энергии и аккумулируется она в АТФ. Анаболические пути расходятся: 1 фаза. Синтез белков начинается с образования α-кетокислот. 2 фаза. Аминирование α-кетокислот, получение АМК. 3 фаза. Из АМК образуются белки Общий путь катаболизма: После образования ПВК дальнейший путь распада веществ до углекислого газа и воды происходит одинаково в общем пути катаболизма (ОПК). ОПК включает реакции окислительного декарбоксилирования ПВК и ЦТК. Реакции ОПК происходят в матриксе митохондрий и восстановленные коферменты передают водород на компоненты дыхательной цепи. Катаболические пути сходятся, вливаясь на третьей фазе в ЦТК. На первой фазе белки дают 20 АМК. На второй фазе 20 АМК дают ацетилКоА и аммиак. На третьей фазе ЦТК даёт углекислый газ, воду и энергию. Метаболические пути – совокупность катализируемых ферментами реакций, в ходе которых происходит превращение субстрата в продукт. Главные (основные) метаболические пути – универсальные, свойственные любой клетке. Поставляют энергию, синтез основных биополимеров клетки. Добавочные пути менее универсальны, характерны для определённых тканей и органов. Синтез важных веществ. Поставляют энергию в форме НАДФН+Н. Побочные пути протекают ограниченно. В условиях патологии. В них часто появляются токсические метаболиты. Центральные метаболиты: ацетил-КоА, ПВК, ЩУК, ФГА. Витамины РР и В2, структура, признаки витаминной недостаточности и участие в обмене веществ. B2 –Рибофлавин G 2-2,5 мг/сут Флавиновые коферменты Флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД) являются производными витамина В2 (диметилизоаллоксазинрибитола). 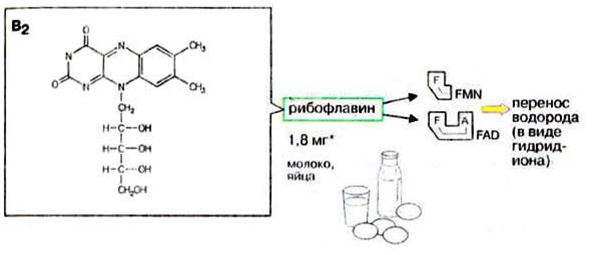 ФАД представляет собой соединение ФМН с АМФ 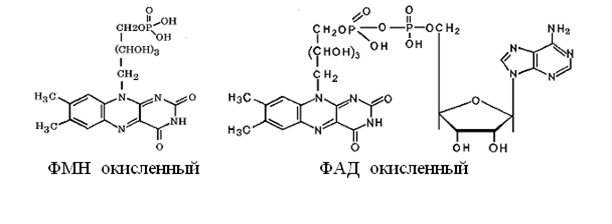 Обратимая окислительно-восстановительная реакция, катализируемая ФМН- и ФАД-зависимыми дегидрогеназами 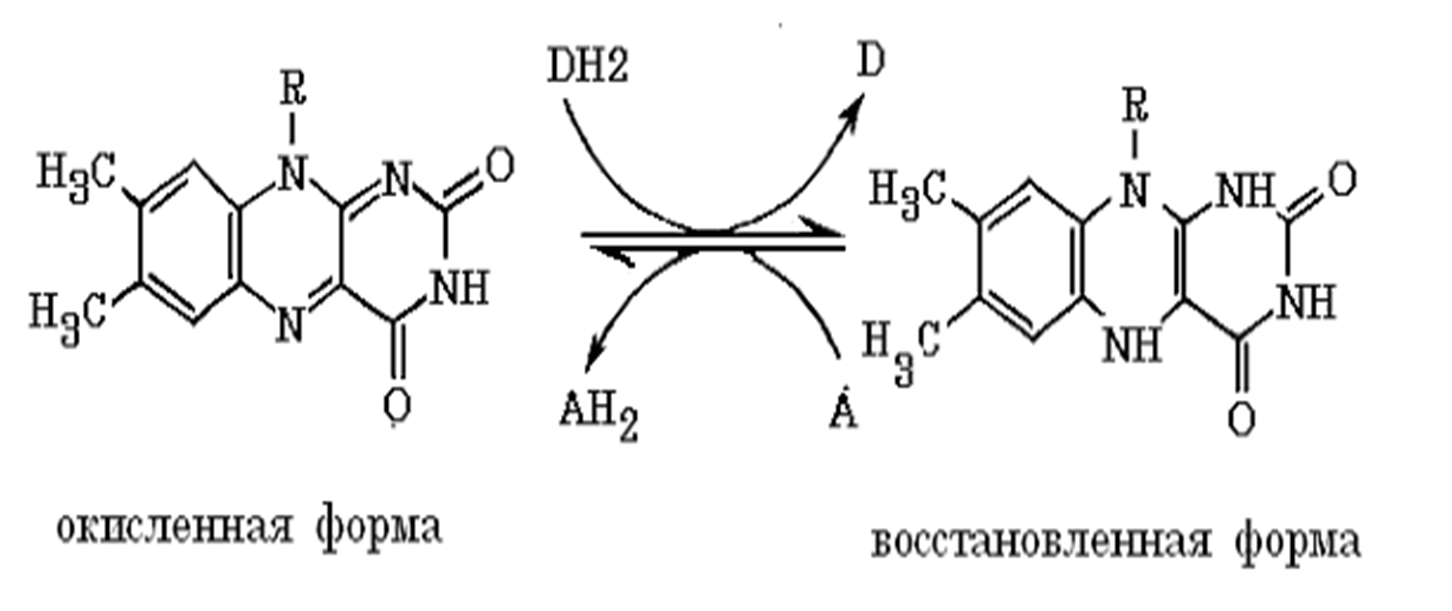 Дефицит витамина В2 расстройство пищеварения и нервной системы, хронические гастриты и колиты, общая слабость, кожные заболевания, снижает сопротивляемость болезням. Пищевые источники витамина В2 капуста, горох, яблоки, зеленая фасоль, помидоры, репа, дрожжи, яйца, печень, мясо, молоко. Биофункция: Входит в состав дыхательных флавиновых ферментов (ФМФ и ФАД). Осуществляет перенос H+ и e–. Авитоминоз/гипервитаминоз: Поражение глаз, светобоязнь, поражение слизистой полости рта, глоссит, задержка роста. PP Никотиновая кислота 15-25 мг/сут Кофермент оксидоредуктаз Биох.роль: Участвует в процессах клеточного дыхания (перенос H+ и e–). Регулирует секреторные и моторные функции желудочно-кишечного тракта и печени. Входит в состав НАД и НАДФ. Пищ.источн: Мясо, печень, почки, рыба, дрожжи. Авитоминоз/гипервитаминоз:Воспаление кожи (пеллагра), расстройства желудочно-кишечного тракта. НАД и НАДФ: Никотинамидадениндинуклеотид (НАД) и никотин-амидадениндинуклеотидфосфат (НАДФ) - производные витамина РР -никотинамида (антипеллагрического витамина). 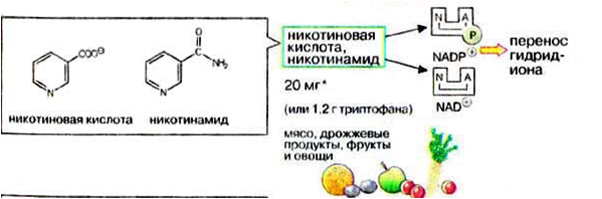 Пеллагра - авитаминоз РР: дерматит, деменция, диарея. Симптомы пеллагры наиболее резко выражены у больных с недостаточным белковым питанием. Это объясняется недостатком триптофана, который является предшественником никотинамида. Пищевые источники витамина РР: дрожжи, продукты животного происхождения, гречиха, грибы. Обратимая окислительно-восстановительная реакция, катализируемая НАД- и НАДФ-зависимыми дегидрогеназами 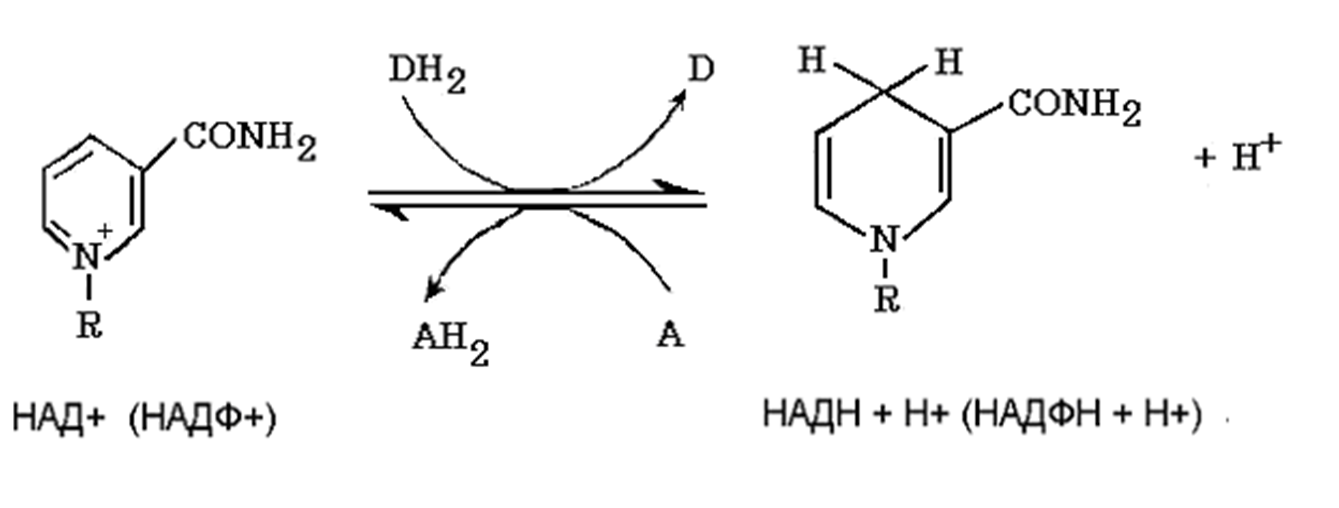 К НАД присоединяются 2 электрона и один протон, второй протон остаётся в растворе для подкисления. 3. В моче больного найдено значительное количество гомогентизиновой кислоты. Как образуется гомогентизиновая кислота в организме. Содержится ли она в моче здоровых людей? Назовите заболевание, обнаруженное у выше указанного больного и причину его возникновения? Билет 19 фен и тир; Послед. Алкаптонурия Билет20. 1. Обмен и биологическое значение глутаминовой и аспарагиновой аминокислот в организме человека. Биосинтез заменимых АМК: Ала, глу, асп – первичные АМК. Пути синтеза: восстановительное аминирование, трансаминирование Глутамин синтезируется из глу под действием глутаминсинтетазы. Аспарагин синтезируется из асп и глутамина. Судьба Асп: -Аспарагин -Синтез пуриновых и пиримидиновых омнований -В-аланин: КоАSH Азотистые вещ-ва мыщц:анзерин,карнозин Судьба Глу: -Фолиевая кислота -Глутамин -Пролин -Глутатион -Синтез Пуриновых нуклеотидов Образование амидов АМК:  Образование амидов АМК: у детей раннего возраста это основной путь обезвреживания аммиака Глутамин и аспарагин образуются в местах образования аммиака: печень, мозг, мышцы. Глутамин: нетоксичен, свободно проходит через клеточную мембрану, форма, в которой транспортируется аммиак, временное хранилище аммиака, используется для синтеза белка, аминосахаров, пуриновых и пиримидиновых нуклеотидов, фолиевой кислоты, глу, три, гис, асн, донор аммиака. Образование аммонийных солей: глутамин используется почками в качестве источника аммиака, необходимого для нейтрализации кислых продуктов. 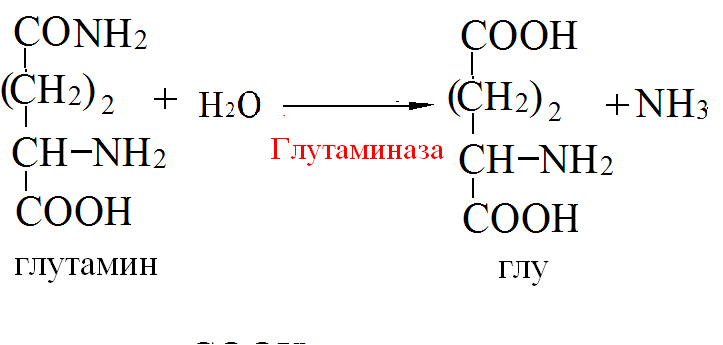 Аспарагиновая кислота (аминоянтарная кислота, аспартат, аминобутандиовая кислота) — алифатическая аминокислота, одна из 20 протеиногенных аминокислот организма. Встречается во всех организмах в свободном виде и в составе белков. Кроме того, выполняет роль нейромедиатора в ЦНС. Аспарагиновая кислота: - присутствует в организме в составе белков и в свободном виде - играет важную роль в обмене азотистых веществ - участвует в образовании пиримидиновых оснований и мочевины Аспарагиновая кислота и аспарагин являются критически важными для роста и размножения лейкозных клеток при некоторых видах лимфолейкоза. Фермент микробного происхождения L-аспарагиназа, нарушающий превращение аспарагиновой кислоты в аспарагин и наоборот, оказывает сильное специфическое цитостатическое действие при этих видах лейкозов. Основные функции Аспарагиновая кислота является прямым предшественником аспарагина и участвует в синтезе незаменимых аминокислот метионина и треонина, в синтезе пиримидиновых нуклеотидов. Она играет важную роль в обмене веществ, в деятельности ДНК и РНК, синтезе иммуноглобулинов, способствует удалению вредного аммиака из организма. Важный фактор предотвращения усталости. Аспарагиновая кислота, будучи связывающим субстратом энергетического и пластического обмена, обладает способностью повышать основной обмен и участвует в передаче и модуляции межнейронных сигналов. Используется в качестве биологически активной добавки в питании спортсменов. Потребность Cуточная потребность - 6 г. Пищевые источники Значительное количество аспарагиновой кислоты содержат проращенных семенах Физиологич.роль: присутствует в организме в составе белков и в свободном виде играет важную роль в обмене азотистых веществ участвует в образовании пиримидиновых оснований и мочевины Аспарагиновая кислота и аспарагин являются критически важными для роста и размножения лейкозных клеток при некоторых видах лимфолейкоза. Фермент микробного происхождения L-аспарагиназа, нарушающий превращение аспарагиновой кислоты в аспарагин и наоборот, оказывает сильное специфическое цитостатическое действие при этих видах лейкозов. Синтез мочевины:  Карбомаилфосфатсинтетаза 1 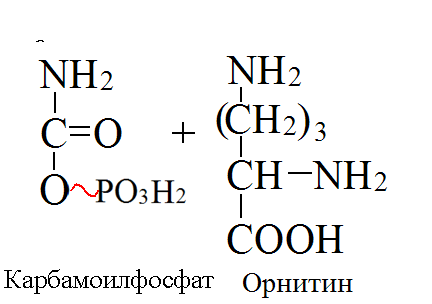  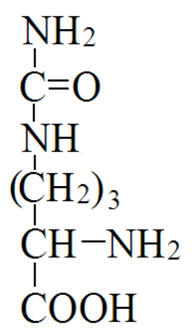 Орнитин Цитруллин карбомоил трансфераза 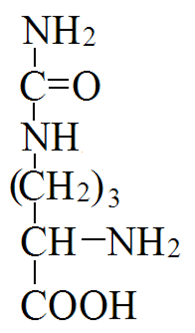 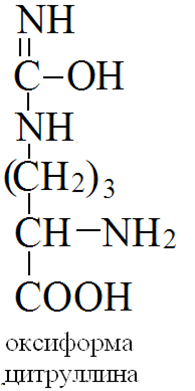 Цитруллин 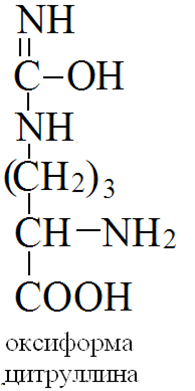 + +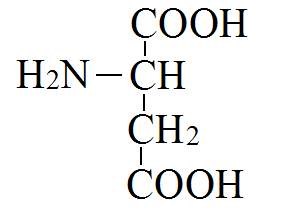  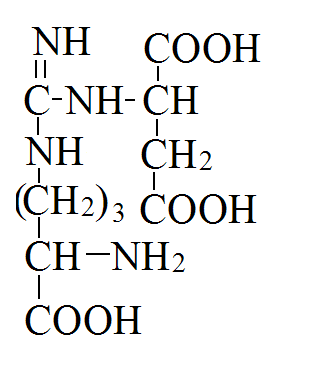 Асп Аргинино Аргининосукцинат сукцинат синтетаза Атф ФФн+АМФ 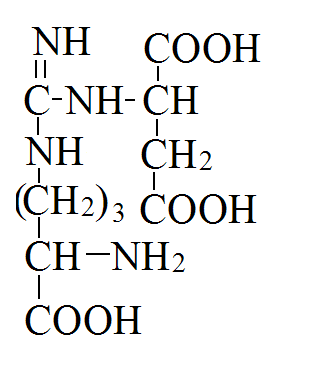   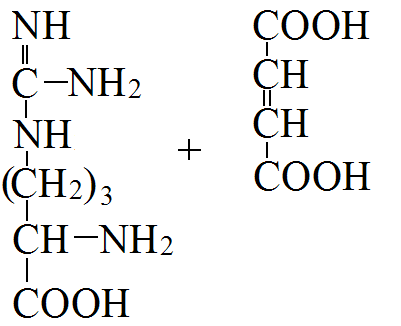 Аргининосукцинат лиаза Аргинин фуморат Аргининосукцинат 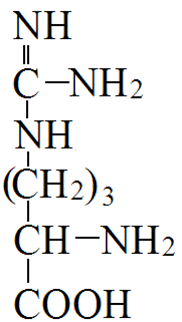  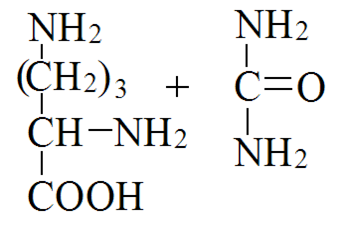 Аргиназа Аргинин Орнитин Мочевина |
