ответы на экзаменационные билеты. Применение изоферментов
 Скачать 6.79 Mb. Скачать 6.79 Mb.
|
|
Гипергликемия Физиологическая 1)Алиментарная Возникает после приёма пищи 2))Эмоциональная при стрессе и Патологическая (Возникает при: 1) сахарном диабете2) избытке контринсулярных гормонов, 3) расстройствах мозгового кровообращения. Глюкозурия – появление глюкозы в моче.Наблюдается, если гипергликемия более 9,3 ммоль/л, то есть превышает почечный порог.Возникает при: нарушении углеводного обмена, повреждениях почек, острых инфекциях, сотрясении головного мозга. Гипогликемия- снижение содержания глюкозы крови. Симптомы гипогликемии сходны с симптомами гипоксии: головокружение, обморок, ступор, кома. Причины гипогликемии голодание, усиленная мышечная работа, введение инсулина, инсулинома, злокачественные опухоли из-за повышенной утилизации глюкозы, алкоголизм (угнетение глюконеогенеза), заболевания почек, нарушения функции печени, гипофизарная, надпочечниковая, тиреоидная недостаточность, беременность и лактация, гликогенозы. 3. Рассмотрите схему ферментативной реакции: пируват ----------- > лактат. Назовите класс фермента, катализирующего данную реакцию. С участием какого кофермента протекает реакция? Какой витамин входит в его состав. Билет 27 над стрелочкой-ЛДГ оксидоредуктазы РРвит НАД Билет 28. 1. Гликолиз. Биологическая роль, химизм процесса, биоэнергетика, регуляция. Эффект Пастера. это анаэробный распад глюкозы до лактата. С6Н12О6 + 2АДФ +2Фн в2 лактата + 2АТФ + 2Н20. включает 11 реакций и 2 этапа. Значение гликолиза Благодаря гликолизу организм осуществляет ряд функций в условиях недостаточности кислорода. Когда на Земле не было кислорода, то гликолиз был основным источником энергии. Особенности гликолиза Ферменты гликолиза локализуются в цитоплазме. Наиболее интенсивен гликолиз в: эритроцитах, работающей мышце, эмбриональной ткани, опухоли. 3 необратимые реакции (киназные). Первый этап гликолиза  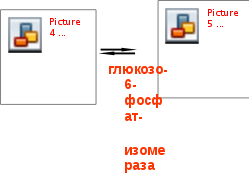 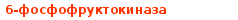  Второй этап гликолиза 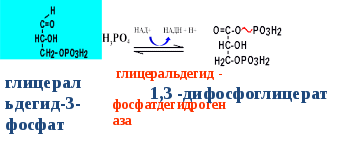 В активном центре фермента глицеральдегидфосфатдегидрогеназы содержатся SН-группы цистеина. На первом этапе происходит отщепление водорода с альдегидной группы субстрата, а второй водород от SН-группы активного центра. Водород переходит на НАД, в результате получаем НАДН+Н+, образуется фермент-субстратный комплекс, который взаимодействует с фосфорной кислотой. Свободная энергия, освобождённая при окислении альдегидной группы, сохраняется в высокоэнергетической фосфатной группе. 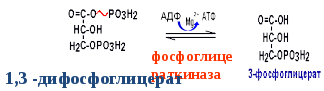 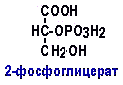 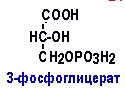 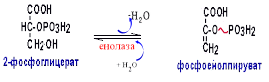 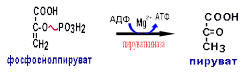 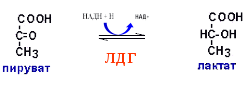 НАДН+Н , образующийся при окислении глицеральдегид-3фосфата,вновь окисляется в НАД, восстанавливая при этом ПВК до лактата. Эта реакция происходит в анаэробных условиях Баланс гликолиза АТФ образуется за счёт двух реакций субстратного фосфорилирования (ПК, фосфоглицераткиназной). Из глюкозы образуется 4АТФ. 2АТФ тратится в гликолизе на фосфорилирование (ГК, ФФК реакции). Гексокиназная реакция -1АТФ Фосфофруктокиназная реакция -1АТФ Фосфоглицераткиназная реакция 2АТФ Пируваткиназная реакция 2АТФ Итого: 4 – 2 = 2АТФ Регуляция гликолиза Гексокиназа – аллостерический фермент, ингибируется глюкозо-6-фосфатом. Инсулин стимулирует синтез глюкокиназы, которая не ингибируется глюкозо-6-фосфатом. Фосфофруктокиназа - аллостерический фермент. Положительный модулятор – АМФ, АДФ, Фн, цАМФ, ионы двухвалентных металлов. Отрицательный модулятор – АТФ и цитрат. Когда величина значительна, то происходит угнетение ФФК. Эффект Пастера -торможение гликолиза кислородом. Причина этого: кислород окисляет НАДН+Н и он не восстанавливает ПВК в лактат. 3) Пируваткиназа – аллостерический фермент. Положительный модулятор – АДФ. Отрицательный модулятор – АТФ, ацетил-КоА, жирные кислоты. Гликолиз обратим. Биологическое значение обратимости гликолиза: освобождение тканей от лактата, возможность осуществления глюконеогенеза 2. Витамин D. Химическая природа витамина, гормонально-активные формы. Участие витамина в обмене веществ. Рахит. Витамин D Суточная потребность в витамине D 15-25мкг Пищевые источники: сливочное масло, желток яиц, печень, рыбий жир. Синтез витамина D3 происходит в мальпигиевом слое эпидермиса под действием УФ-лучей из 7-дегидрохолестерина Затем транспортный белок переносит витамин D3 в печень. Роль витамина D в обмене кальция В печени происходит гидроксилирование в положении 25 В этом участвуют: ионы магния, НАДФН+Н+, цитохром Р450-редуктаза, цитохром Р450, кислород. Образуется 25-оксихолекальциферол, который из печени поступает в плазму крови и затем транспортируется в почки. В почках происходит гидроксилирование в положении 1 В этом участвуют: ионы магния, НАДФН+Н+, кислород, почечная ферредоксинредуктаза, почечный ферредоксин, цитохром Р450. Образуется кальцитриол (1,25-диоксихолекальциферол) Паратгормон активирует гидроксилирование в почках Гормонально активные кальцитриолы 24,25-диоксихолекальциферол 23,25-диоксихолекальциферол 24,26-диоксихолекальциферол Рахит заболевание, в основе которого лежат изменения фосфорно-кальциевого обмена и нарушение отложения в костной ткани фосфата кальция, ведущие к деформации скелета. у взрослых недостаточность витамина D вызывает остеомаляцию и кариес у беременных. Витамин-D-дефицитный рахит возникает при авитаминозе D. Витамин-D-толерантный рахит может быть связан: с нарушением функции паращитовидных желёз с нарушением функции почек. Рахит развивается при дефиците витамина D в пище, при недостаточном солнечном облучении, при заболеваниях почек, при недостаточной продукции паратгормона (нарушение гидроксилирования в почках), при дисбактериозе кишечника, при синдромах нарушенного всасывания (целиакия, муковисцидоз), под влиянием экологических факторов (замещение кальция в костях другими микроэлементами- стронций, свинец, цинк), недоношенность предрасполагает к рахиту, так как наиболее интенсивное поступление кальция и фосфора от матери к плоду происходит в последние месяцы беременности. Биохимия рахита понижение концентрации кальция и фосфора в крови, при этом Са/Р возрастает, снижение всасывания кальция и фосфора в кишечнике, снижение реабсорбции кальция и фосфора в почках, нарушается минерализация костной ткани, повышается активность щелочной фосфатазы, снижается синтез цитрата, который в норме связывает кальций. Билет 29. 1)Фосфолипиды, их химическая структура, биологическая роль, биосинтез, переваривание и распад. Липотропные вещества. фосфолипидов 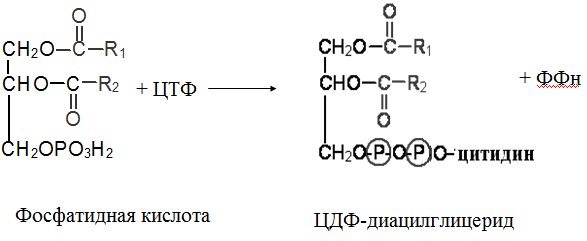 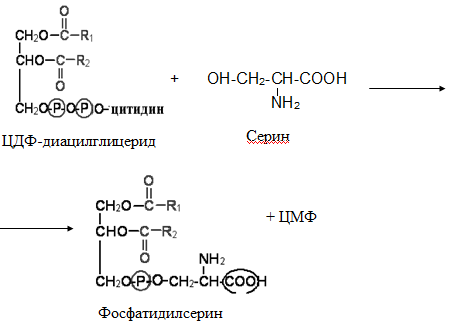 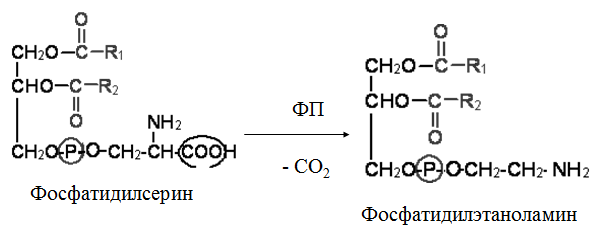 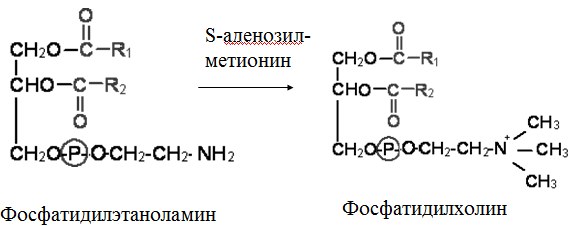 Фосфолипиды могут синтезироваться из готовых остатков (резервный путь) холин + АТФ = фосфохолин + АДФ фосфохолин + ЦТФ = ЦДФ-холин + ФФн ЦДФ-холин + 1,2-диглицерид = фосфатидилхолин + ЦМФ этаноламин + АТФ =фосфоэтаноламин + АДФ фосфоэтаноламин + ЦТФ = ЦДФ- этаноламин + ФФн ЦДФ- этаноламин + 1,2-диглицерид = фосфатидилхолин + ЦМФ Функции фосфолипидов структурная (входят в состав мембран, мозга), участвуют в обмене холестерина лецитин + холестерин Ёлизолецитин+ эфиры ХС, фосфатидилинозитол – предшественник вторичных посредников при действии гормонов, из фосфолипидов идёт синтез тромбоцитактивирующего фактора, вызывающего агрегацию тромбоцитов, снижение АД, дипальмитилфосфатидилхолин образуется в лёгких доношенного плода перед родами. Он входит в состав ПАВ сурфактанта лёгких, что препятствует спадению лёгочных альвеол. У недоношенных детей при недостатке этого соединения возникают расстройства дыхания. Липотропные вещества способны предотвращать жировую инфильтрацию печени холин, метионин, лецитин, казеин, инозит, липокаин, витамин В12, фолиевая кислота, липоевая кислота, пангамовая кислота. Механизм липотропного действия Липотропные вещества необходимы для синтеза ЛП (холин). Синтез ЛП – важный путь утилизации организмом липидов печени. В реакциях метилирования (в синтезе холина) участвуют метионин, витамин В12, фолиевая кислота. Казеин богат метионином. ФЛ поддерживают функцию клеточных мембран, необходимых для нормального протекания метаболических процессов в гепатоцитах. Липотропные вещества применяют при жировой дистрофии печени, гепатитах, циррозе, атеросклерозе. 2.Регуляция и патология белкового обмена. Гормональная регуляция белкового обмена. Все гормоны регулирующие, белковый обмен, делятся на две группы: Анаболические гормоны. Они активируют синтез белка и тормозят его распад. К их числу относятся: а) гормон роста – соматотропный гормон вырабатывается в передней доле гипофиза, активирует все стадии синтеза нуклеиновых кислот и белка, активирует транспорт аминокислот в клетку, обеспечивает синтез белка энергией, переключая биоэнергетику клетки с углеводов на липиды, в результате усиливается рост костного скелета, мышечной ткани, устанавливается положительный азотистый баланс. б) инсулин – гормон поджелудочной железы, активирует синтез белка, распад глюкозы и образование энергии, которая необходима для синтеза белка., тормозит распад белка и глюконеогенез, т.е. образование глюкозы из аминокислот. в) тироксин – гормон щитовидной железы, в детском организме и в малых дозах стимулирует синтез белка практически во всех тканях, способствует задержке азота, активирует транспорт аминокислот через мембраны, активирует синтез около 100 ферментов. г) андрогены – активируют синтез белка в мышечной, соединительной и костной ткани, а также в тканях-мишенях мужского организма, активирует все этапы синтеза белка и нуклеиновых кислот, транспорт аминокислот в клетку. д) эстрогены – активируют синтез белка в тканях-мишенях женского организма. Катаболические гормоны: активируют распад белка и аминокислот, тормозят синтез белка: а) тироксин в больших дозах во взрослом возрасте усиливает окислительные процессы в том числе аминокислот, активирует распад белка, повышает основной обмен, способствует усилению выведению азота из организма. Активирует синтез глюкозы из аминокислот. б) гормоны коры надпочечников: глюкокортикоиды усиливают распад белка, трансаминирование, тормозят синтез белка, активируют глюконеогенез. Патология белкового обмена. Затрагивает все виды метаболизма. Делится на наследственную и приобретенную. Наследственная патология может быть обусловлена отсутствием какого либо фермента или низкой его активностью. Причиной этого являются различные генетические дефекты. Например, отсутствие одного или нескольких ферментов процесса мочевинообразования приводит к развитию гипераммониемии. Анальбуминемия развивается как следствие нарушения синтеза этого белка в печени из-за остутствия соответствующего гена. Приобретенная патология белкового обмена возникает как осложнение основного патологического процесса при заболеваниях печени, почек. Состояние сопровождается гипо- и диспротеинемией. Например, при циррозе печени возникает гипоальбуминемия, причиной которой является утрата способности гепатоцита синтезировать белки. При острых и хронических заболеваниях почек наблюдается избыточное выведение альбуминов с мочой. Приобретенная патология может развиваться на фоне дефицита поступления аминокислот, в организме развивается белковое голодание, которое приводит к снижению иммунной защиты, склонности к инфекционным заболеваниям. При диспансерном обследовании у мужчины 45 лет выявлено повышение глюкозы крови до 7,1 ммоль/л. Какие дополнительные биохимические исследования необходимо провести для уточнения диагноза? Билет 29 тест толерантности к глюкозе определен глюкозы в моче энзимодиагностика Билет 30. 1.Гормоны островкового аппарата поджелудочной железы. Химическая структура и влияние на обмен веществ. Гормоны островкового аппарата поджелудочной железы Инсулин – первый гормон, для которого расшифрована белковая природа. Его удалось получить синтетическим путём. Инсулиноподобные вещества вырабатываются в печени, почках, эндотелии сосудов головного мозга, слюнных железах, гортани, сосочках языка.Инсулин – простой белок. Состоит из двух полипептидных цепей: а- и в-. а-цепь содержит 21 аминокислотный остаток, в-цепь – 30. Инсулин синтезируется в виде неактивного предшественника проинсулина, который путём ограниченного протеолиза превращается в инсулин. При этом от проинсулина отщепляется С-пептид из 33 аминокислотных остатков. Основной эффект инсулина – повышение проницаемости клеточных мембран для глюкозы. Инсулин активирует гексокиназную реакцию, синтез глюкокиназы, гликолиз, все фазы аэробного распада, пентозный цикл, синтез гликогена, синтез жира из глюкозы. Инсулин ингибирует: распад гликогена, глюконеогенез. Инсулин является анаболиком. способствует синтезу гликогена, жира, белка. оказывает белоксберегающий эффект, так как тормозит глюконеогенез из аминокислот.Органы – мишени инсулина и характер метаболического влияния  Глюкагон вырабатывается а-клетками островков Лангерганса, состоит из 29 АМК, молекулярная масса 3500. Органы-мишени: печень, жировая ткань. Действует глюкагон через цАМФ. Рецепторами являются липопротеины мембран. Биологическая роль глюкагона стимулирует фосфоролиз гликогена печени, стимулирует глюконеогенез, усиливает липолиз в жировой ткани и печени, увеличивает клубочковую фильтрацию, ускоряет ток крови, способствует экскреции соли, мочевой кислоты, стимулирует протеолиз, увеличивает кетогенез, стимулирует транспорт АМК в печени, снижает концентрацию калия в печени. 2.Окислительное фосфорилирование. Значение и механизм процесса. Разобщение дыхания и фосфорилирования. Свободное окисление. Субстратное фосфорилирование. Окислительное осфорилирование-синтез АТФ из АДФ и Фн за счёт энергии, выделяющейся при тканевом дыхании. •Идею о наличии сопряжения высказал в 1931году англичанин Энгельгардт. •Для образования одной макроэргической связи АТФ, затраты на которую составляют не менее 7,3 ккал, требуется перепад редокс-потенциалов между участками цепи 0,2 В на пару перенесённых электронов. Места сопряжения В дыхательной цепи есть 3 участка, в которых перенос электрона сопровождается относительно большим изменением стандартной свободной энергии: •НАДН-ДГ-KoQ, •цитохром В -цитохром С1, •цитохромоксидаза, Это пункты фосфорилирования. Уменьшение энергии на каждом из этих участков достаточно для сопряжённого образования АТФ. Основные положения хемоосмотической концепции 1) Движущей силой фосфорилирования является протонный градиент. Перенос электрона сопровождается выкачиванием ионов водорода из матрикса через внутреннюю мембрану митохондрии. При транспорте каждой пары электронов в межмембранном пространстве может накапливаться до 6 протонов. Свободная энергия потока электронов используется для перекачивания ионов водорода наружу против градиента концентрации. Перенос электронов создаёт электрохимический градиент ионов Н+ (Dm Н+),включающий 2 ионокомпонента: Dm Н = y + DрН. 2) Окислительное фосфорилирование требует целостностивнутренней митохондриальной мембраны. При разрыве мембраны нет окислительного фосфорилирования, хотя перенос электронов продолжается. 3) Внутренняя митохондриальная мембрана непроницаемадля ионов Н, ОН, К, Сl .Если мембрана при повреждениистановится проницаемой, то окислительного осфорилирования не будет. Ионы Н+ из окружающей среды вновь устремляются внутрь в матрикс митохондрий по электрохимическому градиенту через молекулыFoF1-АТФазы. Этот переход ионов водорода сопровождается выделение свободной энергии , за счёт которой и синтезируется АТФ. Между митохондрией и окружающей её средой совершается непрерывный кругооборот ионов водорода, движущей силой которого является перенос электронов. Различают разобщители 1. естественной природы:•прогестерон,•тироксин,•холод, •жирные кислоты. 2. патологические факторы:•дифтерийный токсин, 3. искусственные:•валиномицин,•грамицидин,•2, 4 –динитрофенол. Ионофоры –жирорастворимые вещества, способные связывать ионы и переносить их чрез мембрану, подавляют окислительное фосфорилирование. Свободное (нефосфорилирующее) дыхание •В митохондриях дыхание не всегда сопровождается с фосфорилированием. Такой путь окисления субстратов в дыхательной цепи назван Ленинджером свободным окислением. •Вся энергия окисляемых веществ превращается при этом в теплоту. Теплообразующая функция митохондрий была впервые продемонстрирована В.П. Скулачёвым. Субстратное фосфорилирование–образование АТФ за счёт превращения субстрата, имеющего макроэргическую связь. 3.Почему при переходе на рацион питания с высоким содержанием белка, у человека возрастает потребность в витамине В6. Билет 30 обмен белков-NH2 Билет 31. 1.Пути обезвреживания аммиака в организме. Транспорт аммиака. Мочевина как конечный продукт обмена аминокислот. Синтез мочевины. Гипераммониемия. |
