ответы на экзаменационные билеты. Применение изоферментов
 Скачать 6.79 Mb. Скачать 6.79 Mb.
|
|
Токсичность аммиака связана с его действием на ЦНС аммиак проходит сквозь мембраны и проникает в клетки мозга, аммиак взаимодействует с α-кетоглутаратом, что приводит к снижению скорости окисления глюкозы, угнетение обмена АМК из-за снижения концентрации α-кетоглутарата, аммиак усиливает синтез глутамина в нервной ткани, повышается осмотическое давление, развивается отёк мозга, снижение концентрации глу приводит к нарушению обмена нейромедиаторов (ГАМК), это нарушает проведение нервного импульса и вызывает судороги, аммиак в крови и цитозоле образует ион NH4+, накопление которого нарушает трансмембранный перенос ионов натрия и калия, что влияет на проведение нервных импульсов. Источники аммиака в организме дезаминирование АМК, амидов АМК, биогенных аминов, пуриновых оснований, распад пиримидиновых оснований, образуется в кишечнике с участием бактерий из пищевого белка. Пути обезвреживания аммиака синтез мочевины, образование амидов АМК, восстановительное аминирование, образование аммонийных солей. Образование амидов АМК у детей раннего возраста это основной путь обезвреживания аммиака. 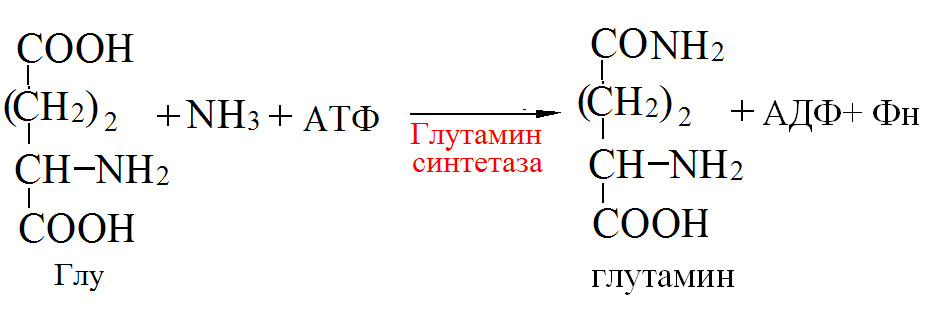 Глутамин нетоксичен, свободно проходит через клеточную мембрану, форма, в которой транспортируется аммиак, временное хранилище аммиака, используется для синтеза белка, аминосахаров, пуриновых и пиримидиновых нуклеотидов, фолиевой кислоты, аминокислот (глу, три, гис, аспарагин), донор аммиака. Образование аммонийных солей глутамин используется почками в качестве источника аммиака, необходимого для нейтрализации кислых продуктов. 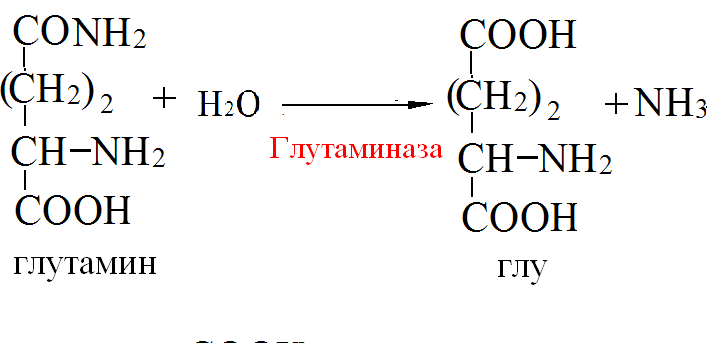 Удаление аммиака происходит в виде аммонийных солей с мочой (до 1 г в сутки). Восстановительное аминирование 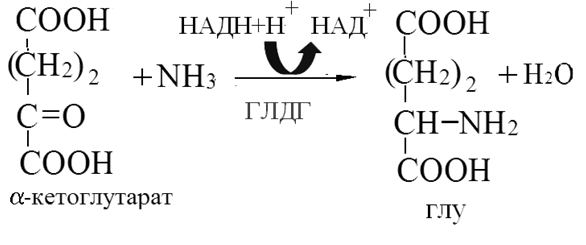 Экскреция аммиака с мочой увеличивается при ацидозе При ацидозе повышается активность глутаминазы и усиливается глюконеогенез. Глутамат после дезаминирования может превращаться в глюкозу путём глюконеогенеза. Биосинтез мочевины из кишечника аммиак с воротной веной идёт в печень, главный путь экскреции азота у человека в составе мочевины. протекает в печени, в синтезе мочевины 5 реакций, 2 из которых протекают в митохондриях Орнитиновый цикл основной путь обезвреживания аммиака и главная форма выделения азота из организма взрослых и детей старшего возраста. Синтез мочевины 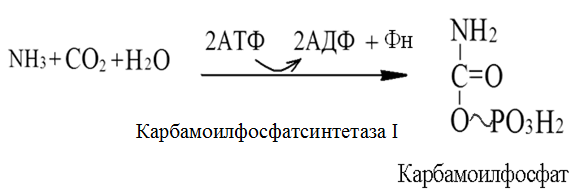 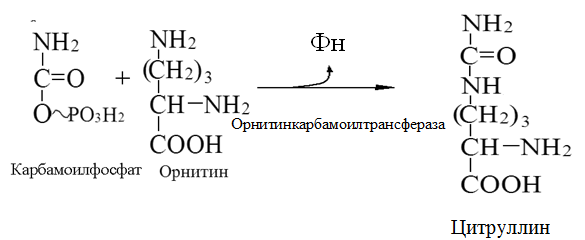 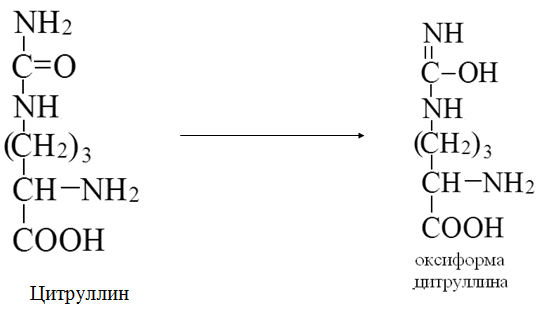 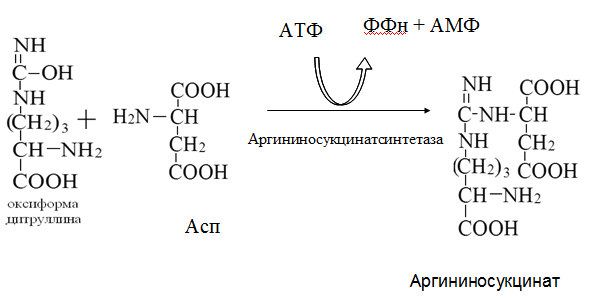 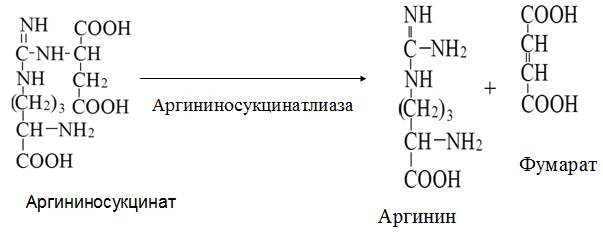 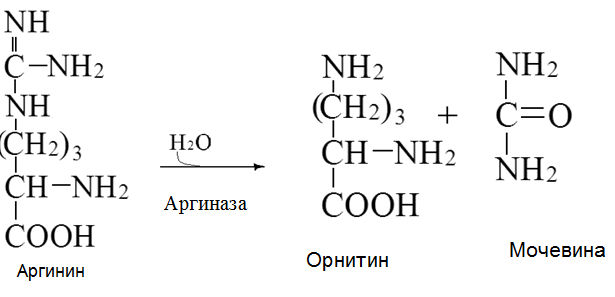 Экскреция мочевины в норме выделяется 25 г мочевины в сутки, мочевина – основной конечный продукт азотистого обмена. для транспорта азота из тканей в печень используется 3 соединения: глутамин, аланин, аммиак. Гипераммониемия – повышенное содержание аммиака в крови. рвота, сонливость, раздражительность, нарушение координации, судороги, потеря сознания, отёк мозга. 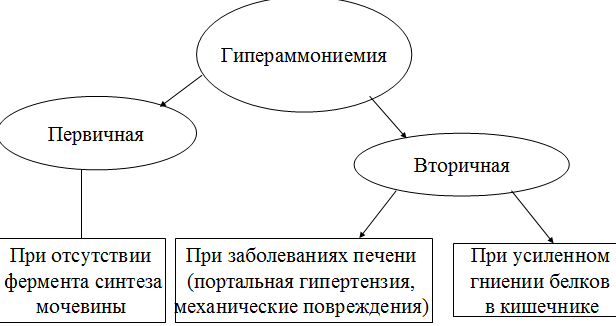 Гипераммониемия типа I наследственная, при недостатке карбамоилфосфатсинтетазы1. Гипераммониемия типа II наследственная,при недостатке орнитинкарбамоилтрансферазы. 2.Классификация и химическая структура углеводов, их роль в обеспечении жизнедеятельности организма. Переваривание и всасывание углеводов в пищеварительном тракте. Мальабсорбция. По химическому строению углеводы являются полиоксиальдегидами и полиоксикетонами и продуктами их поликонденсации. Углеводы широко распространены в растительном мире (крахмал, клетчатка и др.), на их долю приходится до 80% на сухое вещество. В организме человека и животных на долю углеводов приходится не более 2% от массы тела. 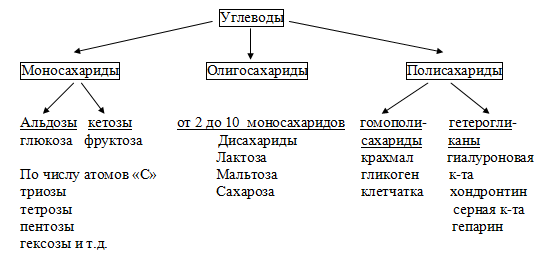 Функции углеводов: Энергетическая функция.60-70% энергии организм получает за счёт углеводов. Суточная потребность в углеводах 400 – 500 г. Мозг, кровь, почки, надпочечники живут за счёт углеводов. При окислении 1 г углеводов выделяется 4,1 ккал энергии. Резерв энергии – гликоген в мышцах и печени. Структурная функция. Углеводы входят в состав мембран, сухожилий. Защитная функция. Углеводы содержатся в слизи и антителах. Углеводы входят в состав биологически активных веществ: нуклеиновых кислот, коферментов, гормонов, гликолипидов, гликопротеидов. Глюкурониды участвуют в детоксикации. Специфические функции углеводов. входят в состав групповых факторов крови, гепарин, антигены в мембранах при развитии клеточного иммунитета.Углеводы – связующее звено между солнцем, растениями, животными, человеком. В растениях содержится глюкоза, при распаде которой в организме человека освобождается энергия. Углеводы поступают в организм человека с хлебом, растительной пищей. Основные углеводы пищи: глюкоза, лактоза, сахароза, крахмал, гликоген, клетчатка. Переваривание углеводов Ферменты, расщепляющие углеводы, относятся к гидролазам, так как осуществляют гидролиз гликозидных связей. Переваривание начинается в ротовой полости. а-Амилаза слюны расщепляет а-1,4-гликозидные связи, не гидролизует связи в дисахаридах. Оптимум рН амилазы – 6,8. Крахмал расщепляется до декстринов и небольшого количества мальтозы. Кислый желудочный сок прекращает действие амилазы, лишь в глубине желудка идёт переваривание углеводов до мальтозы. Переваривание углеводов в кишечнике В двенадцатиперстной кишке а-амилаза панкреатическая(рН =7,5-8,0) завершает переваривание крахмала и гликогена до мальтозы. В кишечном соке мальтаза, сахараза, лактазаосуществляют гидролиз дисахаридов на поверхности клеток и внутри энтероцитов у взрослых. Сахаразо-изомальтазный комплекс гидролизует сахарозу и изомальтозу. Этот комплекс присоединяется к мембране микроворсинок кишечника. Расщепляет а-1,4- и а-1,6- гликозидные связи. Гликоамилазный комплекс (действует как мальтаза) гидролизует а-1,4- гликозидные связи в олигосахаридах 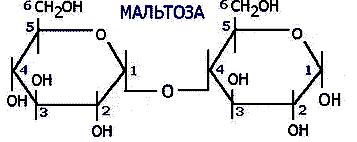 Лактаза кишечного сока гидролизует в-1,4 -гликозидные связи между галактозой и глюкозой в лактозе. 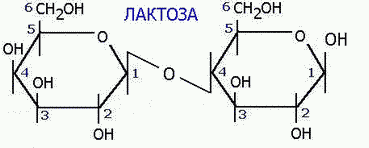 Механизм трансмембранного переноса глюкозы Глюкоза и фруктоза всасываются из кишечника в клетки слизистой оболочки путём облегчённой диффузии с помощью специфических белков – переносчиков. Глюкоза и галактоза переносятся в энтероциты путём активного транспорта, зависимого от градиента концентрации ионов натрия. Из клеток кишечника в кровь глюкоза поступает в кровь с помощью облегчённой диффузии. Из кровотока потребление глюкозы клетками осуществляется путём облегчённой диффузии при участии специальных белков – транспортеров. Исключение составляют клетки мышц и жировой ткани, где облегчённая диффузия регулируется инсулином. Без инсулина мембрана этих клеток непроницаема для глюкозы, так как в ней нет белков-переносчиков для глюкозы. В клетки печени глюкоза проходит при участии белка глют-2, независимо от инсулина. Бифидобактерии анаэробные молочнокислые бактерии, населяющие кишечник человека, составляют 95-98% всей микрофлоры кишечника, обнаруживаются уже на 3-5 день после рождения. ферментируют углеводы с образованием молочной и уксусной кислот, тем самым способствуя всасыванию углеводов, способствуют синтезу витаминов К и В1, непатогенны для человека. Антагонисты энтеропатогенных и гнилостных бактерий. Мальабсорбция дисахаридов - нарушения всасывания, вызванные расстройствами транспортных механизмов и недостаточностью пищеварительных ферментов. Различают: синдром первичной мальабсорбции (наследственный),синдром вторичной мальабсорбции. Этиология:снижение активности ферментов расщепления углеводов и транспортных переносчиков через кишечную стенку,недостаточное поступление в кишечник ферментов с пищеварительными соками,инактивирование ферментов,морфологические изменения тонкой кишки и нарушение перистальтики. Непереносимость лактозы Первичная непереносимость лактозы Недостаточность лактазы наследуется по аутосомно-рецессивному типу. Лечение: маленьким детям в молоко добавляют лактазу. Приобретённая непереносимость лактозы наблюдается при энтероколитах, язвенных колитах. Симптомы: метеоризм, диарея при употреблении молока. У взрослых чаще бывает приобретённая непереносимость глюкозы. При непереносимости лактозы наблюдается лактозурия. 3.О поражении какой ткани можно думать, если в крови больного повышена активность АЛТ, ЛДГ и аргиназы? За счет каких изоферментов ЛДГ можно предполагать повышение активности фермента? Билет 31 печень, ЛДГ 5 Билет 32. Химическая природа ферментов. Активный и аллостерический центры, их роль. Доказательства белковой природы ферментов все выделенные ферменты – белки, методы получение ферментов и белков одинаковы, факторы, вызывающие денатурацию белка, вызывают инактивацию ферментов, при гидролизе ферменты дают аминокислоты, ферменты обладают высокой специфичностью. Ферменты могут быть простыми белками пепсин, трипсин, уреаза, лизоцим. Ферменты могут быть сложными белками ЛДГ, трансаминазы. Сложные ферменты помимо белковой части содержатнебелковую часть – кофермент. Ферменты, являясь белками, имеют каждый свою I, II, III, IV – структуры. Активный центр фермента это зона молекулы фермента, которая отвечает за выбор субстрата, связывание и превращение его в продукты реакции. Активный центр формируется в процессе образования III и IV структуры фермента. Он выполняет каталитическую функцию. Его формируют чаще следующие аминокислоты: серин, цистеин, лизин, гистидин, глутаминовая кислота, аспарагиновая кислота, тирозин, которые имеют функциональные группы в радикалах. Эти группы в ходе катализа реагируют с субстратом. Субстрат – это вещество, на которое действует фермент, в результате чего образуются продукты реакции. В активном центре рассматривают каталитический и субстратный участки. В субстратном участке фиксируется субстрат, а в каталитическом – происходит превращение субстрата, при условии, если есть стерическое соответствие субстрата и активного центра фермента. Аллостерический центр характерен для ферментов, имеющих IV-структуру. Это другой центр, пространственно не совпадает с активным центром. С этим центром связываются определённые, обычно низкомолекулярные, вещества (эффектроы или модуляторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет III и IV- структуры молекулы фермента и соответственно конфигурацию активного центра, вызывая либо снижение или повышение активности фермента. Апотомический путь обмена глюкозы. Окислительная и неокислительные ветви процесса. Биологическое значение пентозного цикла. ПЕНТОЗНЫЙ ЦИКЛ апотомический (усечённый) С6 вС5 + СО2, прямое окисление глюкозы, добавочный метаболический путь, идёт в определённых тканях: печени, жировой ткани, хрусталике, роговице, эритроцитах, половых железах, надпочечниках, молочных железах. В цитоплазме клеток в цикл вступают сразу не менее 6 молекул глюкозы. Различают две ветви пентозного цикла Окислительная ветвь происходит образование НАДФН+Н, кислород не участвует, может протекать в присутствии и отсутствии кислорода. Неокислительная ветвь образование пентоз, образование исходного глюкозо-6-фосфата, не нуждается в кислороде, идёт в анаэробных условиях. Биологическая роль пентозного цикла образование пентоз (синтез нуклеиновых кислот), образование НАДФ+Н для восстановительных синтезов (синтез холестерина, жирных кислот), сгорание других моносахаридов, помимо гексоз, образование 36 АТФ. Пентозный цикл - источник энергии у детей, так как аэробный распад глюкозы ещё не функционирует нормально. Гексокиназная реакция 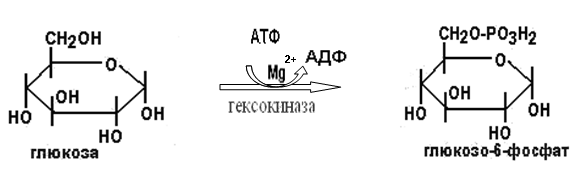 ОКИСЛИТЕЛЬНАЯ ВЕТВЬ ПЕНТОЗНОГО ЦИКЛА 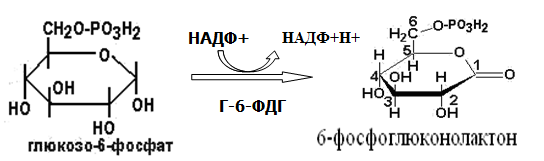 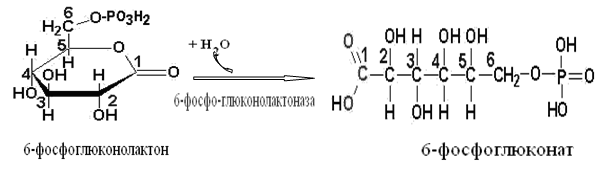 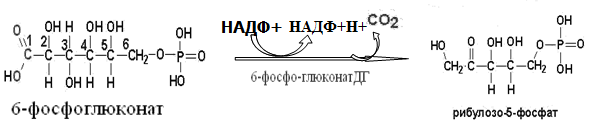 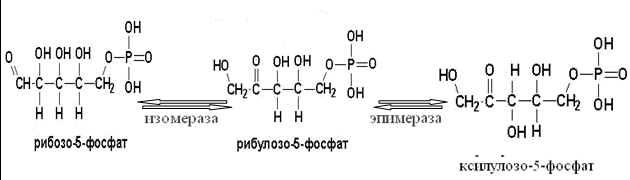 Итоговое уравнение окислительной части  Неокислительная ветвь пентозного цикла (в анаэробных условиях) 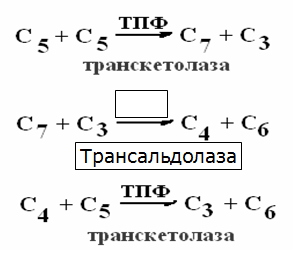 Пентозный цикл связан с гликолизом. Триозы и гексозы могут вступать в дихотомический путь. В этом цикле за один оборот полностью распадается одна молекула глюкозы, все 6 углеродных атомов которой превращаются в СО2. Регуляция пентозного цикла Усиливают пентозный цикл гормоны: инсулин, кортикотропин, андрогены, эстрогены. При дефиците витаминов Е, К на фоне угнетения тканевого дыхания нарастает активность ферментов пентозного цикла, Ингибиторы пентозного цикла - фунгициды. Особенности пентозного цикла у детей Активность ферментов пентозного цикла отмечена у плода. В периоде новорожденности активность ферментов пентозного цикла существенно возрастает. У новорожденных половина глюкозы, окисляемой в пентозном цикле, идёт на образование энергии, а половина участвует в синтетических процессах. Это объясняется тем, что не начал полностью функционировать аэробный дихотомический путь. Низкая эффективность гликолиза. Отсутствие в эритроцитах глюкозо-6-фосфатдегидрогеназы Эритроциты нестойкие. Происходит гемолиз. Развивается анемия. Пентозный цикл в эритроцитах поставляет НАДФН+Н для восстановления окисленного глутатиона. 2 Глутатион-SH + Н2О2 в Г-S-S-Г + 2Н2О. Накопление перекиси сокращает время жизни эритроцита. При недостатке витамина В1 Нарушается пентозный цикл. Определение активности транскетолазы крови позволяет судить о степени недостаточности тиамина. При перницитозной анемии возрастает активность транскетолаз. Нарушаются процессы синтеза нуклеиновых кислот, жирных кислот. 3.Аммиак является раздражителем нервной системы. При введении глутаминовой кислоты больным эпилепсии их состояние улучшается: частота приступов, судорог снижается. Почему? Напишите, какие биохимические реакции происходят в мозгу при введении глутаминовой кислоты? Билет 32 связывает белок Предшественник. ГАМК-тормозн медиатор 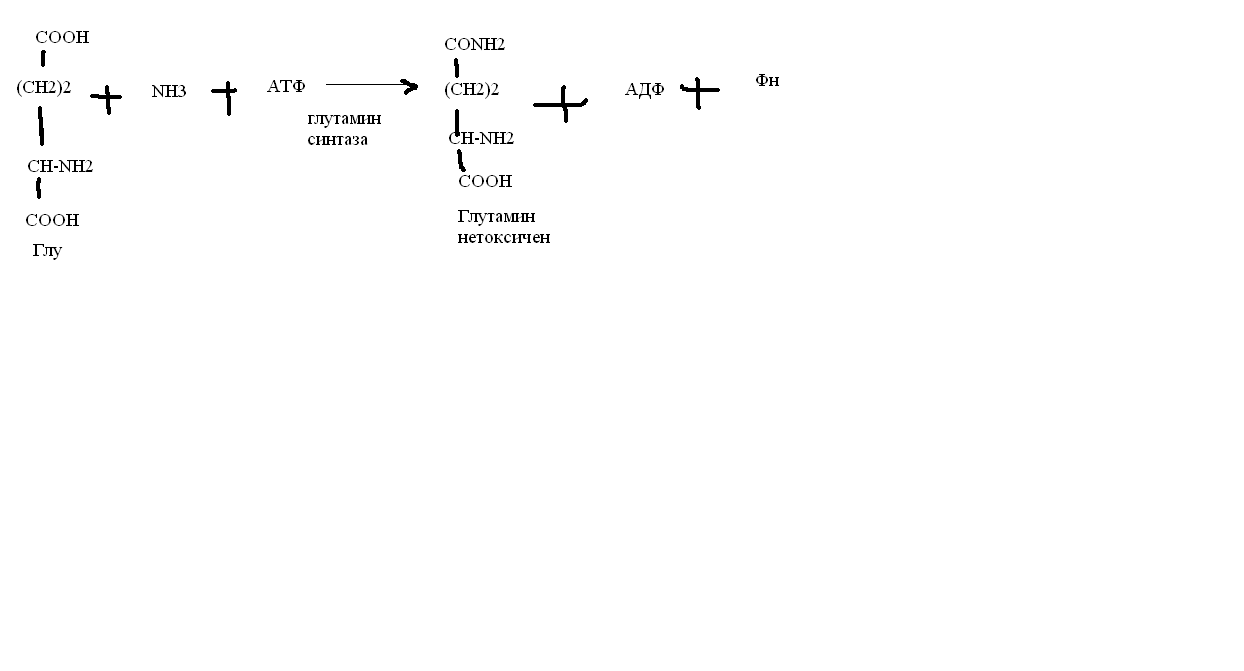 Билет 33. 1)Основные функции белков в организме. Структурная организация белковой молекулы. Особенности формирования первичной, вторичной, третичной и четвертичной структур белка. Функции белков структурная, каталитическая, регуляторная, рецепторная, иммунологическая, защитная, транспортная, сократительная, опорная, обезвреживающая, энергетическая, геннорегуляторная, создание биопотенциалов мембран, гомеостатическая, индивидуальное строение органов, обеспечивают хорошее зрение. Первичная структура белка порядок, последовательность расположения АМК в полипептидной цепи. Свойства первичной структуры белка уникальна, детерминирована генетически, её стабильность обеспечивается в основном пептидными связями, возможно участие небольшого числа дисульфидных связей, в первичной структуре детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, в полипептидной цепи могут быть обнаружены разнообразные комбинации АМК: не во всех белках содержатся все 20 АМК, ни в одном белке АМК не содержатся в эквивалентных отношениях, некоторые АМК встречаются редко и в меньшем количестве (гли в 10 раз чаще, чем три). принцип структурного подобия (в белках встречаются идентичные пептидные структуры), в состав полипептидной цепи входит 100-1000 АМК. Даже небольшие изменения первичной структуры изменяют свойства белков. HbA1 - у здоровых людей, HbS - у больных серповидно-клеточной анемией. HbS в шестом положении β-цепи вместо глу имеет валин.Отличается по физическим, химическим и биологическим свойствам. |
