ответы на экзаменационные билеты. Применение изоферментов
 Скачать 6.79 Mb. Скачать 6.79 Mb.
|
|
Вторичная структура пространственное расположение полипептидной цепи, поддерживаемое водородными связями С=О … Н-N между фрагментами цепи. Связи нековалентные, непрочные. α-спираль устойчивая винтовая лестница, закрученная по часовой стрелке,NН-группа остатка АМК взаимодействует с СО – группой четвёртого от него остатка, на виток приходится ,6 АМК остатка, 5,4 Å – шаг спирали (расстояние между витками). АМК формирующие α-спираль: ала, лей, глн, цис, фен, тир, три, мет, вал, дестабилизирующие α-спираль: сер, иле, тре, глу, лиз, арг, гли, асп, нарушающие α-спираль: про, оксипролин. Белки с α-спиралью: гемоглобин, миоглобин. β-складчатость пептидные цепи располагаются параллельно друг другу в один слой, подобно листу, сложенному гармошкой. На каждой плоскости образуются пептидные связи и радикалы выходят из структуры.Полипептидные цепи могут формировать параллельные ли антипараллельные β-структуры. Складчатые структуры В белках встречаются области с нерегулярной вторичной структурой, которые называются беспорядочными клубками. Во многих белках присутствует и α-спираль и β-складчатость. Белки с β-складчатостью β-кератины (фиброин шёлка), фибриллярные белки волос, шёлка. Третичная структура пространственное расположение пептидной цепи, поддерживаемое межрадикальными связями.Все биологические свойства белков связаны с сохранностью их третичной структуры. Связи дисульфидная – ковалентная, Все остальные связи нековалентны: гидрофобные – между аминогруппами с неполярными радикалами (вал, мет, ала, фен, иле), водородные между полярными радикалами (OH, NH2, SH, COOH), ионные - между заряженными полярными радикалами (лиз, арг, гис, асп, глу). Белки с известной третичной структурой гемоглобин, трипсин, лизоцим, инсулин, цитохром. Методы изучения третичной структуры рентгеноструктурный анализ, электронное микроскопирование. Четвертичная структура белок может состоять из нескольких цепей, число и взаиморасположение в пространстве которых различно. Олигомерные белки состоят из нескольких полипептидных цепей: гемоглобин -4, гексокиназа – 2, ГЛДГ -6, ферритин -24. Связи, поддерживающие четвертичную структуру гидрофобные, ионные, водородные. Белки с известной четвертичной структурой гемоглобин, ГЛДГ, миоглобин, ГК. 2.Образование и распад ацетоновых тел. Кетогенез в норме и при патологии. Кетоновые тела образуются из ацетил-КоА, синтезируются в печени. Содержание кетоновых тел в крови здоровых людей: 0,8 – 1,2 ммоль/л. Синтез кетоновых тел  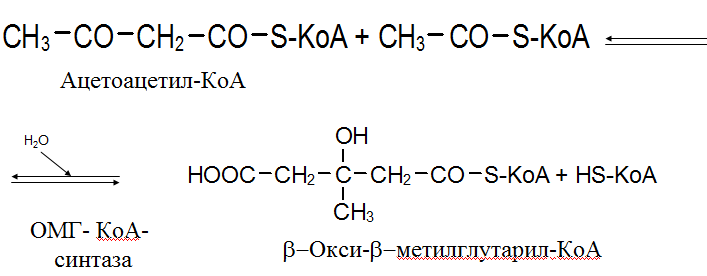  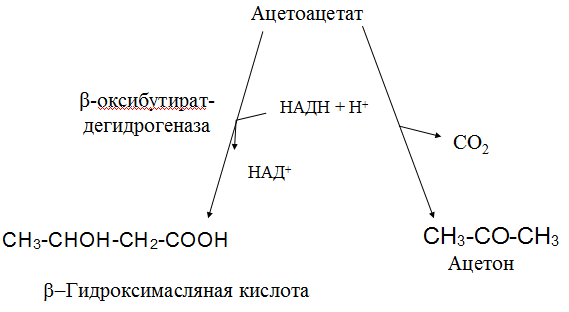 Источники синтеза кетоновых тел жирные кислоты, кетопластичные АМК. Избыток ацетил-КоА, высвобожденный при окислении жирных кислот и не использованный печенью, превращается в кетоновые тела, которые переносятся кровью в периферические ткани, где используются в ЦТК. Кетоновые тела –поставщики топлива для мышц, почек, мозга. Для мозга основным энергетическим субстратом являются глюкоза и кетоновые тела. Использование ацетоуксусной кислоты   Регуляция Инсулин активирует синтез жира, тормозит образование ОМГ, ингибирует образование ацетоновых тел, Глюкагон активирует синтез ацетоновых тел, активирует синтез ОМГ, тормозит синтез жирных кислот за счёт блокады ацетил-КоАкарбоксилазы, усиливает β-окисление, тормозит обмен глюкозы. Кетонемия, кетонурия наблюдаются при сахарном диабете, голодании, длительной мышечной работе,токсикозе беременных, приёме пищи, богатой жирами. Развивается метаболический ацидоз. В мозге новорожденных кетоновые тела потребляются в 3 раза интенсивнее, чем у взрослых.В раннем детстве они используются тканью мозга для синтеза жирных кислот при миелинизации мозга. Склонность к кетозу повышена у детей в возрасте от 2 до 10 лет, так как снижена концентрация глюкозы и повышена концентрация НЭЖК, нарушен АМК обмен (кетогенные кислоты). 3.В эксперименте с изолированными митохондриями в качестве субстрата использовали малат. Как изменится показатель Р/О, если: а) в инкубационную смесь добавить ингибитор НАДН-дегидрогеназы? б) вместе с ингибитором добавить сукцинат? Билет 33 А)тормозин перено е и р следовательно нарушает тканев дыхание Б)  Билет 34. Классификация ферментов. Общая характеристика класса гидролаз. Основные подклассы гидролаз. В основе классификации лежит тип катализируемой реакции. Оксидоредуктазы катализируют окислительно-восстановительные реакции. Трансферазы - реакции с переносом групп. Гидролазы - гидролитический разрыв связи СС, СN, СS с присоединением воды по месту разрыва. Лиазы – реакции негидролитического расщепления с бразованием двойных связей, некоторые обратные реакции синтеза. Изомеразы – перенос групп внутри молекулы с образованием изомеров. Лигазы катализируют соединение двух молекул, сопряжённое с разрывом пирофосфатной связи АТФ. Гидролазы– простые белки.  Подкласс определяется типом расщепляемой связи 3.1. – сложноэфирные, 3.2. – гликозильные, 3.4. – пептидные. Подподкласс уточняет тип связи: 3.1.1. – эфиры карбоновых кислот. В класс гидролаз входят пептидогидролазы, эстеразы, гликозидазы. Пептидогидролазы аминопептидазы, карбоксипептидазы, дипептидазы, протеиназы (пепсин, трипсин, папаин).Эстеразы расщепляют эфиры. карбоксиэстеразы (липаза), фосфоэстеразы (КФ, ЩФ), сульфоэстеразы. Гликозидазы катализируют гидролиз гликозидов. 2.Обмен и биологическое значение фенилаланина и тирозина. Молекулярная патология обмена этих аминокислот. Обмен фенилаланина и тирозина на 50% кетогенные, фен – незаменимая АМК, тир – условно заменимая АМК.  Блок 1. ФенилПВК: токсичен в первые 2-4 года жизни, ингибирует ПК, ГК, обмен триптофана, нарушает обмен серотонина, приводит к развитию фенилпировиноградной олигофрении.Фенилпировиноградная олигофрения встречается с частотой 1 на 20 000, для постановки диагноза необходимо провести реакцию мочи с FеClз 10% (зелёное окрашивание). Симптомы: задержка умственного развития, меняется нейромедиаторная активность, сокращается образование нейромедиаторных производных тирозина (тирамин, катехоламины), нарушается баланс АМК, синтез белка, нейромедиаторов в нервной ткани.Скорость обмена АМК наиболее высока в нервной ткани. Наследственные аминоацидопатии – одна из основных причин слабоумия. Нарушение обмена фенилаланина При побочном пути метаболизма фенилаланина образуются фенилэтиламин и фенилацетат. Это нейротоксины, они способны нарушать метаболизм липидов в мозге. Избыток фен и его минорные метаболиты – тератогенны. Приводят к множественным порокам у плода. Нарушения катаболизма тирозина.  Блок 2. При дефекте йодтирозиназы развивается кретинизм. При этом аутосомно-рецессивном заболевании моно- и дийодтирозин не дейодируются, развивается нехватка тиреоидных гормонов. 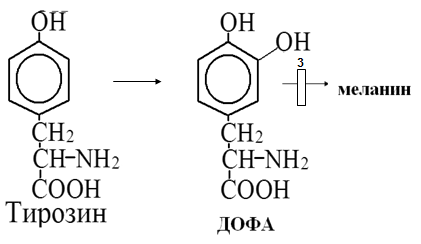 Блок 3 При дефекте тирозиназы развивается альбинизм. 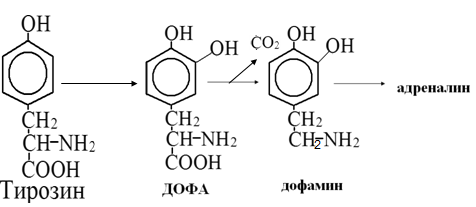 При первичной болезни Паркинсона заторможено образование дофамина из ДОФА в ткани мозга.  Блок 4. на уровне тирозинтрансаминазы, развивается тирозинемия II типа. Симптомы: умственная отсталость, поражения глаз, кожи. 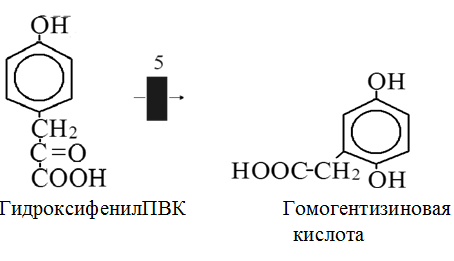 Блок 5. на уровне гидроксифенилПВКгидроксилазы, развивается тирозинемия новорожденных. 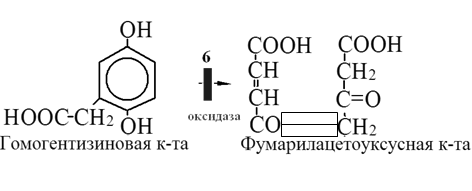 Блок 6. на оксидазе гомогентизиновой кислоты, развивается алкаптонурия. Симптомы: охроноз, артриты, чёрная моча. Лабораторная диагностика алкаптонурии: при подщелачивании мочи NаОН гомогентизиновая кислота окисляется с образованием соединения сине-фиолетового цвета. Гомогентизиновая кислота ингибирует лизингидроксилазу. 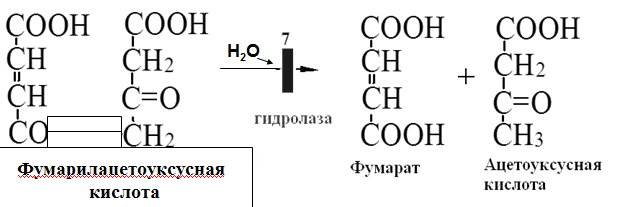 Блок 7. на фумарилацетоацетатгидролазе, развивается тирозинемия I типа. Симптомы: в плазме повышено содержание тирозина и метионина, понос, рвота, задержка в развитии, смерть в 6-8 лет. 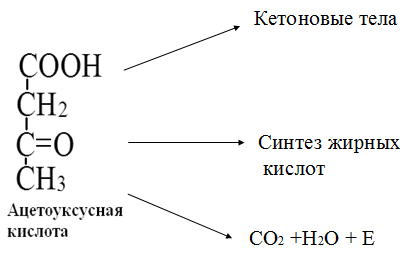  При отсутствии витамина С оксидазы не работают. 3)Сколько молекул глюкозы надо разрушить до лактата, чтобы получить то же количество АТФ, которое образуется при полном распаде молекулы глюкозы (до СО2 и Н2О). Обоснуйте ответ. Билет 34 19 т.к 38/2 Билет 35. 1)Классификация витаминов. Авитаминозы, гиповитаминозы, гипервитаминозы. Причины развития витаминной недостаточности в организме человека. Витамин В1, признаки витаминной недостаточности. Нарушения углеводного обмена при В1-витаминной недостаточности. Витамины – это низкомолекулярные органические соединения, которые поступают в организм с пищей или синтезируются в относительно небольших количествах в кишечнике. Они участвуют в обменных процессах в составе коферментов. Их классифицируют по способности растворяться в воде или липидах: водорастворимые (РР, В1, В2, В6, В12, С) и жирорастворимые витамины (А, D, Е, К). Причины гиповитаминозов и авитаминозов. При отсутствии поступления витаминов в организм развиваются болезни называемые авитаминозами. При ограниченном содержании витаминов в организме развиваются гиповитаминозы, а если поступает избыточное количество витаминов с пищей – гипервитаминозы. Причины гиповитаминозов и авитаминозов: Эндогенные: нарушение всасывания витаминов при заболеваниях ЖКТ, дисбактериоз, эндокринные заболевания, инфекционные заболевания, искусственное вскармливание, избыточные потребности в витаминах при беременности, лактации, росте ребенка, половом созревании, физических нагрузках, а также при курении и алкоголизме. Экзогенные: условия быта (подвальные помещения), род трудовой деятельности (горячие цеха), занятия спортом, климатическая зона проживания, технология приготовления пищи (консервирование), длительное хранение продуктов питания, социальные факторы (неблагоприятная семья, колонии, религиозные обычаи и.т.д). Витамин В1 – тиамин. Тиамин в тканях подвергается фосфорилированию при участии АТФ и превращается в тиаминдифосфат (ТДФ). Это основная связанная форма тиамина которая является коферментом. Биологическая роль: Тиамин в форме кофермента участвует в окислительном декарбоксилировании ПВК, - кетоглутаровой кислоты; в составе транскетолаз пентозного цикла в окислении глюкозы, с амидом никотиновой кислоты в процессах превращения триптофана в витамин РР. При дефиците В1 развивается заболевание получившее название полиневрит или бери-бери. Специфические симптомы этого заболевания связаны с нарушением функций: нервно-мышечной системы – постепенное снижение чувствительности, угасание периферических рефлексов, боли по ходу нервных стволов, параличи с мышечной слабостью и атрофией скелетных мышц; расстройства высшей нервной деятельности (потеря памяти, страх) – сердечно-сосудистой системы (тахикардия, нарушения сердечного ритма, одышка) – пищеварительной системы – нарушение моторной и секреторной функции желудка, кишечника (атония, диарея, снижение секреции соляной кислоты) Суточная потребность: 2-3 мг. Источники В1: зародыши ячменя, дрожжи, гречневая крупа, хлеб грубого помола, мясо, желтки яиц, печень, морковь, бананы, крыжовник и т.д При недостатке витамина В1 Нарушается пентозный цикл. Определение активности транскетолазы крови позволяет судить о степени недостаточности тиамина. При перницитозной анемии возрастает активность транскетолаз. Нарушаются процессы синтеза нуклеиновых кислот, жирных кислот. 2)Биохимия мышечной ткани. Важнейшие белки мышц. Креатин, креатинфосфат, креатинин, их синтез и биологическая роль. мышц Белки саркоплазмы миоглобин, белки–ферменты Белки миофибрилл Сократительные белки: миозин, актин, актомиозин Регуляторные белки:тропомиозин, тропонин Белки стромы эластин, коллаген Миоглобин Дыхательный белок мышц. Гемопротеин Содержит 153 аминокислотных остатка. Основная функция – перенос кислорода в мышцах. Состоит из 1 полипептидной цепи, уложенной в пространстве в виде глобулы. Миозин Составляет 50 – 55% от массы миофибрилл. Фибриллярный белок. Период полураспада – 20 дней. Состоит из 2 тяжелых цепей (мол. масса 200 000 Да) и 4 легких цепей (мол. масса 20 000 – 25 000 Да) . Активные центры головки миозина обладают АТФ-азной активностью: АТФ + Н2О → → АДФ + Рн + Е Актин Составляет 20% от массы миофибрилл. Небольшой глобулярный белок. Состоит из 1 полипептидной цепи (374 аминокислотных остатка). Молекула глобулярного актина способна к спонтанной агрегации, образуя фибриллярный актин Тропомиозин фибриллярный белок. состоит из 2 α-спиралей. на 1 молекулу тропомиозина приходится 7 молекул актина. молекула тропомиозина закрывает активные центры связывания актина Тропонин Глобулярный белок. В состав входят 3 субъединицы: Тн-Т – тропомиозинсвязывающая субъединица – отвечает за связь с тропомиозином Тн-С – кальцийсвязывающая субъединица – обладает сродством к ионам Са2+ Тн-I – ингибиторная субъединица – ингибирует АТФ-азную активность, препятствуя взаимодействию актина и миозина Креатинкиназная реакция Преимущества:Самый быстрый способ синтеза АТФ (каждая молекула креатинфосфата образует 1 молекулу АТФ) Максимально эффективен Не требует кислорода. Включается мгновенно. Не дает побочных продуктов. Креатин мышц резервирует энергию в макроэргических связях и передает эту энергию для участия в акте мышечного сокращения Недостаток: малый резерв субстрата (на 20 секунд работы) Биосинтез и распад креатина Креатин и креатининфосфат – важные азотистые вещества мышцы. Находится креатин в мышцах, ткани мозга, миокарде в свободном состоянии и в форме фосфокреатина. При переходе от покоя к работе мышцы сначала используют АТФ, образующийся из креатинфосфата – это наиболее быстрый путь генерации АТФ. Синтез креатина Первая стадия синтеза креатина протекает в почках под действием глицин-амидинотрансферазы.  Вторая стадия – метилирование- протекает в печени.  В мышцах имеется высокоэнергетическое вещество – креатинфосфат. 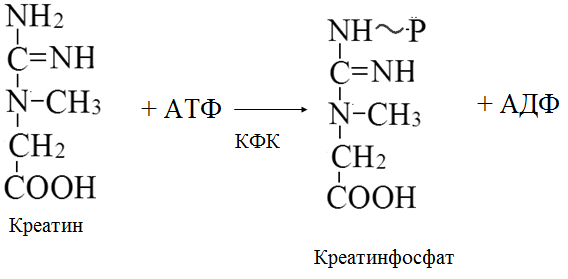 Креатинин образуется в результате неферментативного дефосфорилирования креатинфосфата. 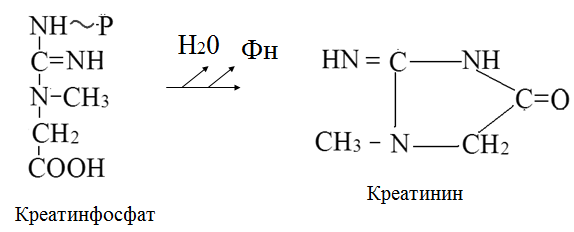 Содержание в плазме крови В плазме крови в небольших количествах содержатся креатин и креатинин. Содержание креатинина в плазме крови - 44-100 ммоль/л у мужчин, у женщин - чуть меньше.С мочой креатин выделяется только у детей, у взрослых – креатинин.При болезнях почек с нарушением фильтрации выделение креатинина уменьшается, а его количество в крови увеличивается.В норме суточное выделение креатинина с мочой пропорционально мышечной массе. Диагностическое значение уровень креатинина в сыворотке – чувствительный показатель состояния функции почек, снижение выделение креатинина с мочой наблюдается при гипертиреозе и прогрессирующей мышечной дистрофии в связи со снижением скорости синтеза креатина. Повышение выделения креатина наблюдается при переохлаждении организма. заболеваниях скелетной мускулатуры (при нарушении трофики и структуры мышц), при этом креатинурия сопровождается снижением содержания креатинина в моче, что связано с нарушением механизма превращения креатина в креатинин. 3. У двух пациентов тест толерантности к глюкозе дал следующие результаты: глюкоза (ммоль/л) натощак через 60 мин. через 120 мин. 1. 4,5 8,0 4,3 2. 6,1 14,0 10,0 Оцените состояние пациентов. Билет 35 1) N N N 2)повыш N; повыш N; повыш N явный диабет Билет 36. 1)Роль белков в питании человека. Биологическая ценность пищевых белков. Полноценные и неполноценные белки. Азотистый баланс. Переваривание белков в желудке. Определение кислотности желудочного сока. В организме человека содержится около 15 кг белков. Количество свободных АМК примерно 35 г. АМК и белки содержат 95 % всего азота в организме. Классификация аминокислот по заменимости заменимые, незаменимые (Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен) , частично заменимые (Арг, Гис), условно заменимые (Цис, Тир). Азотистый баланс – разность между общим количеством азота, поступившим в организм человека и количеством экскретируемого азота. Азотистое равновесие наблюдается у взрослого здорового человека. При этом количество синтезируемого белка, равно количеству экскретируемого. Положительный азотистый баланс у детей, беременных, выздоравливающих, введении анаболиков. При этом синтез белка преобладает над распадом. Отрицательный азотистый баланс при голодании, старении, истощающих заболеваниях, раке. Избыток и недостаток белка При недостаточном поступлении белка развивается белковая недостаточность.При белковых нагрузках вероятность возникновения дистрофических поражений почек, аллергических заболеваний, неопластических процессов повышается.Белковый оптимум для человека умственного труда при средней физической нагрузке – 100 г в сутки, при работе в жарком климате – 120 г в сутки. Оптимальная норма белка в питании обеспечивает положительный азотистый баланс. На потребность в белке влияют климатические условия, характер трудовой деятельности, возраст, физиологическое состояние организма, стрессы, наличие заболеваний. Белковый минимум 30-50 г в сутки такое количество белка необходимо для поддержания азотистого равновесия. Даже при полном исключении из диеты всех белков с мочой выводится 4 г азота в сутки, то есть 25 г белка. Следовательно, при белковом голодании организм ежесуточно расходует примерно 25 г белков собственных тканей. Биологическая ценность белков определяется сбалансированностью АМК состава, атакуемостью белков ферментами пищеварительного тракта (доступностью АМК).Ограниченная всасываемость АМК растительной пищи связана с высоким содержанием в ней волокон, наличием специфических ингибиторов пищеварительных ферментов если эти ингибиторы не инактивированы горячей обработкой пищи (соя, горох). Идеальный белок 100% биологическая ценность, 100% усвоение в ЖКТ.К идеальным белкам можно отнести белок женского молока, белок цельного куриного яйца.Белки коровьего молока усваиваются на 90%, растительные белки – на 60%. Ценность белка определяется его химическим составом. Незаменимые АМК: Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен. Незаменимые АМК для детей: Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен, Гис и Арг. Скорость синтеза Гис и Арг недостаточна для того, чтобы обеспечить рост организма в детстве. Исключение какой-либо АМК из пищи сопровождается развитием отрицательного азотистого баланса, истощением, остановкой в росте, нарушениями со стороны нервной системы. При отсутствии Гис, Арг – анемия. При отсутствии Три – катаракта. При отсутствии Лиз - кариес, задержка роста. При отсутствии Мет страдает печень.Дефицит белка в пище вызывает потерю массы тела, нарушения роста, ферментную недостаточность, нарушения иммунитета. Парентеральное белковое питание используют при ожогах, отравлениях, непроходимости пищевода, тяжёлых раковых поражениях пищевода и желудка. Желудочный сок 95% - вода,0,5% органические вещества, 2,5 литра. Состав желудочного сока пепсин (7 изоферментов), соляная кислота, гастрин (гормон, стимулирующий желудочную секрецию), лизоцим (вырабатывается поверхностью эпителия желудка), слизь (гликопротеины) несёт защитную функцию, внутренний фактор Кастла. Соляная кислота создаёт рН 1,5-2 у взрослого, рН 5-6 – у новорожденных. Роль соляной кислоты вызывает денатурацию, набухание белка, активация пепсиногена, создаёт оптимум рН для пепсина, бактерицидное действие, нужна для всасывания железа, стимулирует работу внутреннего фактора Кастла, стимулирует работу секретина. Общая кислотность желудочного сока - совокупность всех кислотореагирующих веществ желудочного сока. Связанная соляная кислота - соляная кислота, связанная с белками и продуктами их переваривания. Свободная соляная кислота - соляная кислота, остающаяся в избытке. Кислотность измеряется в титрационных единицах – количество NaOH, затраченное на титрование 100 мл желудочного сока. Общая кислотность – 40-60 ТЕ. Связанная соляная кислота – 20-30 ТЕ. Свободная соляная кислота - 20-40 ТЕ. 2)Аэробный (дихотомический) путь распада глюкозы. Роль пируватдегидрогеназного комплекса в процессе окислительного декарбоксилирования пирувата. Биоэнергетика процесса. Аэробный распад глюкозы Основной путь катаболизма глюкозы. Дихотомический распад молекулы глюкозы на 2 триозы. Происходит в нервной ткани, почках, печени, сердце. Поставляет энергию в клетку. Требуется кислород. В процессе аэробного распада глюкозы выделяют три этапа: Гликолитическая фаза. Окислительное декарбоксилирование ПВК. Цикл трикарбоновых кислот. I этап аэробного распада –гликолиз без последней реакции. Все реакции протекают в цитоплазме. Кислород может присутствовать, а может и отсутствовать (анаэробная фаза). Две реакции идут с затратой энергии (гексокиназная, фосфофруктокиназная ). Субстратное фосфорилирование обеспечивает на одну молекулу глюкозы 4 молекулы АТФ. 2 НАДН+Н+ (на 1 молекулу глюкозы)образуются в глицеральдегидфосфатдегидрогеназной реакции, проникают в митохондрии , где дают 3*2=6 АТФ. Большинство реакций обратимы, три реакции необратимые (гексокиназная, фосфофруктокиназная, пируваткиназная). Баланс: приход 6+4= 10АТФ. расход 2АТФ. 10-2 = 8АТФ. Первый этап гликолитической фазы 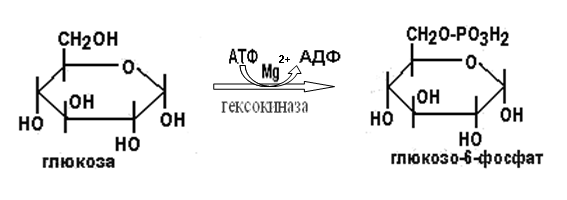  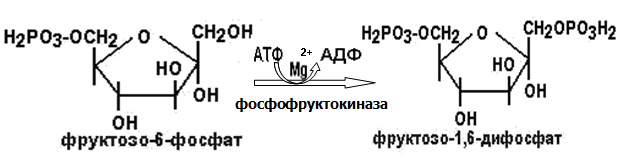   Второй этап гликолитической фазы 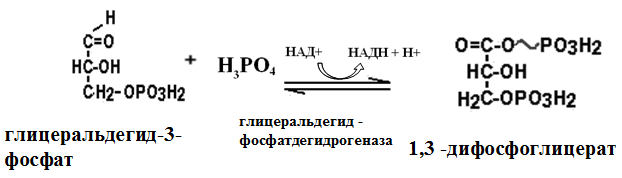   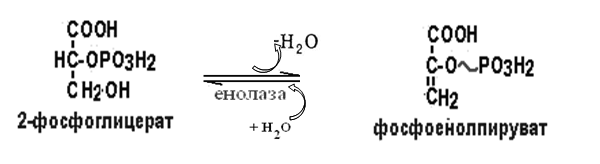  II этап - окислительное декарбоксилирование ПВК 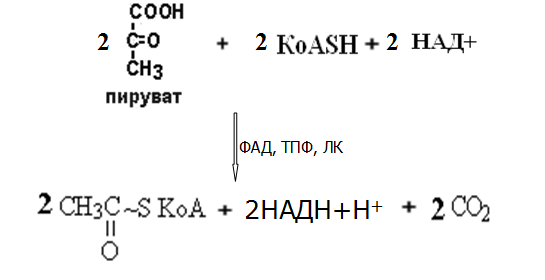 Пируватдегидрогеназная реакция Реакция катализируется мультиферментным пируватдегидрогеназным комплексом, в котором участвуют 5 коферментов (ФАД, ТПФ, липоевая кислота, НАД , КоАSH) и 3 фермента. Условия протекания реакции ПВК диффундирует в матрикс митохондрий, реакция протекает в матриксе митохондрий, реакция необратима, требуется кислород, образуются 2 НАДН+Н, которые дают 6АТФ. При избытке углеводов у ребёнка возникает недостаточность тиамина, в крови накапливается ПВК (продукт неполного окисления углеводов). III этап - Цикл Кребса идёт в митохондриях, требует присутствия кислорода, из 1 молекулы ацетил-КоА – 12АТФ из 2 молекул ацетил-КоА = 2*12 АТФ=24 АТФ. При аэробном распаде глюкозы: этап – 8 АТФ, этап – 6 АТФ, этап –24 АТФ. Итого: 38 АТФ на 1 моль глюкозы. 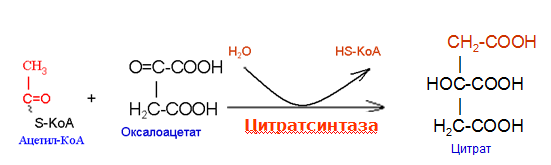 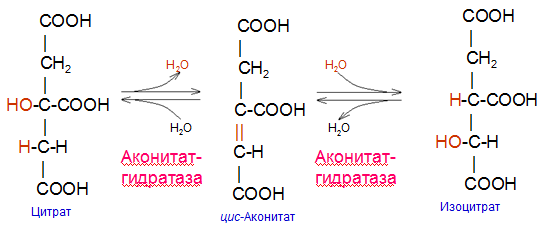 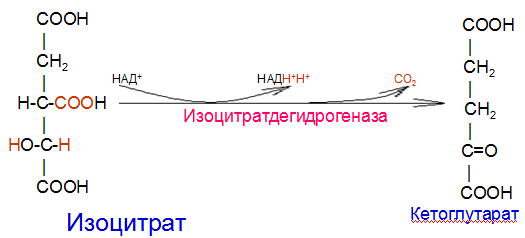  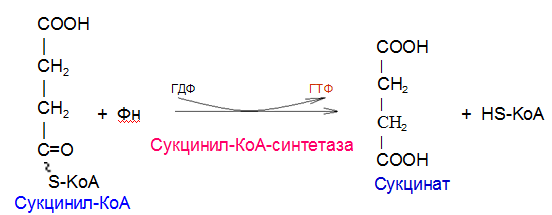 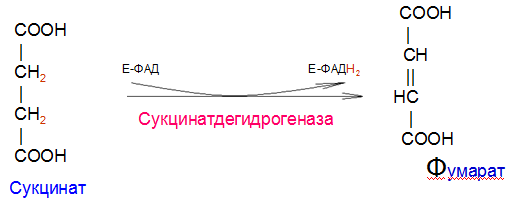 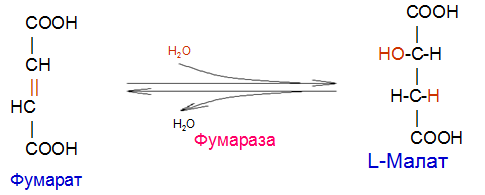  3)В моче больного обнаружено увеличение уробилина. Чем это может быть обусловлено? Какие биохимические исследования нужно провести, чтобы уточнить причину появления билирубина в моче? Билет 36 кровь на свободн билирубин Билет 37. 1)Биосинтез белка. Активация аминокислот, трансляция. Ингибиторы синтеза белка. Влияние облучения на синтез белка. Активация аминокислоты Требуется:•аминокислота,•т-РНК,АТФ,•ионы магния,•кодазы.Трансляция – синтез белка на матрице РНК. •ДНК –код АТГ,•и-РНК –кодон УАУ,•т –РНК –антикодон АУГ. Этапы трансляции •инициация,•элонгация,•терминация. Инициация Инициирующий кодон –АУГ. •Рост цепей идёт с N-конца. •Синтез начинается с N-формилметионина. Необходимые компоненты: •рибосомы,•инициирующий кодон,•инициаторная аминоацил-тРНК,•факторы инициации (IF1, IF2, IF3),•ГТФ, •ионы магния. •Процесс формилирования предотвращает участие аминогруппы АМК в образовании пептидной связи и обеспечивает синтез белка в направлении от аминогруппы к карбоксильной. •IF3первым связывается с малой субъединицей рибосомы. •IF3обеспечивает узнавание участка на м-РНК, куда присоединяется формилметионин-тРНК. •IF1 способствует связыванию формилметионин-тРНК с малой субъединицей рибосомы и присоединению к ней м-РНК. •IF2 способствует объединению большой и малой субчастиц. Элонгация трансляции Необходимо: •т-РНК,•АМК,•ГТФ,•ионы магния,•рибосомы,•факторы элонгации,•м-РНК •Формилметионин-тРНК поступает сначала на А-центр, а потом на Р-центр. •Участок А получает другую АМК. Для этого необходим ГТФ. •Рибосома делает «шаг» по м-РНК на один кодон. •Формилметионин переходит на А-участок с Р-участка. На А-участке происходит синтез пептидной связи под влиянием пептидилтрансферазы. •Рибосома перемещается на один кодон. Дипептид вновь переносится на Р-участок под влиянием пептидилтрансферазы. •На А-участок поступает третья АМК. •При перебросе в участок А дипептида образуется трипептид. Терминация Необходимы: •рибосомы, •факторы терминации (3), •м-РНК, •терминирующие кодоны УАГ, УАА, УГА. От рибосомы отделяется белок, т-РНК, м-РНК. м-РНК распадается до рибонуклеотидов. Терминация трансляции Синтез митохондриальных белков •2% клеточной ДНК находится в митохондриях. •Белки, синтезируемые в митохондриях, нерастворимы и участвуют в организации структуры митохондрий. Влияние облучения на синтез белков •Наиболее чувствительны ткани в состоянии митоза (костный мозг, эпителий кишечника). •Наиболее устойчивы -клетки ЦНС. •Если повреждаются соматические клетки, то они гибнут или укорачивается срок их жизни. •В половых клетках изменения передаются по наследству. При облучении активируется СРО. В итоге: •гибель клетки,•мутации,•торможение деления. Действие на репликацию •мутации типа делеции, •нарушается связь ДНК с гистоновыми и негистоновыми белками, •хромосомные абберации, •тормозится репарация ДНК. Влияние облучения на транскрипцию. •подавление активности ферментов транскрипции, •нарушение процессинга РНК. Влияние облучения на трансляцию. •тормозится сборка инициаторного комплекса, •происходит сборка белка с изменённой первичной структурой, •появляются функционально неполноценные белки. 2)Гормоны стероидной природы: глюкокортикоиды, половые гормоны, минералокортикоиды. Химическая структура гормонов, механизм действия, влияние на обмен веществ. Кора надпочечников – жизненно важный орган. В коре синтезируется свыше 50 кортикостероидов,7 – 10 из них - гормоны: глюкокортикоиды, минералокортикоиды, половые гормоны. Глюкокортикоиды кортикостерон, кортизон, гидрокортизон, 11-дезоксикортизол, 11-дегидрокортикостерон. Глюкокортикоиды состоят из 21 углеродного атома и имеют боковую цепь у 17 атома углерода.75-80 % глюкокортикоидов связаны с транскортином.10-15 % - с альбумином. Органы-мишени для глюкокортикоидов соединительная ткань, мышцы, жировая ткань, лимфоидная ткань, печень, почки. Влияние глюкокортикоидов на белковый обмен Глюкокортикоиды являются катаболиками в мышечной, лимфоидной, соединительной, жировой тканях. Снижают проницаемость клеток этих тканей для аминокислот и глюкозы, способствуют гипераминоацидурии, повышают выделение общего азота с мочой. В печени глюкокортикоиды – анаболики. Влияние глюкокортикоидов на углеводный обмен: усиливают глюконеогенез из АМК, ингибируют ГК, снижают синтез гликогена в мышцах, активируют гликогенолиз. на жировой обмен: стимулируют липолиз, активируя липазы, повышают содержание жирных кислот в крови. Из-за того, что жирные кислоты не успевают сгорать, развивается кетонемия и стероидный диабет. Глюкокортикоиды: влияют на терморегуляционный центр, снижают синтез АТФ и адениловых нуклеотидов, оказывают противоаллергическое действие (угнетение образования иммуноглобулинов), оказывают противовоспалительное действие: уменьшают проницаемость капилляров, ослабляют фагоцитарную активность лимфоцитов.Применение В клинике глюкокортикоиды применяют как десенсибилизаторы, противовоспалительные, иммунодепресснты. Используют при коллагенозах, бронхиальной астме. Минералокортикоиды дезоксикортикостерон, альдостерон: 1) Действует на канальцевый аппарат почек: снижает реабсорбцию калия (нарушение сократительной способности мышц), повышает реабсорбцию натрия и хлора из первичной мочи повышается осмотическое давление крови, лимфы, тканевой жидкости повышается обратное всасывание воды в кровь. 2) Усиливает воспаление.Катаболизм гормонов 17-кетостероиды – конечные метаболиты гормонов- выводятся с мочой. у мужчин 10-25 мг в сутки.у женщин 5-15 мг в сутки. Выделение увеличивается при: опухоли коры надпочечников и семенников, аддисоновой болезни, микседеме. Гиперкортицизм Возникает при: опухоли коры надпочечников, поражении гипоталамо- гипофизарной системы (избыток либерина). Проявляется повышенной секрецией всех кортикостероидов, либо одной группы гормонов. Болезнь Иценко - Кушинга возникает при избытке кортизола При этом заболевании: «буйволовый» тип телосложения, повреждается миокард, снижается иммунитет, стероидный диабет, гипергликемия, гипертония. Синдром Кона возникает при избыточном выделении альдостерона При этом заболевании: задержка натрия, хлора и воды в организме. теряется калий, отёки, гипертония, слабость, повышается возбудимость миокарда. Гиперплазия коры надпочечников Гормонально активные опухоли коры надпочечников:кортикостерома, андростерома, кортикоэстрома, альдостерома, смешаннные опухоли. При опухоли, продуцирующей мужские половые гормоны в моче много 17-кетостероидов, появляются усы и борода у женщин. Гипокортицизм Бронзовая болезнь (болезнь Аддисона) Причины: аутоиммунные поражения клеток коры надпочечников, туберкулёз, сифилис. Клинические проявления: слабость, гипотония, гипогликемия, снижение концентрации натрия и хлора, повышение концентрации калия, пигментация кожи (кортикостерон связан с МСГ), снижается сопротивляемость к стрессам, инфекциям, снижается возбудимость миокарда. Эстрогены синтезируются в яичниках, жёлтом теле, надпочечниках, семенниках, плаценте. Женские половые гормоны 1) Эстрогены (эстрадиол, эстрон, эстриол).2) Прогестины (прогестерон).Секреция этих гормонов носит циклический характер:В первой фазе цикла выделяются эстрогены, а во второй – прогестерон (в жёлтом теле). Женские половые гормоны  Биологическая роль эстрогенов Обеспечение репродуктивной функции организма: стимулируют рост яйцеводов и матки, усиливают размножение клеток эндометрия, усиливают сократительную функцию матки, стимулируют разрастание желёз эндометрия, в миометрии стимулируют синтез белка, увеличивают активность ферментов, анаболики, действуют на ЦНС. Биологическая роль прогестерона Органы - мишени прогестерона: молочные железы, матка. Прогестерон: стимулирует процессы, обеспечивающие наступление беременности и её сохранение до родов, готовит эндометрий матки к имплантации оплодотворённой яйцеклетки, стимулирует разрастание эндометрия, усиливает деятельность маточных желёз, стимулирует развитие железистой ткани молочных желёз, расслабляет маточную мускулатуру, влияет на ЦНС. Релаксин – гормон плаценты, яичников, эндометрия. Стимулирует размягчение лонного сращения, открытие шейки матки. Плацентарные гормоны Хорионический гонадотропин – гликопротеин. Стимулирует рост, развитие и секреторную активность жёлтого тела. эстрогены, прогестерон, релаксин, окситоцин, СТГ, ТТГ, АКТГ, глюкокортикоиды Андрогены (тестостерон, андростерон, дегидроэпиандростерон) Синтезируются в семенниках, клетках яичников, клетках Лейдига, надпочечниках.Синтез регулирует ГТГ гипофиза. Биологическая роль тестостерона формирование половых признаков (голос, гортань, скелет, мускулатура, волосы и др.), активирует сперматогенез, стимулирует развитие добавочных половых желёз (простаты), влияет на скорость закрытия эпифизарных зон роста, анаболический эффект – усиливает синтез белка в печени, почках, мышцах, влияет на ЦНС, влияет на фиксацию кальция и фосфора в костях, активация ЦТК и окислительных процессов. Уровень тестостерона в крови после рождения повышается, достигает максимума к 1-3 месяцу, затем до 1 года снижается, повышается в пубертатном периоде. Тестостерон применяют при лечении рака молочных желёз. Эстрогены – при раке простаты. 3)При добавлении АТФ к гомогенату мышечной ткани снизилась скорость гликолиза, концентрация глюкозо-6-фосфата и фруктозо-6-фосфата увеличилась, а концентрация всех других метаболитов гликолиза была при этом ниже. Укажите фермент, активность которого снижается при добавлении АТФ. Напишите реакцию, катализируемую этим ферментом. Билет 37 ФФК ФФК Фруктоза-6-фосфат ---- Ф+ 1,6 ди-фт Билет 38. 1)Виды специфичности ферментов. Основные пути активации и ингибирования ферментативной активности. Специфичность действия ферментовЭто способность фермента взаимодействовать с одним субстратом или группой близких по химическому строению субстратов. Различают: Абсолютная специфичность – фермент превращает только один субстрат. Например: аргиназа расщепляет аргинин на мочевину и орнитин, сахараза расщепляет сахарозу на глюкозу и фруктозу. Относительная специфичность – действие фермента на группу субстратов, имеющих определенный тип связи. Например: протеолитические ферменты (пепсин, трипсин, химотрипсин) гидролизуют пептидную связь в различных белках, но эта связь должна быть образована определенными аминокислотами. Групповая специфичность Фермент действует на отдельные связи определённой группы субстратов. Пепсин расщепляет связи, образованные аминогруппой тирозина или фенилаланина. Трипсин гидролизует пептидные связи, в образовании которых принимают участие СООН-группы лиз и арг. Химотрипсин гидролизует пептидные связи, в образовании которых участвуют СООН-группы ароматических АМК. Эластаза гидролизует пептидные связи, в образовании которых участвуют СООН-группы гли, ала. Активаторы – вещества, ускоряющие ход химической реакции. Ими могут быть ионы металлов, гормоны, коферменты. Рассматривают различные виды активации ферментов: аллостерическая активация, «ограниченный протеолиз». Аллостерическая регуляция характерна только для особой группы ферментов с IV структурой, имеющих регуляторные центры для связывания аллостерических эффекторов. Механизм действия аллостерических активаторов или ингибиторов на фермент заключается в изменении конформации активного центра фермента. «Ограниченный протеолиз» – это активация фермента путем модификации его, т.е. превращение неактивного предшественника в активную форму фермента путем разрыва пептидной связи и отщепление от профермента небольшого фрагмента. Затем следует перестройка пространственной структуры оставшейся части макромалекулы. Этот вид активации характерен для протеолитических ферментов ЖКТ, свертывающей системы крови. Например: пепсиноген  пепсин + пептид-ингибитор пепсин + пептид-ингибитор НСЕ Ингибиторы – вещества, вызывающие частичное (обратимое) или полное (необратимое) торможение реакций, катализируемых ферментами. Ингибиторами могут быть органические (антибиотики, противоопухолевые препараты, метаболиты, гормоны) и неорганические (соли тяжелых металлов, ионы металлов) соединения. В молекуле ингибитора имеются реакционно-способные группы, которые блокируют в активном центре фермента важные для катализа функциональные группы. Рассматривают аллостерическое ингибирование, конкурентное ингибирование. Конкурентное ингибирование возникает, когда ингибитор и субстрат имея похожую химическую структуру конкурируют за активный центр фермента. Классическим примером подобного типа ингибирования является торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой (малонат). СДГ катализирует окисление янтарной кислоты в фумаровую. 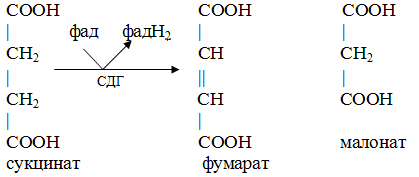 Если в среду добавить малонат (ингибитор), то в результате структурного сходства его с истинным субстратом-сукцинатом он будет взаимодействовать с активным центром фермента, тормозя реакцию окисления сукцината. Образовавшийся фермент-ингибиторный комплекс не распадается с образованием продуктов реакции. Метод конкурентного торможения нашел широкое применение в медицинской практике. Например, применение сульфаниламидных препаратов при лечении некоторых инфекционных заболеваний. Эти препараты имеют структурное сходство с парааминобензойной кислотой, которую бактерии используют для синтеза фолиевой кислоты, являющейся необходимой для их размножения. Торможение синтеза фолиевой кислоты препятствует развитию микроорганизмов. По такому принципу ингибирования действуют противоопухолевые препараты. (метатрексат, фтоурацил). Лечение подагры аллопуринолом основано на ингибировании ксантиноксидазы. 2)Тироксин, его синтез, влияние на обмен веществ. Гипотиреоз и гипертиреоз. Тироксин гормон щитовидной железы, производное тирозина, йодсодержащий гормон. На долю тироксина приходится ¾ всего йода, содержащегося в крови  Этапы синтеза тироксина Окисление йода катализирует фермент – тиреопероксидаза. Щитовидная железа – единственная ткань, способная окислять йод до состояния с более высокой валентностью, что необходимо для синтеза тиреоидных гормонов. Окисленный йод внедряется в тиреоглобулин. Происходит йодирование тирозина в составе тиреоглобулина. Образуются МИТ и ДИТ. 3. Конденсация йодтирозинов 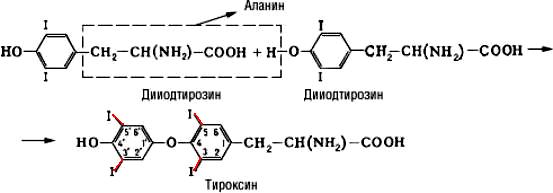 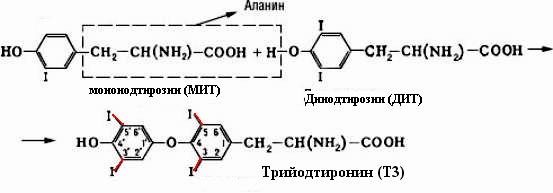 Тиреоглобулин – большой йодированный белок. 70% йодида в этом белке находится в составе неактивных предшественников МИТ и ДИТ. 30% - в виде Т3 и Т4. Тиреоглобулин – форма хранения Т3 и Т4 в коллоиде, обеспечивает поступление этих гормонов в кровь. Синтез тиреоглобулина:контролируется по цепочке: тиролиберин ТТГ синтез тиреоглобулина ограничивается:тиреоидными гормонами, которые подавляют секрецию тиролиберина, протеиназами плазмы, которые расщепляют тиролиберин во время его транспорта кровью. Тироксин выделяется в кровь после гидролиза тиреоглобулина протеазами лизосом фолликулярных клеток щитовидной железы.Тироксинсвязывающий белок преальбумин и альбумин транспортируют Т4.Концентрация тироксина контролируется ТТГ. При недостатке йода могут образоваться моно- и дииодтиронины. Распад Т3 и Т4 происходит в клетках печени. Механизм действия тироксина Тироксин легко проходит через клеточную мембрану. Внутри клетки имеет рецепторы в: ядре, митохондриях, цитоплазме. Действие тироксина Тироксин активирует аденилатциклазу в чувствительных к нему тканях: печень, почки, сердце, жировая ткань, скелетные мышцы. Тироксин действует на все ткани и обмены. Он необходим для нормального роста, развития, дифференцировки тканей. Тироксин вначале стимулирует энергопотребляющую систему (активный мембранный перенос ионов натрия). За этим следует поглощение кислорода тканями, усиление синтеза белка, необходимое для образования митохондрий, а затем наполнение их ферментами. Тироксин – анаболик в малых дозах в детстве. В больших дозах во взрослом организме тироксин – катаболик: стимулирует распад белков, липидов, активирует глюконеогенез. Действие тироксина увеличивает скорость основного обмена, усиливает поглощение кислорода тканями, обеспечивает теплопродукцию, стимулирует синтез белков, ускоряет синтез многих ферментов, повышает активность ферментов, стимулирует сердечную деятельность, стимулирует проведение нервных импульсов, увеличивает всасывание глюкозы, стимулирует трансляцию и транскрипцию, тормозит синтез жира из глюкозы, стимулирует липолиз. Функция щитовидной железы в норме и патологии Щитовидная железа развивается на 3 неделе внутриутробного развития .На 12 неделе железа способна синтезировать гормон.У новорожденных отмечена гиперфункция щитовидной железы.К 5 – 10 годам железа функционирует как у взрослых. При недостатке тироксина возникает: кретинизм в детстве микседема у взрослых. Кретинизм - врождённое нарушение синтеза тироксина. Клинические проявления: остановка роста, изменения кожи, волос, мышц, нарушения психики. Микседема – слизистый отёк. Чаще встречается у женщин. Клинические проявления: нарушение водно-солевого, основного, жирового обменов, патологическое ожирение, выпадение волос и зубов, психические расстройства, вялость, отёчность, снижение интенсивности окислительно-восстановительных процессов. Эндемический зоб обусловлен недостатком йода в питьевой воде, почве и растениях определённых районов земного шара. При заболевании компенсаторно разрастается соединительная ткань.Наблюдается ухудшение интеллектуального, полового, физического развития детей. В регионах тяжёлой зобной эндемии распространён врождённый гипотиреоз, дети с эндемическим неврологическим кретинизмом, глухонемота, резкое снижение интеллекта, спастическая диплегия. В регионах средней степени эндемии – тугоухость, нарушения речи, лёгкие моторные нарушения. Заболевания (состояния), ассоциированные с зобной эндемией Снижение интеллектуального потенциала населения Бесплодие, невынашивание беременности, высокая перинатальная и младенческая смертность ® демографические проблемы Ухудшение состояния здоровья населения: - высокий уровень заболеваемости - высокий уровень хронических заболеваний - акселерация атеросклероза - рост кардиоваскулярных заболеваний Тиреотоксикоз обусловлен повышенным содержанием в крови гормонов щитовидной железы. Тироксин разобщает тканевое дыхание и окислительное фосфорилирование, снижается концентрация АТФ, идёт распад белков, жиров, углеводов. Клинические проявления: худоба, тахикардия, экзофтальм, остеопороз, раздражительность, психические расстройства, нарушение сна, потливость, повышение температуры тела, астения, снижение психической активности. 3. Как осуществляется связывание аммиака в различных тканях человеческого организма и его выделение? Напишите уравнения соответствующих реакций. Билет 38 1)синтез мочевины(печень) 2) образование амидов а/к (ткань мозга) 3)образов аммонийных солей (почки) 4)восстановит аминирование(в регенирирующей печени) Билет 39. Сопряжение обмена липидов и аминокислот. Сопряжение обмена углеводов, липидов и аминокислот на уровне образования ацетил-КоА и на уровне цикла Кребса. Взаимосвязь обменов осуществляется благодаря интегрирующим системам: •нервной, •эндокринной, •сосудистой. Взаимосвязь обеспечивается различными уровнями: •информационный уровень, •структурный уровень, •общее энергетическое обеспечение, •на уровне общих метаболитов, •на уровне Ц.Т.К. Ацетил-КоА образуется •при окислительном декарбоксилировании ПВК, •при β-окислении жирных кислот, •из аминокислот. заимосвязь углеводного и липидного обменов осуществляется через •ацетил-КоА, •ФГА, •НАДФН2 из пентозного цикла идёт на синтез жирных кислот, •ЩУК нужен для работы Ц.Т.К. Жиры сгорают в пламени углеводов. При избытке в пище углеводов возникает ожирение. ФГА и ацетил-КоА–источники глицерина и жирных кислот. При спячке у животных происходит образование углеводов из жиров. Взаимосвязь белкового и жирового обменов на уровне •ПВК, •ацетил-КоА, •кетоновых тел. Из белков осуществляется синтез жира. Взаимосвязь углеводного и белкового обменов на уровне •ПВК, •ЩУК, •ацетил-КоА, •пентоз, •глюкопластичных и кетопластичных аминокислот. Углеродные скелеты АМК вступают в Ц.Т.К. Возможно образование углеводов из белков (ГНГ) и белков из углеводов (из ПВК образуется аланин). Сопряжение на уровне Ц.Т.К. •углеродные скелеты АМК включаются в Ц.Т.К, •все кислоты Ц.Т.К. превращаются в ЩУК (ГНГ), •взаимосвязь Ц.Т.К. с синтезом мочевины через фумарат, асп, СО2, |
