ответы на экзаменационные билеты. Применение изоферментов
 Скачать 6.79 Mb. Скачать 6.79 Mb.
|
|
В синтезе мочевины участвует 6 АМК: орнитин, цитруллин, аргинин, аспарагиновая кислота, аргининосукцинат, N-ацетилглутамат – активатор первой реакции. 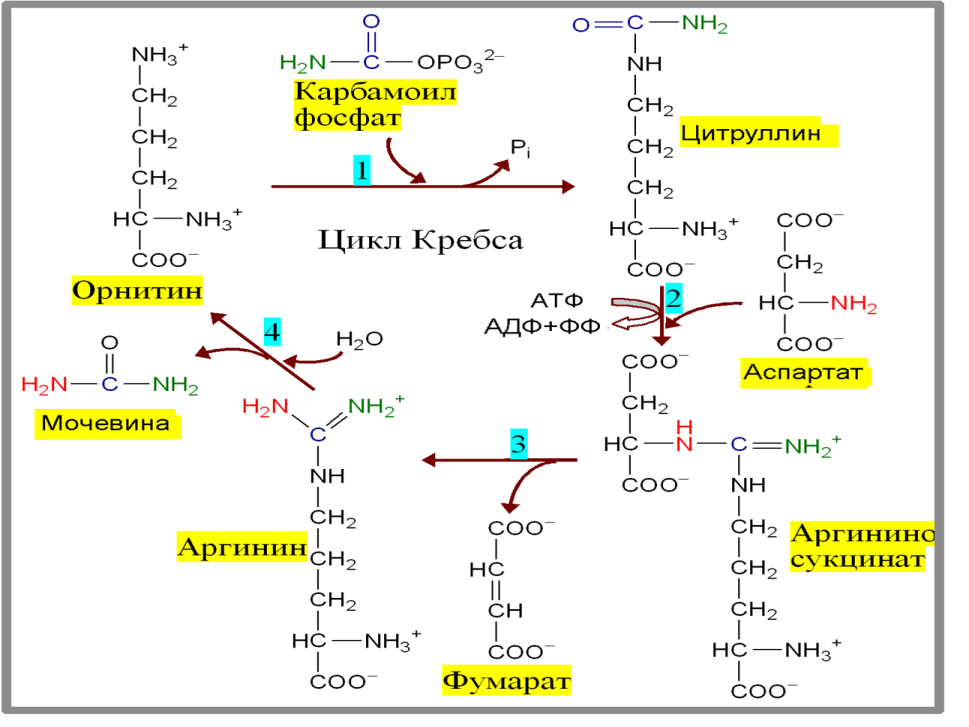 2. Микроэлементы: железо, медь и кобальт. Их роль в организме. Понятие о микроэлементозах. ЖЕЛЕЗО Общее количество железа в организме: у женщин: 3-4 г, у мужчин: 3-5 г, 65 % - железо гемоглобина, 10 % - железо миоглобина, 5 % - железо в составе ферментов, 20 % железа депонировано в печени, костном мозге, селезёнке (связано с ферритином, гемосидерином), 0,1-0,2 % - транспортное железо. На 1 г гемоглобина приходится 3,4 мг железа. Содержание железа в сыворотке крови: 8,9 - 29 мкмоль/л у мужчин, 7-27 мкмоль/л у женщин. Суточная потребность в железе 3-5г так как жизненный цикл эритроцитов 120 дней, то взрослые люди в день нуждаются в 16-20 мг железа для восполнения эритроцитарной массы, женщинам необходимо в 2 раза больше железа, при беременности потребность в железе возрастает на 60%, так как идёт перенос к плоду. Пищевые источники: мясо, печень, яблоки, гранаты, земляника, фасоль, чернослив, бобы, Петрушка Всасывание железа происходит в двенадцатиперстной кишке: Улучшают всасывание железа: соляная кислота, аскорбиновая кислота, животный белок, простые углеводы (лактоза, фруктоза, сорбит), лизин, гистидин, цистеин, медь, кобальт. Подавляют всасывание железа: жир, фосфаты, фитин. Трансферрин: гликопротеин, молекулярная масса 77 кД, синтезируется в печени, транспортирует железо, одна молекула трансферрина связывает 2 атома железа. Атомы железа транспортируются в клетку путём взаимодействия комплекса Fe-трансферрин со специфическими рецепторами мембраны. Транспорт железа в крови Мобилизация железа в кровь из кишечника сопровождается переходом:  В плазме крови железо связано с трансферрином. Другие транспортные белки железа: гаптоглобин, гемопексин, альбумин. Лактоферрин отсутствует в сыворотке крови. Находится лактоферрин в: женском молоке, бронхиальном секрете, цитоплазме нейтрофилов, слюне, слезе. Ферритин – основная форма депонированного железа. Накапливается в : печени, селезёнке, костном мозге. Избыток железа в тканях содержится в виде гемосидерина. Биологическая роль железа: транспорт электронов (цитохромы, железосеропротеины), транспорт и депонирование кислорода (миоглобин, гемоглобин, гемэритрин), участие в формировании активных центров ферментов (оксидазы, гидроксилазы, СОД, каталаза, пероксидаза), транспорт и депонирование железа (трансферрин, ферритин, гемосидерин). Снижена концентрация железа в крови при: железодефицитных анемиях, раке печени, обтурационной желтухе, гемосидерозе внутренних органов, дефиците витамина С, миоме матки, болезнях почек. Повышена концентрация железа в крови при: чрезмерной резорбции железа (частые переливания крови), гемолитической анемии, болезнях печени, хроническом холецистите, свинцовой интоксикации, талассемии, гипопластической и апластической анемиях. Гиперсидероз -избыточное содержание железа в организме У шахтёров и электросварщиков встречается экзогенный гиперсидероз. Эндогенный гиперсидероз возникает в результате разрушения гемоглобина в организме. Причины повышения концентрации железа в сыворотке: усиление деградации эритроцитов при гемолитической анемии, нарушение синтеза гемоглобин(В12-дефицитная анемия), острый гепатит, гемосидероз, гемохроматоз. Низкое содержание железа в крови при: недостаточном поступлении железа в организм, нарушении депонирования железа при беременности, гастроэктомии, снижении кислотности и ахлоргидрии, хронической диарее, стеаторее, неспецифическом колите, потерях крови, язвенной болезни. МЕДЬ В организме взрослого человека содержится 100-150 мг меди. 50% меди находится в мышцах и костях, 10% - в печени. Много меди в: почках, ткани мозга. У новорожденных содержание меди в 10 раз больше, чем у взрослых. Пищевые источники: грибы, печень, орехи, соя, кофе, овощи, морепродукты. Суточная потребность 2-5 мг меди Биологическая роль: составная часть электронпереносящих белков, цитохромоксидазы, стимулятор эритропоэза и образования гема (при дефиците меди нарушается всасывание и мобилизация железа), входит в состав 30 ферментов: СОД, уратоксидазы, тирозиназы, аминооксидазы, оксигеназы, необходима для нормального развития соединительной ткани и кровеносных сосудов (коллаген, эластин), необходима для формирования костной ткани. Всасывается лишь 32% меди из пищи, остальная медь выводится через кишечник, с желчью, мочой. В сыворотке крови медь связана с церулоплазмином – 95%, с альбумином – 5%. Функции церулоплазмина: переносчик ионов меди, основной антиоксидант плазмы, перехватчик , обладает ферментативными свойствами, осуществляет окисление Fe в Fe , увеличивает всасывание железа и способствует включению железа в трансферрин, активатор гемопоэза, белок острой фазы, детоксикационная функция (окисляет диамины и полифенолы), участвует в обмене адреналина, норадреналина, серотонина, повышает пероксидазную активность плазмы и бактерицидные свойства крови. Гиперурикемия наблюдается при: стрессе, беременности, острых и хронических воспалениях, лейкозах, апластических анемиях, мегабластических анемиях, талассемиях, гипер- и гипофункции щитовидной железы, билиарном циррозе, инфаркте миокарда, заболеваниях почек. «Медная лихорадка» возникает при работе с медной пылью, медьсодержащими фунгицидами. Гипоурикемия возникает при: нехватки меди в рационе, недостаточном белковом питании, у новорожденных на искусственном вскармливании, в результате потери или распада церулоплазмина (нефротический синдром, диспротеинемия), болезни Вильсона-Коновалова (гепатоцеребральная дистрофия), синдроме Менкеса, синдроме Марфана. Болезнь Вильсона-Коновалова: эндогенный дискупреоз, сочетание цирроза печени с дистрофическим процессом в головном мозге, причиной является аномальный церулоплазмин, медь выводится с мочой и откладывается в тканях (роговице, мозге, печени). Синдром Менкеса умственная отсталость, отставание в росте, снижение температуры до 35 градусов, аномалии в стенке артерий, нарушение в структуре метафизов длинных костей, снижение концентрации меди в крови, печени, мозге, смерть до 3 лет. В основе заболевания лежит нарушение всасывания меди в кишечнике. Синдром Марфана недостаточность лизилоксидазы, медьдефицитное заболевание, «птичье» лицо, аневризма аорты, страдает эластин, узкий череп, врождённая гипопластическая мезодермальная дистрофия. КОБАЛЬТ поступает в организм с печенью, почками, растительной пищей, витамином В12. Биологическая роль: активатор ферментов (фосфатазы, дыхательных ферментов), стимулятор кроветворения, активатор окислительного фосфорилирования, влияет на синтез компонентов адениловой системы, повышает неспецифическую резистентность организма, избирательно накапливается в железистых органах, лимфоузлах. У новорожденных снижено содержание кобальта. Кобальт – промышленный яд в больших дозах. поражает: органы дыхания, систему кроветворения, вызывает сердечную недостаточность. Дефицит кобальта наблюдается при дефиците витамина В12. 3. Пациенту в лечебных целях назначили диету с низким содержанием углеводов. Концентрация глюкозы в крови нормальная. За счет каких процессов преимущественно поддерживается уровень глюкозы в крови? Билет 20 ГНГ,гликогенолиз Билет 21. 1. Основные пути межуточного обмена аминокислот. Трансаминирование. Клиническое значение определения активности трансаминаз. Трансаминирование АМК реакции межмолекулярного переноса аминогруппы от АМК на а-кетокислоту, обратимые реакции, универсальные реакции для всех организмов, ферменты – трансаминазы, кофермент – ФП. 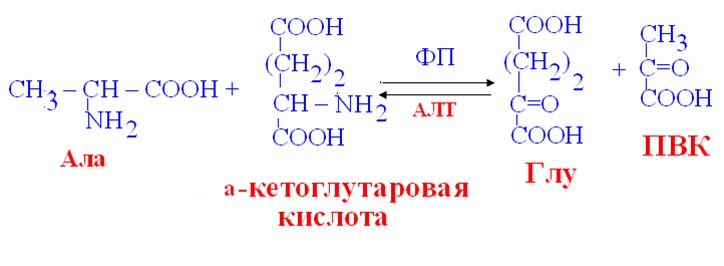 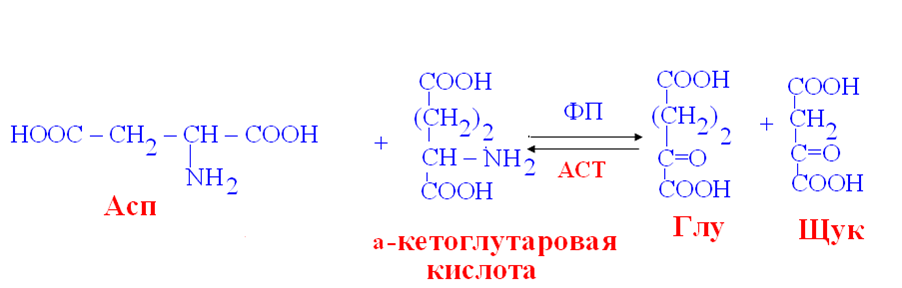 Глюкозо –аланиловый цикл: Работающая мышца выделяет в кровь много лактата и аланина. Аланин образуется из ПВК путём трансаминирования. Из крови аланин поглощается печенью, где в результате трансаминирования вновь превращается в ПВК. ПВК используется для глюконеогенеза. Значение реакций трансаминирования для синтеза и катаболизма АМК: образование кетокислот (ПВК, ЩУК, а-кетоглутарат), потеря аминогруппы определёнными АМК, перераспределение аминного азота, диагностическое значение трансаминаз. Диагностическое значение трансаминаз: у новорожденных из-за высокой проницаемости АСТ в 1,5 раза выше, чем у взрослых здоровых людей, при остром гепатите повышается АЛТ, при инфаркте миокарда через 4-6 часов повышается АСТ, коэффициент де Ритиса АСТ/АЛТ в норме = 1,33± 0,42, при гепатите <1, при инфаркте миокарда повышается. 2. Антиоксидантная система организма. Неферментативные антиоксиданты. Антиоксидантные ферменты. Антиоксидантная система (АОС)-система защиты биополимеров от деструкции. Различают: ферментативное звено АОС, неферментативное звено АОС. Ферменты АО: супероксиддисмутаза, каталаза, пероксидаза, глутатионпероксидаза, глутатионредуктаза, церулоплазмин. Супероксиддисмутаза СОД О 2 + О2 + Н+ → Н2О2 + О2 Ионы меди и цинка – кофакторы СОД, СОД осуществляет удаление образовавшегося в клетке супероксидрадикала, применяется для лечения пневмонии, инфаркта миокарда, ожогов глаз. Каталаза 2Н2О2 → 2Н2О + О2 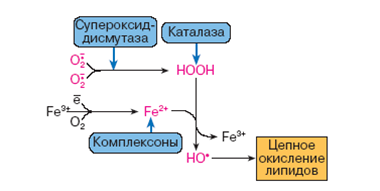 Пероксидазная реакция Н2О2 + АН2 → 2Н2О + А Пероксидаза АН2 - донор протонов (аскорбиновая кислота, фенолы). ГПО: селеносодержащий фермент, состоит из четырёх субъединиц, в активном центре каждой содержится селен, катализирует восстановление гидропероксида или перекиси водорода с помощью глутатиона. ROOH +2GSH → ROH + Н2О+ GSSG Н2О2 +2GSH → 2Н2О+ GSSG В отличие от каталазы более активна при малых концентрациях перекиси водорода Церулоплазмин основной антиоксидант плазмы крови, «перехватчик» супероксидрадикалов, обладает ферментативными свойствами, осуществляет окисление Fe в Fe . Неферментативные антиоксиданты: Антирадикальные ингибиторы отдают подвижный водород свободному радикалу. InH +ROO· → In + ROOH витамины: С, α-токоферол, β-каротин, К, Р, белки: церулоплазмин, лактоферрин, трансферин, альбумин, минеральные вещества: Se, Zn, Co, Fe, Cu, гормоны: эстрогены, тироксин, биогенные амины: серотонин, гистамин, аминокислоты: фен, тир, три, мет, цис, пигмент меланин, мочевая кислота, карнозин, ансерин, глутатион, таурин. Белковые АО плазмы крови: церулоплазмин, Бито (α +β – глобулины плазмы крови) -неспецифические адаптогены, Это имеет прямое отношение к их терапевтическому действию. Применяются при ожогах и радиационных поражениях. Слабыми антиоксидантными свойствами обладают: альбумины, трансферин, лактоферрин. Они связывают ионы железа или меди и тем самым предотвращают образование свободных радикалов из перекиси водорода. Антиоксиданты по локализации делятся на: внутриклеточные: ГПО, СОД, каталаза, не расходуются в процессе разрушения свободных радикалов, встроены в мембраны: α-токоферол, β-каротин, убихинон, расходуются в процессе разрушения свободных радикалов, во внеклеточных жидкостях: флавоноиды, полифенолы. Идентифицируют 3 класса АО: Первичные АО: ГПО, СОД, церулоплазмин, ферритин, трансферин, предупреждают образование новых свободных радикалов. Вторичные АО: витамин Е, С, β-каротин, МК, билирубин, альбумин, удаляют образованные радикалы. Третичные АО: ДНК-репарирующие ферменты, метионинсульфоксидредуктаза, восстанавливают клеточные структуры, повреждённые свободными радикалами. АО могут действовать как прооксиданты: Это зависит от их редокс-потенциала и дозы потребления. Приём β-каротина в дозе 20 мг в день повышает частоту возникновения рака лёгкого у курильщиков. Синтетические АО: Синтетические аналоги витаминов: водорастворимое производное витамина Е – динатриевая соль токоферолфосфата. Ароматические фенолы и полифенолы: дибунол, порбукол. Гетероароматические фенолы. Азотистые гетероциклы. Органическиие кислоты и их производные: мочевая кислота, цистеин, глутатион, фитиновая кислота способны угнетать формирование гидроксилрадикалов. |
