ЛЕЧЕНИЕ. Диета — основной вариант стандартной. Компенсированная неактивная стадия в медикаментозной терапии не нуждается. Больным в большей степени показана вторичная профилактика: предупреждение заражения вирусным гепатитом (одноразовые шприцы, инструментарий и др.); защита от алкоголя (полный отказ от алкоголя и продуктов, содержащих алкоголь); защита от гепатотоксичных лекарств.
Глюкокортикоиды: преднизолон 20—25 мг/сут. — 3—4 нед. до снижения желтухи, активности АлТ, АсТ в два раза. Показания: высокоактивный цирроз
Делагил 0,375—0,5 г/сут. (1,5—2 таб.) от 2 мес. до нескольких лет.
Показания: низкоактивный цирроз, высокоактивный цирроз при противопоказаниях к назначению преднизолона.
Комбинированная терапия: преднизолон 5—15 мг + делагил 0,25—0,5 г.
Препараты, улучшающие метаболизм гепатоцитов легален 0,035 х 3—4 р. в день (форма форте 0,07 х 2 р. в день); карсил 0,03 х 3 р. в день; силибор 0,04—0,08 х 3 р. в день; гепабене 1—2 капе, х 3 р. в день.
Инфузионная терапия: 5% р-р глюкозы 200—500 мл + препараты К, Mg Са, физиологический р-р 500 мл в/в капельно. Показания: прекома, кома, выраженный холестатический синдром.
Трансфузионная терапия: эритроцитарная масса 125—150 мл №3—5, нативная концентрированная плазма, 20% р-р альбумина. Показания: геморрагический синдром, кровотечение из варикозно расширенных вен пищевода, асцит, гипопротеинемия.
55. Первичный билиарный цирроз печени. Этиология. Патогенез. Клиника. Лечение.
ЭТИОЛОГИЯ неизвестна. Определенную роль играют генетические факторы а также недостаточность иммуносупрессорной системы.
ПАТОГЕНЕЗ. ведущую роль в патогенезе играют аутоиммунные клеточные реакции по типу «трансплантат против хозяина». Роль трансплантата играет собственная печень. В качестве ишени иммунной агрессии выступают антигены главного комплекса гистосовместимости (HLA) желчных протоков.
Морфологически выделяют четыре стадии ПБЦ:
• хронический негнойный деструктивный холангит — дуктальная стадия;
• пролиферация желчных протоков и перидуктальный фиброз — дуктулярная стадия;
• фиброз стромы при наличии воспалительной инфильтрации парен-
химы печени;
• цирроз печени.
КЛИНИЧЕСКАЯ КАРТИНА. кожный зуд. Он может сочетаться с иктеричностью
склер и кожи. Вначале зуд носит перемежающийся характер, усиливается по ночам и после теплой ванны. Далее — темно-коричневая пигментация кожи сначала в области лопаток, затем диффузная. Причина ее — отложение меланина.
Ксантомы и ксантелазмыых. Их образование пропорционально зависит от уровня и длительности гиперхолестеринемии.
Гепатомегалия обычно незначительная — 1,5—3 см ниже реберной дуги, плотная, край гладкий, определяется у большинства больных.
Спленомегалия
Из внепеченочных знаков у ряда больных — единичные телеангиоэктазии, «печеночные» ладони.
Начальными проявлениями могут служить такие неспецифические симптомы, как боли в правом подреберье, в ряде случаев с лихорадкой и ускорением СОЭ, боли в суставах, мышцах, а также диспепсический синдром.
Развернутая стадия. Характеризуется быстрым ухудшением состояния больных, нарастанием желтухи, повышением температуры до субфебрильных цифр, истощением из-за нарушения всасывания в кишечнике.
Пигментированная кожа утолщается, грубеет, особенно на подошвах и ладонях, может определяться плотный отек кожи как при склеродермии.
синдром мальабсорбции жирорастворимых витаминов — D, А и К Появляется хрупкость тел позвонков, патологические переломы. Печень становится огромной, занимает все правое и левое подреберье. Увеличиваются размеры селезенки. Появляются признаки портальной гипертензии
Терминальная стадия. Характеризуется прогрессированием печеночно-клеточной недостаточности, которую провоцируют переломы костей, портальная гипертензия, кровотечения. уменьшается и исчезает кожный зуд, появляется асцит, генаторенальный синдром, энцефалопатия.
полигландулярный синдром. Поражаются слезные, слюнные, поджелудочная железа, реже почки. Проявлением полигландулярного синдрома является секреторная недостаточность pancreas, с чем связана стеаторея.
В возникновении полигландулярного синдрома играют роль, с одной
Легочный синдром характеризуется рентгенологической картиной диф-
ЛЕЧЕНИЕ.
При выраженном холестазе значительно уменьшают прием жира до 40—50 г/сут., преимущественно за счет растительного.
Применяют:
1. Жирорастворимые витамины A, D, Е, К назначают для их компенсации парентерально. А — 100000 ME в/м 1 р. в мес; D — 3000 МЕ/сут. per os, при остеомаляции — 100000 ME в/м 1 p. в мес; Е — 30 мг/сут. (10—20 дней); К — 10 мг в/м 1 р. в сутки 5—10 дней, затем 1 инъекция в месяц.
2. Препараты, связывающие желчные кислоты в кишечнике: холестирамин 10—16 г/сут. в течение 1—3 мес; билигнин 15—30 г/сут. в течение 1—3 мес.
3. Иммунодепрессивная, противофиброзная терапия. D-пеницилламин
300—900 мг/сут., поддерживающая доза — 150—250 мг/сут. Назначают вме-
сте с витамином В6.
Циклоспорин-А Хлорабуцил
Глюкокортикоиды неэффективны, только при мучительном кожном
зуде и только коротким курсом преднизолон в дозе 10—15 мг/сут.
Из немедикаментозных методов лечения показана гемосорбция, лимфосорбция, трансплантация печени.
53. Анемии. Классификация. Клиника
Анемии всегда вторичны и являются симптомом какого-то общего заболевания, поэтому строгая нозологическая классификация их невозможна.
Современная классификация анемий строится на патогенетическом и лабораторном принципах с выделением клинико-морфологических форм.
Патогенетическим механизмом анемии может быть любое заболевание, приводящее к уменьшению количества крови в организме либо в результате острой или хронической кровопотери, либо вследствие усиления разрушения крови (гемолиз), либо в результате нарушения образования эритроцитов в костном мозге. С учетом изложенного все анемии можно разделить на четыре группы:
Анемии вследствие кровопотерь (острая, хроническая).
Анемии вследствие нарушения образования эритроцитов и/или гемоглобина (железодефицитные, сидероахрестические, обусловленные нарушением синтеза или утилизации порфиринов, Витамин-B12-дефицитная, фолиеводефицитная, витаминB6-дефицитная, апластическая).
Анемии вследствие повышенного разрушения эритроцитов. Наследственные: эритропатии (сфероцитоз, талассемия, гемоглобинопатии), энзимопатии эритроцитов. Приобретенные (иммунные и неиммунные, пароксизмальная ночная гемоглобинурия).
Анемии полидефицитные вследствие комбинированного нарушения кровообразования, без повышенного кроворазрушения и кровопотери или с наличием их. Дефицит белка, микроэлементов, витаминов А, B1, B2, C, E, PP/ в сочетании с дефицитом витаминов B6, B12, фолиевой кислоты, эндокринной недостаточностью.
Среди симптомов анемии ведущими считаются проявления непосредственно связанные с гипоксией. Степень клинических проявлений зависит от выраженности снижения числа гемоглобина.
При лёгкой степени (уровень гемоглобина 115- 90 г/л), могут наблюдаться общая слабость, повышенная утомляемость, снижение концентрации внимания.
При средней (90-70 г/л) больные жалуются на отдышку, учащённое сердцебиение, частую головную боль, нарушение сна, шум в ушах, снижение аппетита, отсутствие полового влечения. Пациенты отличаются бледностью кожных покровов.
В случае тяжёлой степени (гемоглобин менее 70 г/л) развиваются симптомы сердечной недостаточности.
Если снижение количества красных клеток крови является следствием другого заболевания, тогда возможно сочетанное проявление симптомов, характер которых связан с этиологией основной болезни. Опасность анемии состоит в том, что начальные этапы вообще могут протекать бессимптомно или признаки очень слабо выражены.
Каждому человеку необходимо помнить следующие физиологические признаки, по которым можно предположить наличие анемии:
изменение пластинок ногтей: характерна ломкость, тонкость, расслоение, исчерченность;.
сухость слизистых и кожных покровов, наличие в уголках рта болезненных трещин;
медленный рост волос или их выпадение;
нарушение вкуса и обоняния: употребление в пищу несъедобных (мел, песок, уголь, глина, сера) или сырых (крупы, тесто, мясо) продуктов;
постоянное незначительное увеличение температуры тела (в пределах 37-37,5 градусов);
бледность кожи или наоборот её желтушный оттенок.
54. Железодеф. анемии
Железодефицитная анемия – это патологическое состояние, характеризующееся снижением количества гемоглобина и эритроцитов из-за недостатка железа в организме, а также трофическими расстройствами (нарушениями структуры тканей).
Симптомы анемии железодефицитной
Все симптомы железодефицитной анемии объединены в два синдрома (устойчивая совокупность симптомов, возникающих по единой причине).
Анемический синдром:
общая слабость;
снижение работоспособности;
головокружение;
обморочные состояния (помрачение сознания);
шум в ушах;
мелькание « мушек» перед глазами;
одышка (учащенное дыхание) и ускоренное сердцебиение при незначительной физической нагрузке.
Сидеропенический синдром.
Поражение эпителия (тканей, покрывающих все тело и выстилающих полые органы) любой локализации.
Поражение эпителия желудочно-кишечного тракта:
трещины в углах рта;
затруднения при глотании сухой и твердой пищи;
жжение и боли в языке, возникающие спонтанно или после еды, сглаженность сосочков языка (сидеропенический глоссит);
зубы теряют блеск, быстро разрушаются, несмотря на самый тщательный уход за ними;
непостоянные тупые ноющие боли в эпигастральной области (в середине верхней части живота).
Поражение кожи и ее придатков (волосы, ногти):
сухая кожа с множественными микротрещинами (особенно кисти рук, передняя поверхность голеней);
ногти — повышается ломкость ногтей, поперечная исчерченность, ложкообразные вдавления (койлонихии – « корявые ногти»);
волосы — выпадение волос, сухость и ломкость волос, преждевременная седина.
Извращение вкуса (в виде желания есть мел, известь, уголь, глину, сырую крупу) и извращение обоняния (пристрастие к необычным запахам – ацетона, керосина, красок, фекалий).
Нарушение деятельности сфинктеров (круговых мышц, замыкающих какое-либо отверствие: заброс пищи из желудка в пищевод, беталепсия (недержание мочи и кала при кашле, смехе, натуживании, поднимании ноги на ступеньку)).
Формы
С учетом уровня гемоглобина (особого вещества эритроцитов (красных клеток крови), переносящего кислород) железодефицитная анемия, как и другие формы анемий, может быть тяжелой, средней и легкой степени.
Легкая степень: концентрация гемоглобина 90-110 г/л (то есть граммов гемоглобина на 1 литр крови).
Средняя степень: содержание гемоглобина 70-90 г/л.
Тяжелая степень: уровень гемоглобина менее 70 г/л.
В норме уровень гемоглобина в крови:
у женщин – 120-140 г/л;
у мужчин – 130-160 г/л;
у новорожденных – 145-225 г/л;
у детей 1 мес. – 100-180 г/л;
у детей 2 мес. – 2 лет. – 90-140 г/л;
у детей 2-12 лет – 110-150 г/л;
у детей 13-16 лет – 115-155 г/л.
Вместе с тем клинические признаки тяжести анемии (симптомы гипоксического характера (недостатка кислорода)) не всегда соответствуют степени тяжести анемии по лабораторным критериям. Поэтому предложена классификация анемий по степени выраженности клинических симптомов.
По клиническим проявлениям выделяют пять степеней тяжести анемий.
Легкая степень анемии — без клинических проявлений.
Умеренная степень анемии:
быстрая утомляемость;
слабость;
недомогание;
пониженная концентрация внимания;
бледность видимых слизистых и ногтевых лож.
Тяжелая степень анемии:
одышка при умеренной или незначительной нагрузке;
головная боль, головокружение;
учащенное сердцебиение (аритмия);
шум в ушах;
нарушение сна (например, затрудненное засыпание, частые пробуждения ночью);
снижение аппетита, изменения пищевых пристрастий в виде отказа от ранее любимой еды;
извращение аппетита (поедание мела, грязи, красок и др.) и обоняния (нравятся резкие запахи бензина, красок, лаков);
бледность видимых слизистых и ногтевых лож, кожных покровов;
повышенная чувствительность к холоду — пациент постоянно мерзнет;
развиваются воспаления языка (глосситы), губ (хейлит);
истонченные, исчерченные, ломкие ногти;
частые простудные заболевания.
Анемическая прекома:
одышка в состоянии покоя без каких-либо нагрузок;
прогрессирующая слабость, сонливость;
психические расстройства (галлюцинации, депрессивный синдром);
кожа и слизистые оболочки резко бледные с синюшным оттенком;
тахикардия (учащенное сердцебиение).
Анемическая кома:
низкое артериальное (кровяное) давление;
рвота;
тахипноэ (учащенное поверхностное дыхание);
потеря сознания;
непроизвольное мочеиспускание;
отсутствие рефлексов на конечностях (то есть реакции в ответ на раздражение: например, перестает определяться разгибание конечности при ударе молоточком в зонах близкого расположения нервов под кожей или сгибание пальцев ног при проведении пальцем по подошве).
Причины
Низкий запас железа при рождении:
недоношенные дети;
дети, рожденные от матерей с железодефицитной анемией;
дети из многоплодной беременности (одновременное вынашивание двух и более плодов);
дети от матерей с кровотечением в последние месяцы беременности или во время родов.
Алиментарные факторы (нарушение поступления железа с пищей и всасывания железа в кишечнике).
Вегетарианство (употребление только растительной пищи).
При однообразной диете с повышенным содержанием жиров и углеводов.
Наследственные нарушения транспорта железа (снижение активности ферментов, переносящих железо из полости кишечника в кровь).
Нарушения всасывания железа вследствие патологии желудочно-кишечного тракта:
удаление желудка или его части;
рак желудка;
удаление части кишечника;
хронический панкреатит (воспаление поджелудочной железы);
муковисцидоз (наследственное заболевание, которое характеризуется поражением всех органов, вырабатывающих слизь (печень, поджелудочная железа, железы слизистой кишечника, дыхательная система, потовые и слюнные железы);
целиакия (генетическая болезнь, при которой белок глютен вызывает повреждение слизистой тонкого кишечника, и нарушается процесс всасывания);
энтеропатии (невоспалительные хронические заболевания кишечника, вызванные недостатком ферментов в кишечнике или дефектами строения кишечной стенки) и др.
Хронические потери крови различного генеза (происхождения):
во внешнюю среду, наиболее часто – кровотечения из желудочно-кишечного тракта (из дивертикула Меккеля (врожденная патология тонкой кишки в виде слепого выпячивания стенки кишечника), при язве и эрозии (дефект слизистой оболочки) желудка и 12-перстной кишки, варикозном расширении вен слизистой желудка и кишечника). Повторные, даже необильные, кровопотери постепенно приводят к анемии вследствие истощения в организме запасов железа, необходимого для образования гемоглобина (особого вещества эритроцитов (красных клеток крови), переносящего кислород). Суточное поступление в организм железа с пищей невелико, примерно 11-28 мг, причем всасывается из него около 1-3 мг, то есть приблизительно столько же, сколько содержится в 15 мл крови. Поэтому ежедневная потеря этого и даже меньшего количества крови неминуемо приводит к сокращению запасов железа в организме и возникновению железодефицитной анемии;
во внутреннюю среду без реутилизации (повторного использования) железа — изолированный гемосидероз легких (хроническое заболевание легких, проявляющееся повторными кровоизлияниями в альвеолы – пузырьки с воздухом).
Повышенное потребление железа — при опухолевом росте любой локализации.
Диагностика
Анализ анамнеза заболевания и жалоб (когда (как давно) появились общая слабость, одышка, головокружение, колющие боли в грудной клетке и др.; с чем пациент связывает возникновение этих симптомов).
Анализ анамнеза жизни (есть ли у пациента какие-либо хронические заболевания, отмечаются ли наследственные (передаются от родителей к детям) заболевания, имеет ли пациент вредные привычки, принимал ли длительно какие-нибудь препараты, выявлялись ли у него опухоли, контактировал ли он с токсическими (отравляющими) веществами).
Общий осмотр (определяется цвет кожных покровов (возможна бледность); пульс может быть учащенным, артериальное (кровяное) давление — сниженным).
Анализ крови. Может определяться снижение количества эритроцитов (красных клеток крови, норма 4,0-5,5х109/литр), уменьшение уровня гемоглобина (особого соединения внутри эритроцитов, переносящего кислород, норма 130-160 г/л). Цветной показатель (отношение уровня гемоглобина, умноженного на 3, к первым трем цифрам количества эритроцитов) снижается (в норме этот показатель 0,86-1,05).
Биохимический анализ крови:
снижение уровня сывороточного железа (сыворотка – это жидкая часть крови);
повышение уровня ОЖСС (общая железосвязывающая способность сыворотки);
снижение уровня насыщения трансферрина (белка крови, основного переносчика железа) железом;
снижение уровня ферритина (сложный белок, в котором запасается железо).
Исследование костного мозга, полученного при помощи пункции (прокалывания с извлечением внутреннего содержимого) кости, чаще всего грудины (центральной кости передней поверхности грудной клетки, к которой крепятся ребра), выполняется в некоторых случаях для оценки кроветворения и выявления характера анемии.
Трепанобиопсия (исследование костного мозга в его соотношении с окружающими тканями) выполняется при взятии на исследование столбика костного мозга с костью и надкостницей, обычно из крыла подвздошной кости (область таза человека, расположенная наиболее близко к коже), с помощью специального приборы – трепана. Наиболее точно характеризует состояние костного мозга.
Электрокардиография (ЭКГ). Определяется увеличение частоты сердечных сокращений, нарушение питания мышцы сердца, реже – нарушения ритма сердца.
Лечение анемии железодефицитной
Устранение причин, вызывающих развитие анемии, является очень важным фактором при лечении.
Режим дня: активный образ жизни, ежедневные прогулки на свежем воздухе.
Диетотерапия:
употреблять больше пищи с высоким содержанием белка (например: творог, мясо, рыба, яичный белок, печень, почки и др.);
ограничить употребление жиров (жирных сортов мяса, птицы, рыбы, сала, жирных колбас), отдавать предпочтение легкоусвояемым жирам (сливочное, подсолнечное, соевое, оливковое масло);
ограничить употребление молока (не более 0,5 л в сутки) и крепкого чая, так как они препятствуют всасыванию железа в кишечнике;
количество углеводов не ограничивается, рекомендуются блюда из различных круп (например: каши, пудинги), сахара, меда, варенья, бобовых, изделий из муки, овощей, фруктов, ягод;
употребление повышенного количества витаминов группы В и С: витаминами группы В богаты дрожжи, печень, почки, бобовые, яичные желтки, мясо, рыба, молоко, творог, отруби (рисовые, пшеничные); витамина С (аскорбиновой кислоты) много в салате, зеленом луке, капусте, зернах сои;
употреблять достаточное количество железосодержащих продуктов (например: свиная и говяжья печень, говяжий язык, мясо кролика и индейки, крупы – гречневая, овсяная, ячневая, пшено, черника, персики; икра рыб, особенно осетровых).
Обязательное назначение препаратов железа: в первые три месяца лечения анемии — в лечебных дозах, в последующем – в профилактических. Препараты железа назначают внутрь между приемами пищи, запивая свежими фруктовыми соками или водой, нельзя запивать молоком.
В тяжелых случаях анемии назначают препараты железа в инъекциях внутримышечных или внутривенных, переливание эритроцитарной массы (эритроцитов донора).
Осложнения и последствия
Прогноз при своевременной диагностике и адекватном лечении благоприятный.
Осложнения.
Нарушение психоэмоционального состояния:
снижается память;
нарушается концентрация внимания;
появляется раздражительность.
Анемическая кома (утрата сознания с отсутствием реакции на внешние раздражители вследствие недостаточного поступления кислорода к головному мозгу в результате значительного или быстро развившегося снижения количества эритроцитов (красных клеток крови)).
Ухудшение состояния внутренних органов, особенно при наличии хронических заболеваний (например, сердца, почек и др.).
Профилактика анемии железодефицитной
Первичная профилактика (то есть до возникновения заболевания).
Прием препаратов железа особым группам людей с наиболее высоким риском развития железодефицитной анемии — донорам.
Сбалансированное и рациональное питание (употребление в пищу продуктов с высоким содержанием клетчатки (овощи, фрукты, зелень), отказ от консервированной, жареной, острой, горячей пищи), употребление в пищу продуктов животного происхождения (яиц, икры, мяса, рыбы), а при вегетарианстве (отказе от использования в пищу продуктов животного происхождения) – применение поливитаминных комплексов. Частое дробное питание (5-6 раз в день небольшими порциями).
Профилактика хронических заболеваний, вызывающих дефицит железа (например, профилактика заболеваний желудка и кишечника – регулярное питание, отказ от острой и жирной пищи, употребление тщательно вымытых овощей и фруктов и др.).
Вторичная профилактика (то есть после развития заболевания) заключается в регулярных профилактических осмотрах населения с целью наиболее раннего выявления у них анемии.
55. В12 анемии
В12-дефицитная анемия — это заболевание, обусловленное нарушением кроветворения (образования клеток крови) вследствие дефицита в организме витамина В12.
Анемия может развиться через 4-5 месяцев полного прекращения поступления витамина В12 в организм.
Симптомы В12-дефицитной анемии
Все симптомы В12 -дефицитной анемии объединены в три синдрома (устойчивая совокупность симптомов, объединенных единым развитием).
Анемический (то есть со стороны системы крови):
слабость, снижение работоспособности;
головокружение;
обморочные состояния;
шум в ушах;
мелькание « мушек» перед глазами;
одышка (учащенное дыхание) и сердцебиение при незначительной физической нагрузке;
колющие боли в грудной клетке.
Гастроэнтерологический (то есть со стороны системы органов пищеварения) синдром:
снижение массы тела;
тошнота и рвота;
запоры;
снижение аппетита;
ощущение жжения в языке – проявление гюнтеровского глоссита (изменения структуры языка вследствие дефицита витамина В12). Язык становится ярко-красным или малиновым, « лакированным» (со сглаженной поверхностью).
Неврологический синдром (то есть со стороны нервной системы). Для В12 -дефицита характерно поражение периферической нервной системы (то есть нервы, соединяющие головной и спинной мозг со всеми органами).
Онемение и неприятные ощущения в конечностях.
Скованность ног.
Неустойчивость походки.
Мышечная слабость.
При длительном дефиците витамина В12 может развиваться поражение спинного и головного мозга, имеющее свои симптомы:
утрачивается вибрационная чувствительность (то есть чувствительность к воздействиям колебаний на кожу) в ногах;
появляются эпизоды резкого сокращения мышц (судороги).
Некоторые больные становятся раздражительными, настроение снижается, может нарушаться восприятие желтого и синего цветов за счет повреждения головного мозга.
Формы
По степени тяжести, в зависимости от содержания гемоглобина (особого вещества, содержащегося в эритроцитах, переносящего кислород) в крови, различают:
легкую анемию (гемоглобин от 90 до 110 г/л, то есть граммов гемоглобина на 1 л крови);
анемию средней тяжести (гемоглобин от 90 до 70 г/л);
тяжелую анемию (гемоглобин менее 70 г/л).
В норме у мужчин содержание гемоглобина в крови 130/160 г/л. Ситуации, при которых гемоглобин крови составляет от 110 до 130 г/л, являются промежуточными между нормой и анемией.
Причины
Причины В12 -дефицитной анемии.
Алиментарная недостаточность – недостаточное поступление с пищей (голодание, строгое вегетарианство (то есть отсутствие в питании не только мяса, но также молочных продуктов и яиц), грудное вскармливание матерью-вегетарианкой).
Нарушение всасывания витамина В12, поступившего с пищей, в кровь.
Недостаточное количество внутреннего фактора Касла (комплексное соединение, выделяемое клетками слизистой оболочки желудка и соединяющееся с витамином В12, поступившим в желудок с пищей. Витамин В12 всасывается в тонком кишечнике только в соединении с внутренним фактором Касла). Причины недостаточного количества внутреннего фактора Касла:
образование антител (белков, связывающихся с собственными клетками организма, что приводит к их гибели) к клеткам внутренней оболочки желудка, вырабатывающим внутренний фактор Касла;
структурные изменения желудка (хирургическое удаление желудка или его части, гастрит (воспаление желудка, возникшее из-за воздействия микроорганизмов, некоторых лекарств, алкоголя));
врожденное отсутствие или нарушение структуры внутреннего фактора Касла.
Структурные изменения тонкого кишечника (хирургическое удаление части тонкой кишки, повреждение внутренней оболочки тонкой кишки различными микроорганизмами, злокачественные новообразования (опухоли, растущие путем повреждения окружающих тканей), дисбиоз – нарушение нормального соотношения между микроорганизмами кишечника).
Поглощение витамина В12 микроорганизмами (бактериями кишечника или глистами – внедрившимися в организм человека круглыми или плоскими червями).
Неполноценное использование витамина В12 (нарушение функций печени, и почек, и др.).
Повышенное потребление витамина В12 – любая злокачественная опухоль (опухоль, растущая с повреждением окружающих тканей), повышение выработки гормонов (биологически активных веществ, вырабатываемых железами организма) щитовидной железы, грудной возраст, снижение количества эритроцитов (красных клеток крови) за счет их повышенного разрушения.
Повышенное выделение витамина В12 – недостаточное связывание с белками крови, заболевания печени и почек.
Факторы риска В12 -дефицитной анемии:
пожилой возраст,
заболевания желудка.
Диагностика
Анализ анамнеза заболевания и жалоб (когда (как давно) появились общая слабость, нарушения походки, снижение аппетита, тошнота, одышка и другие симптомы, с чем пациент связывает их возникновение).
Анализ анамнеза жизни (есть ли у пациента какие-либо хронические заболевания, были ли в семье случаи глистной инвазии (внедрение в организм человека круглых или плоских червей), отмечаются ли наследственные заболевания (например, гастрит – воспаление слизистой оболочки желудка и др.), имеет ли пациент вредные привычки, принимал ли длительно какие-нибудь препараты, выявлялись ли у него опухоли, контактировал ли он с токсическими (отравляющими) веществами).
Физикальный осмотр. Определяется цвет кожных покровов (для В12 дефицитной анемии характерна бледность кожных покровов), осматривается язык (характерен малиновый язык с гладкой поверхностью), пульс может быть учащенным, артериальное давление — сниженным.
Анализ крови. При В12 дефицитной анемии определяется снижение количества эритроцитов (красных клеток крови) и ретикулоцитов (клеток-предшественников эритроцитов) с увеличением их размера, уменьшение уровня гемоглобина (особого соединения внутри эритроцитов, переносящего кислород), снижение количества тромбоцитов (кровяных пластинок) с увеличением их размера. Цветной показатель (отношение уровня гемоглобина, умноженного на 3, к первым трем цифрам количества эритроцитов) изменяется в сторону увеличения: в норме этот показатель 0,86-1,05, при В12 -дефицитной анемии – выше, чем 1,05.
Анализ мочи. Проводится для выявления сопутствующих заболеваний.
Биохимический анализ крови. Определяется уровень холестерина (жироподобное вещество), глюкозы (простого углевода), креатинина (продукт распада белка), мочевой кислоты (продукт распада веществ из ядра клетки), электролитов (калий, натрий, кальций) для выявления сопутствующего поражения органов. Для В12-дефицитной анемии характерно повышение уровня билирубина (вещества, появляющегося в крови при распаде эритроцитов), лактат-дегидрогеназы (особого фермента (вещества, ускоряющего химические реакции) печени), железа (в связи с уменьшением его использования для образования новых эритроцитов).
Содержание в крови витамина В12 (при данном заболевании оно снижается).
Исследование костного мозга, полученного при помощи пункции (прокалывания с извлечением внутреннего содержимого) кости, чаще всего грудины (центральной кости передней поверхности грудной клетки, к которой крепятся ребра). В костном мозге при В12-дефицитной анемии определяются усиленное образование эритроцитов и мегалобластический тип кроветворения – то есть крупные эритроциты с остатками ядер (в норме у созревших эритроцитов ядер нет).
Электрокардиография (ЭКГ). Определяется увеличение частоты сердечных сокращений, нарушение питания мышцы сердца, реже – нарушения ритма сердца.
Возможна также консультация терапевта.
Лечение В12-дефицитной анемии
Воздействие на причину В12 -дефицитной анемии – избавление от глистов (внедрившихся в организм плоских или круглых червей), удаление опухоли, нормализация питания.
Восполнение дефицита витамина В12. Введение витамина В12 внутримышечно в дозе 200-500 мкг в сутки. При достижении стабильного улучшения следует вводить (в виде внутримышечных инъекций) поддерживающие дозы – 100-200 мкг 1 раз в месяц в течение нескольких лет. При повреждении нервной системы дозу витамина В12 повышают до 1000 мкг в сутки на 3 дня, затем действует обычная схема.
Быстрое восполнение количества эритроцитов (красных клеток крови) – переливание эритроцитарной массы (эритроцитов, выделенных из донорской крови) по жизненным показаниям (то есть при угрозе для жизни пациента). Угрозой для жизни пациенту с В12-дефицитной анемией являются два состояния:
анемическая кома (утрата сознания с отсутствием реакции на внешние раздражители вследствие недостаточного поступления кислорода к головному мозгу в результате значительного или быстро развившегося снижения количества эритроцитов);
тяжелая степень анемии (уровень гемоглобина крови ниже 70 г/л, то есть граммов гемоглобина на 1 л крови).
Профилактика В12-дефицитной анемии
Употребление в пищу продуктов, богатых витамином В12 (мясо, печень, яйца, молочные продукты).
Своевременное лечение заболеваний, приводящих к развитию дефицита витамина В12 (например, глистных инвазий – внедрения в организм человека глистов (плоских и круглых червей)).
Назначение поддерживающей дозы витамина В12 после операций, сопровождающихся удалением части желудка или кишечника.
56. Хронический миелолейкоз
Хронический миелоидный лейкоз (ХМЛ, хронический миелолейкоз) — форма лейкоза, которая характеризуется ускоренной и нерегулируемой пролиферацией преимущественно миелоидных клеток в костном мозге с их накоплением вкрови. ХМЛ — гемопоэтическое клональное заболевание, основным проявлением которого является пролиферация зрелыхгранулоцитов (нейтрофилов, эозинофилов и базофилов) и их предшественников. Это миелопролиферативное заболевание ассоциировано с характерной хромосомной транслокацией (филадельфийской хромосомой). В настоящее время основным способом лечения хронического миелолейкоза является таргетная (целевая) терапия ингибиторамитирозинкиназ, такими как иматиниб, нилотиниб, дазатиниб и другие, значительно улучшившая показатели выживаемости.
аболевание часто протекает бессимптомно, выявляясь при рутинном клиническом анализе крови. В этом случае ХМЛ следует дифференцировать от лейкемоидной реакции, при которой мазок крови может иметь схожую картину. ХМЛ может проявляться недомоганием, субфебрильной лихорадкой, подагрой, повышенной восприимчивостью к инфекциям, анемией, тромбоцитопенией с кровоточивостью (хотя также может наблюдаться повышенное содержание тромбоцитов). Также отмечается спленомегалия.[2][4]
В течении ХМЛ выделяют три фазы на основании клинических характеристик и лабораторных данных. В отсутствие лечения ХМЛ обычно начинается с хронической фазы, в течение нескольких лет прогрессирует в фазу акселерации и, в конечном счёте, завершается бластным кризом. Бластный криз — терминальная фаза ХМЛ, клинически подобная острому лейкозу. Вовремя начатое медикаментозное лечение, как правило, может остановить прогрессирование болезни по этому пути. Одним из факторов прогрессии от хронической фазы к бластному кризу является приобретение новых хромосомных аномалий (в дополнение к филадельфийской хромосоме)[2]. Некоторые пациенты к моменту постановки диагноза могут находиться уже в фазе акселерации или бластного криза[4].
Хроническая фаза[править | править вики-текст]
Около 85 % пациентов с ХМЛ к моменту постановки диагноза находятся в хронической фазе. В течение этой фазы клинические проявления обычно отсутствуют или имеются «лёгкие» симптомы, такие как недомогание или чувство переполнения живота. Продолжительность хронической фазы различна и зависит от того, насколько рано было диагностировано заболевание, а также от проведённого лечения. В конечном счёте, при отсутствии эффективного лечения, заболевание переходит в фазу акселерации[4].
Фаза акселерации[править | править вики-текст]
Диагностические критерии перехода в фазу акселерации могут различаться: наиболее широко используются критерии, установленные исследователями онкологического центра Андерсона при Техасском университете[5], Сокалом с соавторами[6], а также Всемирной организацией здравоохранения[7][8]. Критерии ВОЗ, вероятно, наиболее широко распространены, и отличают фазу акселлерации по следующим признакам:
10—19 % миелобластов в крови или костном мозге;
> 20 % базофилов в крови или костном мозге;
< 100 000 тромбоцитов в микролитре крови, вне связи с терапией;
> 1 000 000 тромбоцитов в микролитре крови, вне зависимости от терапии;
цитогенетическая эволюция с развитием новых аномалий в дополнение к филадельфийской хромосоме;
прогрессирование спленомегалии или увеличение числа лейкоцитов, вне зависимости от терапии.
Фаза акселерации предполагается при наличии любого из указанных критериев. Фаза акселерации указывает на прогрессию заболевания и приближение бластного криза[7]
Бластный криз[править | править вики-текст]
Бластный криз — финальная стадия развития ХМЛ, протекающая, подобно острому лейкозу, с быстрой прогрессией и непродолжительной выживаемостью[4]. Бластный криз диагностируется на основе одного из следующих признаков у пациента с ХМЛ[9]:
>20 % миелобластов или лимфобластов в крови или костном мозге;
крупные группы бластов в костном мозге при биопсии;
развитие хлоромы (солидного фокуса лейкемии вне костного мозга).
Предположение о ХМЛ часто делается на основании общего анализа крови, демонстрирующего повышение количествагранулоцитов всех типов, включая зрелые миелоидные клетки. Количество базофилов и эозинофилов повышено практически всегда, что позволяет дифференцировать ХМЛ и лейкемоидную реакцию. При диагностике ХМЛ часто проводится биопсия костного мозга, однако одной лишь морфологической оценки костного мозга недостаточно для постановки диагноза ХМЛ[3][4].
В конечном счёте, ХМЛ диагностируется посредством выявления филадельфийской хромосомы в образцах костного мозга. Эта характерная хромосомная аномалия может быть выявлена в результате цитогенетического анализа, при помощи флюоресцентной гибридизации in situ или детекции гена BCR-ABL методом ПЦР[4].
Существуют разногласия в отношении так называемого Ph-негативного ХМЛ, или случаев предполагаемого ХМЛ, при котором филадельфийская хромосома не обнаруживается. У многих таких пациентов в действительности имеют место комплексные хромосомные аномалии, маскирующие транслокацию t(9;22), либо эта транслокация обнаруживается только при флюоресцентной гибридизации или ПЦР с обратной транскрипцией, но не при рутинном кариотипировании[10]. Для небольшой подгруппы пациентов с отсутствием молекулярных свидетельств присутствия гена BCR-ABL может быть поставлен диагноз недифференцированное миелодиспластическое/миелопролиферативное расстройство, так как оно, как правило, отличается от ХМЛ по клиническому течению[7].
Основные симптомы ХМЛ
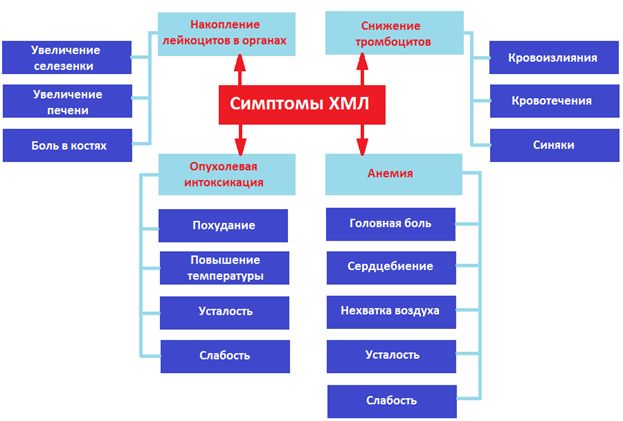
Лечение
Необходимо знать, что сегодня существует только три метода лечения, которые способны коренным образом улучшить прогноз при ХМЛ: трансплантация костного мозга от совместимого донора, терапия ИТК и терапия интерфероном-альфа. Никакая химиотерапия, ни, тем более, никакие народные средства, не способны не только излечить заболевание, но и даже сколько-нибудь существенно удлинить жизнь пациента.
Цель современной терапии ХМЛ – максимальное подавление Ph – положительного опухолевого клона и восстановление нормального кроветворения. Достижение полного цитогенетического ответа (ПЦО) и большого молекулярного ответа (БМО) – это ранние благоприятные прогностические признаки длительной выживаемости без прогрессирования при условии продолжения постоянной терапии. Лечение может проводиться в амбулаторных условиях. В настоящее время основным и наиболее эффективным методом лечения ХМЛ является целенаправленная (таргетная) терапия ингибиторами тирозинкиназ (ИТК), которая у большинства пациентов позволяет добиться хорошего и продолжительного контроля заболевания. В Российской Федерации в настоящее время зарегистрированы три лекарственных препарата из группы ИТК для лечения ХМЛ: иматиниб, дазатиниб и нилотиниб. Лечение препаратами ИТК коренным образом изменили прогноз этого ранее фетального заболевания, улучшив общую выживаемость в несколько раз и сделав возможной перспективу максимального подавления лейкозного клона.
В результате длительных поисков способов блокирования злокачественных клеток при ХМЛ был разработан первыйингибитор тирозинкиназ– иматиниба мезилат.
57. Хронический лимфолейкоз
Хронический лимфолейкоз — это злокачественная (то есть растущая с повреждением окружающих тканей) опухоль системы крови, состоящая из лимфоцитов (особого вида лейкоцитов – белых клеток крови).
Это вариант хронического лейкоза (опухоли, состоящей из зрелых или практически зрелых клеток крови).
Симптомы хронического лимфолейкоза
Все симптомы хронического лимфолейкоза объединены в несколько синдромов (устойчивая совокупность симптомов, объединенных единым развитием).
Гиперпластический, или пролиферативный (связанный с ростом опухоли):
увеличение лимфоузлов;
боль и тяжесть в левой верхней части живота (увеличение селезенки);
отеки шеи, лица, рук — появляются при сдавлении увеличенными внутригрудными лимфоузлами верхней полой вены (сосуд, приносящий кровь к сердцу от верхней половины тела).
Интоксикационный (отравление организма продуктами распада опухоли):
выраженная общая слабость;
утомляемость;
снижение массы тела;
потливость;
повышение температуры тела.
Анемический:
слабость, снижение работоспособности;
головокружение;
обморочные состояния;
шум в ушах, мелькание « мушек» перед глазами;
одышка и сердцебиение при незначительной физической нагрузке;
колющие боли в грудной клетке.
Геморрагический (наличие кровоизлияний и кровотечений). При хроническом лимфолейкозе обычно слабо выражен. Возможны:
подкожные и подслизистые (например, в полости рта) кровоизлияния;
десневые, носовые, маточные и другие кровотечения.
Иммунодефицитный(синдром инфекционных осложнений). Присоединение любых инфекций связано с недостаточным образованием нормальных лейкоцитов – белых клеток крови, обеспечивающих защиту от микроорганизмов. При хроническои лимфолейкозе чаще всего присоединяются инфекции, вызванные вирусами.
Формы
Клинико-лабораторные варианты (формы) хронического лимфолейкоза.
Доброкачественная форма (медленное увеличение лимфоузлов и селезенки и позднее развитие осложнений) – продолжительность жизни больных – 30-40 лет.
Прогрессирующая (классическая) форма, при которой лейкоцитоз (повышенное содержание в крови лейкоцитов – белых клеток крови) и размеры лимфоидных органов (лимфоузлов и селезенки) увеличиваются значительно быстрее, раньше развиваются осложнения. Средняя продолжительность жизни – не более 6-8 лет.
Опухолевая – протекающая с преимущественным увеличением лимфоузлов.
Спленомегалическая – протекающая с преимущественным увеличением селезенки.
Костномозговая – протекающая с поражением костного мозга.
Хронический лимфолейкоз, осложненный цитолитическим синдромом (массовой гибелью опухолевых клеток с развитием отравления организма),
Хронический лимфолейкоз, протекающий с парапротеинемией (выделением клетками опухоли белков, отсутствующих в норме).
Волосатоклеточный лейкоз – клетки опухоли имеют особые выросты, напоминающие ворсинки.
Т-форма (встречается преимущественно в Японии) – типичны более молодой возраст больных, особенное поражение кожи, быстро прогрессирующее течение и неблагоприятный прогноз.
Выделяют три фазы заболевания.
А. Имеется повышение уровня лимфоцитов крови без анемии – снижения уровня гемоглобина (особого вещества эритроцитов – красных клеток крови – переносящего кислород) и тромбоцитопении (снижения уровня тромбоцитов – кровяных пластинок, склеивание которых обеспечивает свертывание крови). Увеличение лимфоузлов отсутствует или увеличено 1-2 группы лифоузлов.
В. Имеются те же самые признаки, но увеличено три и более групп лимфоузлов.
С. Независимо от увеличения лимфоузлов имеется анемия или тромбоцитопения.
Выделяют три стадии хронического лимфолейкоза.
Начальная стадия. Определяется незначительное возрастание количества лейкоцитов в крови, небольшое увеличение размеров селезенки. Проводится динамическое наблюдение, лечение не требуется.
Развернутая стадия. Имеются основные признаки заболевания. Требуется специфическое лечение.
Терминальная стадия. Характеризуется развитием анемии и тромбоцитопении, различных осложнений (кровотечений, инфекционных осложнений). Часто присоединяется вторая опухоль (обычно острый лейкоз – опухоль из незрелых клеток крови).
Причины
Причины хронического лимфолейкоза неизвестны.
Единой теории, объясняющей возникновение опухолей крови, не существует.
Наиболее признанной в настоящее время является вирусно-генетическая теория.
Согласно ей, особые вирусы (известно 15 видов таких вирусов) внедряются в организм человека и при воздействии предрасполагающих факторов, вызывающих срыв иммунитета (защитных сил организма), проникают внутрь незрелых клеток костного мозга или лимфоузлов, вызывая их частое деление без созревания.
Роль наследственности в возникновении опухолей крови не вызывает сомнений, так как эти заболевания чаще встречаются в некоторых семьях, а также у людей с нарушениями структуры хромосом (носителей наследственной информации).
Предрасполагающие факторы.
Физические: ионизирующая радиация, рентгеновское облучение (например, при нарушении техники безопасности на атомных электростанциях или при лечении рентгеновским облучением опухолей кожи).
Химические:
производственные – лаки, краски и др. (могут проникнуть в организм человека через кожу, при вдыхании или поступить с пищей и водой);
лекарственные – длительное применение солей золота (при лечении заболеваний суставов), некоторых антибиотиков и др.
Биологические:
вирусы;
кишечные инфекции;
туберкулез (инфекционное заболевание человека и животных, вызываемое особым видом микроорганизмов – микобактериями, поражающее преимущественно легкие, кости и почки);
хирургические вмешательства;
стрессы.
Для дифференциальной диагностики хронического лимфоцитарного лейкоза с другими лимфопролиферативными заболеваниями необходимо проанализировать количество В-клеток в периферической крови, мазок крови и провести иммунофенотипирование циркулирующих в крови лимфоцитов. Дополнительно для определения прогноза (но не схемы лечения) иногда проводят цитогенетическое исследование, определяют мутационный статус локуса IgVH, количество ZAP-70 или CD38 в клетках ХЛЛ, количество CD23, тимидинкиназы и β2-микроглобулина в сыворотке крови, а также анализируют биоптат или аспират костного мозга[8].
|
 Скачать 1.46 Mb.
Скачать 1.46 Mb.
