Железодефицитные анемии у детей. Руководство для врачей москва 1999 ббк 57 33 к 68 Коровина Н. А., Заплатников А. Л. Захарова И. Н
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
Глава 1. РОЛЬ ЖЕЛЕЗА И ОСОБЕННОСТИ ЕГО МЕТАБОЛИЗМА В ДЕТСКОМ ОРГАНИЗМЕ.Древние римляне говорили «Понимаю для того, чтобы знать» (Intelligo ut scientam), а легендарный Козьма Прутков вторил им: «Смотри в корень». Прислушаемся к этим столь же мудрым, как и древним афоризмам и вначале попытаемся уяснить физиологическую роль железа и особенности его метаболизма в детском организме. 1.1. ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЖЕЛЕЗА ДЛЯ ОРГАНИЗМА.Железо (Fe) - один из важнейших микроэлементов, входящих в организм. Железо является обязательной составной частью многих гемопротеидов, металлопротеидов и энзимов, участвующих в различных метаболических процессах организма. Основные железосодержащие белки и ферменты, а также их функции в организме представлены в таблице 1. Таблица 1 Основные железосодержащие субстраты организма и их функции:
Традиционно наиболее известно физиологическое значение железа, входящего в состав гемоглобина и участвующего в процессах доставки к тканям организма кислорода и удаления из них углекислого газа. 1.1.1. ГЕМОВЫЕ СОЕДИНЕНИЯ ЖЕЛЕЗАГЕМОГЛОБИН (haemoglobinum; (Hb) в дословном переводе "кровяной шарик") - сложный белково-пигментный комплекс, содержащийся в крови позвоночных и некоторых беспозвоночных. Осуществляет транспорт кислорода из легких в ткани и углекислого газа из тканей в легкие. Структурно-функциональными единицами гемоглобина являются глобин (белковая часть) и гем (небелковая часть): 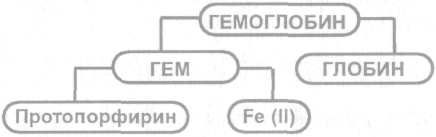 По рекомендациям ВОЗ (1973) нижней граниией для детей до 6-ти лет, следует считать уровень гемоглобина -110 г/л, а для детей старше 6-ти лет-120 г/л. Однако Ю.Е.Малаховский (1981) считает, что содержание гемоглобина для детей в возрасте от 1-го до 6 лет-должно быть не ниже 120 г/л, а для детей старше 6-ти лет - выше 130 г/л. ГЕМ (haemum; синоним железопорфирин) - комплексное соединение пигмента протопорфирина (см. ниже) с ионом двухвалентного железа. Является небелковой частью молекулы гемоглобина. Гем входит в состав гемоглобина, миоглобина, некоторых ферментов (цитохромов, каталазы, лактопероксидазы). Железо, входящее в эти соединения, принято называть гемовым железом. Гемовое железо значительно лучше усваивается организмом, чем ионизированное или железо, не входящее в соединение с протопорфирином. Протопорфирин - пигмент, синтезируемый в организме из янтарной кислоты и глицина. Имеет высокую тропность к ионам двухвалентного железа. МИОГЛОБИН (син.: мышечный гемоглобин, миогемоглобин) - пигментный протеид, содержащийся в мышечной ткани. В состав миоглобина, как и в гемоглобин, входят гем и глобин. Миоглобин осуществляет транспорт О2 в мышцах. Обладает также функцией депонирования О2 в мышечных тканях. КАТАЛАЗА - гемсодержащий фермент, относящийся к классу оксидоредуктаз. Катализирует окислительно-восстановительные реакции, результатом которых является разложение перекиси водорода с образованием кислорода и воды. Физиологическая роль - защита организма от избытка перекисей, образующихся в большом количестве при повышении рО2 во вдыхаемом воздухе или в результате воспалительного процесса. ЦИТОХРОМЫ - гемсодержащие протеиды, участвующие в аэробном обеспечении клеток организма. Переносят в клеточных митохондриях и микросомах электроны и (или) водород к молекулярному кислороду, тем самым, участвуя в тканевом дыхании. ПЕРОКСИДАЗЫ - гемсодержащие ферменты, относящиеся к классу оксиредуктаз. Катализируют реакции окисления различных различных веществ с помощью перекиси водорода. Физиологическая роль, как и у каталаз, - защита организма от избытка перекисей. 1.1.2. НЕГЕМОВЫЕ СОЕДИНЕНИЯ ЖЕЛЕЗАКСАНТИНОКСИДАЗА - фермент группы оксиредуктаз. Катализирует окисление ксантина, гипоксантина и альдегидов с поглащением кислорода. При этом образуются, соответственно, - мочевая кислота, ксантин, карбоновые кислоты. Ац-КоА-ДЕГИДРОГЕНАЗА (син.: ацилкоэнзим А - дегидрогеназа) -фермент, относящийся к классу оксиредуктаз. Катализирует окисление макроэргического соединения ацилкоэнзим А. Участвует в обмене жирных кислот. СУКЦИНАТ-ДЕГИДРОГЕНАЗА - фермент, относящийся к классу оксиредуктаз. Катализирует обратимую реакцию окисления янтарной кислоты в фумаровую. Участвует в цикле трикарбоновых кислот. НАД-Н-ДЕГИДРОГЕНАЗА - фермент, относящийся к классу оксиредуктаз. Катализирует реакции переноса атомов водорода, тем самым участвует в восстановлении НАДФ. ТРАНСФЕРРИН, ФЕРРИТИН И ГЕМОСИДЕРИН - также являются негемовыми железо-содержащими соединениями. Основная их физиологическая функция в организме - непосрественное участие в обмене самого железа. Более подробная характеристика этих физиологических соединений будет представлена в разделе «Особенности обмена железа в детском организме». Суммируя представленные выше данные можно сделать вывод:
Железо играет важную роль в поддержании высокого уровня иммунной резистентности организма. Адекватное содержание железа в организме способствует полноценному функционированию факторов неспецифической защиты, клеточного и местного иммунитета (Бисярина В.П., 1979; Казакова Л.М. и соавт., 1990; Манеров Ф.К., 1985; Овчаренко Е.Ю., 1985; Chandra R.K., 1975; Jacobs A., Worwood M., 1974). Имеются данные, свидетельствующие, что дефицит железа у детей приводит к росту инфекционной заболеваемости органов дыхания и желудочно-кишечного тракта (Бабаш Г.В., Малаховский Ю.Е., 1980; Чумаченко С.М., 1977; Юдина Т.Н., 1989). В тоже время доказано, что дети, получавшие препараты железа в связи с анемией, достоверно реже болели респираторными и кишечными инфекциями (Andelman M.B., Sered B.R., 1966). Опосредованное стимулирующее воздействие железа на миелопероксидазу и энзимные системы, генерирующие Н2О2, способствует поддержанию активности фагоцитоза на необходимом «защитном» уровне (Higashi О. et al., 1967; Baggs R.B., Miller S.A., 1973). Железо через систему рибонуклеотид-редуктазы поддерживает нормальную пролиферацию и митотическую активность Т-лимфоцитов (Казакова Л.М. и соавт., 1984; Chandra R.K., 1983; Mendelsohn L, 1983). Регуляция экспрессии поверхностных антигенов II класса главного комплекса гистосовместимости на Т-лимфоцитах происходит при обязательном участии железосодержащих энзимов (Blakley В. et. al.,1988; De Sousa M., 1989). Нормальное содержание железа в организме необходимо для полноценного фагоцитоза, высокой активности естественных киллеров и бактерицидной способности сыворотки, а также достаточного синтеза пропердина, комплемента, лизоцима, интерферона, slgA (Балашова И.И., 1971; Казакова Л.М. и соавт., 1984; Козлов В.К. и соавт., 1987; Марченко Т.З., 1983; HallguistN.A., Sherman R., 1989; Hasan S.M. et al., 1989; Perkklo M.V., Lausson L.T., 1987). 1.2. ОСОБЕННОСТИ ОБМЕНА ЖЕЛЕЗА В ДЕТСКОМ ОРГАНИЗМЕ.1.2.1. ОСОБЕННОСТИ ОБМЕНА ЖЕЛЕЗА В АНТЕНАТАЛЬНОМ ПЕРИОДЕ.Первоначальные запасы железа у ребенка создаются благодаря антенатальному его поступлению через плаценту от матери. При неосложненном течении беременности женщина передает плоду около 300 мг железа. Этот процесс происходит на протяжении всей беременности, но наиболее активно - начиная с 28-32 недели гестации (Lanzkowsky P., 1976; Widdowson К., 1969). Установлено, что интенсивность трансплацентарного переноса железа нарастает параллельно как сроку гестации, так и увеличению массы плода (Singla J. et al., 1978). Железо матери, в составе трансферрина, доставляется к плаценте с током крови.
Установлено, что плацента является барьером для трансферрина беременной, поэтому последний в кровоток плода не проникает (Duglas Т., Renton J., Watts С., 1971). Непосредственные механизмы переноса железа через плаценту остаются не до конца изученными. Однако известно, что транспорт же/юза через плаценту - активный процесс, осуществляемый против градиента концентрации и возможен только в одном направлении - от беременной к плоду. Предполагается наличие в плаценте высокоактивной ферментативной системы, благодаря которой железо «забирается» из материнского трансферрина и «передается» фетальному трансферрину либо плацентарному ферритину (Woler F., 1955; MazurA.S., 1956).
Железо, доставленное к плаценте материнским трансферрином, взаимодействует со специфическими рецепторами щеточной каймы микроворсинок с последующим трансмембранным переносом (Knisely A.S., 1989). После поступления железа в плаценту часть его депонируется в составе плацентарного ферритина, а другая часть связывается с фетальным трансферрином и непосредственно поступает в кровоток плода (Bothwell Т.Н., 1958; Wochler F., 1964). Трансферрин плода «доставляет» железо в костный мозг, где происходит синтез эритроцитов и в ткани, где железо входит в состав различных ферментных систем, необходимых для внутриклеточного метаболизма. "Избыток" железа депонируется в печени и мышцах в виде ферритина. В случае развития у беременной напряженного железодефицитного состояния включаются компенсаторно-приспособительные реакции, направленные на адекватное снабжение плода железом. Тонкие механизмы данных адаптивных реакций до настоящего времени полностью не выяснены, но установлено, что при этом происходит освобождение железа из резервных запасов плаценты (плацентарного ферритина) и поступление его в фетальный кровоток (Горячев В.В., 1968; Kaufman N., 1970). Передача железа от беременной женщины плоду происходит против градиента концентрации. Это приводит к тому, что уже после 37 недели гестации уровень сывороточного железа у плода выше, чем у матери (Lanzkowsky P., 1976).
Положительный баланс железа у плода обусловлен целым рядом приспособительных механизмов, направленных на создание необходимого запаса железа в организме. Механизмы антенатального образования резервов железа представлены в таблице 2 (Batley G. et al., 1977; Fielding, 1969; Lanzkowsky P., 1976; Matoth, Zaizov, 1977). Таблица 2 Основные механизмы, обеспечивающие положительный баланс железа у плода
Благодаря этим механизмам количество железа, получаемого ребенком антенатально не зависит от содержание железа в организме беременной. Имеются многочисленные и убедительные данные, что плод получает достаточное количество Fe даже в тех случаях, когда у матери в период беременности отмечается железодефицитная анемия (Ковалева Л.А., 1970; Малаховский Ю.Е. и соавт., 1981; Agrawal R.M. et al, 1983; Baker S.J., DeMaeyer E.M, 1979; Keller I, 1978; McPhail A.P, 1980 и др.). Однако, по мнению некоторых авторов, в ряде случаев, железодефицитная анемия и даже латентный дефицит железа у беременной могут стать причиной сидеропении плода и быть одними из факторов развития железодефицитной анемии в постнатальный период (Афонина Л.Г, 1965; Бисярина В.П, 1979; Гайнуллина Э.А, 1974; Жарких А.В., 1989; Гущин И.В., 1990; Сергеева А.И, 1991).
Патологическое течение беременности (токсикозы, угроза прерывания и перенашивание беременности, гипоксический синдром, острые или обострение соматических и инфекционных заболеваний и др.), сопровождающееся нарушением маточно-плацентарного кровотока и плацентарной недостаточностью приводит к уменьшению поступления железа в организм плода. Недостаточное антенатальное накопление железа отмечается при фетоматеринских и фетоплацентарных кровотечениях, внутриутробной мелене. Синдром фетальной трансфузии при многоплодной беременности также способствует "недополучению" железа. По мнению Н.Л.Василевской (1980) для создания запасов железа в организме ребенка не менее важно и время пережатия пуповины. Установлено, что как преждевременная перевязка пуповины (в первые 1-2 мин после рождения, т.е. еще до прекращения пульсации ее сосудов), так и поздняя - приводят к недополучению 30-40 мг железа (Sturgeon P, 1956). Прифизиологическом течении беременности и родов доношенный новорожденный антенатально получает до 250-300 мг железа, что, в среднем, соответствует -70-75 мг/кг массы тела (Мосягина Е.Н., 1969; Малаховский Ю.Е., 198"Т; Josephs H.W., 1953; Woodruff С., 1977). Примечательно, что хотя у недоношенных новорожденных имеется абсолютный дефицит железа, значения относительной концентрации Fe в организме аналогичны таковым доношенных детей (70-75 мг/кг). Чтобы убедиться в этом можно рассчитать суммарное количество железа в организме плода в разные сроки гестации, учитывая, что в течение последнего триместра плод еженедельно получает 22 мг железа: Пример: Ребенок, рожденный на 34 нед. гестации, согласно номограммам оценки физического развития новорожденного имеет массу тела - 2,22 кг (при Р50 ) (Дементьева Г.М., Короткая Е.В., 1981; Gomella T.I., 1988). Т.к. содержание железа у доношенного ребенка (40 нед. гестации), как уже было отмечено, составляет -300 мг, то суммарное количество железа в организме недоношенного на 34 неделе беременности- 168мг: 300 мг - (40 нед-34 нед) • (22 мг) = 300 - (6 -22)=300-132= 168 (мг), что составляет 75,6 мг на 1 кг массы тела: 168 мг:2,22 кг = 75,6 мг/кг Как видно из представленного примера относительный показатель содержания железа в организме ребенка, рожденного на 34 неделе беременности, соответствует значениям доношенного новорожденного. Если же абсолютное количество железа в организме доношеного ребенка (1300 мг) принять за 100%, то окажется, что запасы Fe у приведенного в примере недоношенного ребенка почти в 2 раза меньше: Абсолютное кол-во Fe в организме доношенного (1300 мг) - 100% Абсолютное кол-во Fe в организме недоношенного (168 мг) - х х= (168 • 100) : 1300 = 56,0% 1.2.2. ОБМЕН ЖЕЛЕЗА В ПОСТНАТАЛЬНОМ ПЕРИОДЕ.После рождения источниками железа для развивающегося организма являются поступление экзогенного Fe в составе пищевых продуктов и утилизация Fe из эндогенных запасов. В связи с высокой интенсивностью метаболических процессов в постнатальном периоде очень быстро истощаются антенатальные запасы железа. Развитию сидеропении, особенно у недоношенных, способствуют также низкая активность процессов реутилизации эндогенного Fe и отсутствие полного покрытия физиологических потребностей в железе алиментарными факторами. Если не проводится профилактическая терапия сидеропении, то уже к 3-му мес. жизни у недоношенных и к 5-6-му мес. жизни у доношенных детей, даже при естественном вскармливании, есть все предпосылки для развития железодефицитной анемии.
Как отмечено выше естественная потребность в железе у детей не исчерпывается покрытием физиологических потерь, а направлена на поддержание положительного баланса Fe и создание дополнительных метаболических его запасов. Для покрытия физиологической потребности детского организма в железе в первые 2 года жизни ежедневное его содержание в рационе должно составлять не менее 0,7 мг/кг/сутки (Weipple, 1976). В табл.3 представлено нормативное содержание железа в суточном рационе, обеспечивающее нормальное развитие ребенка: Таблица 3 Нормативы содержания железа в суточном рационе детей для покрытия их суточной физиологической потребности в Fe(Покровский А.А., 1966; WHO.1976)
Особое внимание следует обратить на то, что указанные значения ежедневного поступления железа с пищей превышают ежедневную физиологическую потребность организма ребенка в железе, примерно, в 10 раз. Это обусловлено тем, что из пищи усваивается не более 10% железа, содержащегося в суточном рационе. В обмене железа в постнатальном периоде выделяют следующие этапы (Wheby M.S.,1966; Pinkerton P.M.,1969; Bothwell Т.Н.,1970): A. Всасывание железа в желудочно-кишечном тракте Б. Транспорт железа в организме. B. Депонирование железа в организме. Более подробно основные этапы обмена железа в организме в постнатальном периоде представлены ниже. 1.2.3. ОСНОВНЫЕ ЭТАПЫ ОБМЕНА ЖЕЛЕЗА В ПОСТНАТАЛЬНОМ ПЕРИОДЕ.А. Всасывание железа в желудочно-кишечном тракте:
а) если запасы Fe избыточны, то железо задерживается в эпителиальных клетках слизистой тонкого кишечника в соединении с ферритином. В дальнейшем Fe вместе со слущивающимся эпителием удаляется из организма; б) если же имеется сидеропения, то увеличивается скорость всасывания железа и расширяется абсорбционная площадь кишечника. При этом большая часть железа, не задерживаясь в слизистой, поступает в кровоток и соединяется там с трансферрином (Glanagan Р., 1979; Heinrich H.C., 1977). Однако при развитии дефицита железа у детей раннего возраста усвоение Fe не возрастает, т.к. не происходит компенсаторного увеличения абсорбционной поверхности кишечника. Для детей с неотягощенным перинатальным анамнезом в возрасте первых 3-4-х месяцев жизни материнское молоко является единственным физиологическим продуктом питания, который обеспечивает равновесие обмена железа в организме. Это достигается благодаря сбалансированности состава грудного молока по всем ингредиентам и их соответствия физиологическим потребностям растущего организма. Хотя в женском молоке содержание железа невелико (0,2 - 1,5 мг/л) существуют специальные механизмы для более эффективного его усвоения (до 38-49%) (McMielan I.A. et al. 1976; Saarinen I.M. et al., 1977; WHO, 1968, 1980). Интенсивное всасывание железа из грудного молока обусловлено прежде всего формой, в которой оно представлено. Наличие в женском молоке лактоферрина - железосодержащего белка, выполняющего функции неспецифического фактора защиты, - способствует высокой степени абсорбции Fe из женского молока (Woodruff C.W. et al., 1977). В молекуле лактоферрина определены 2 активных центра связывания ионов Fe3+. Лактоферрин в грудном молоке содержится в виде ненасыщенной и насыщенной форм. Соотношение форм лактоферрина меняется в зависимости от периода лактации. В течение первых 1-3 месяцев жизни превалирует насыщенная железо-транспортная форма лактоферрина. Высокоактивная железотран-спортная форма лактоферрина рассматривается как один из важных физиологических механизмов адаптационного процесса гемопо-этической системы у новорожденных и грудных детей (Отт В.Д., Дюкаева С.И., Марушко Т.Л., 1995). Степень насыщения железом нативного лактоферрина женского молока составляет 10-30% (Ainsough E.W. et al., 1980). Насыщение лактоферрина грудного молока ионами Рез* катализирует лактокупреин - медьсодержащий белок, обладащий ферроксидазными свойствами (Отт В.Д. и соавт., 1995). Наличие специфических рецепторов к лактоферрину на эпителиальных клетках слизистых кишечника способствует адгезии с ними лактоферрина и более полной его утилизации. Кроме того, лактоферрин, связывая "лишнее", невсосавшееся в кишечнике железо, лишает условно-патогенную микрофлору необходимого для ее жизнедеятельности микроэлемента и запускает неспецифические бактерицидные механизмы (Arnold R.R., 1981; Oram J.D.,1977). Установлено, что бактерицидная функция slgA реализуется только в присутствии лактоферрина (Rogers H.J., 1979; Batish V.K. et al., 1984). Интенсивные обменные процессы у грудных детей приводят к тому, что к 5-6 месяцу жизни антенатальные запасы железа истощаются даже у детей с благополучным перинатальным анамнезом и вскармливаемых грудным молоком. Железа, поступающего в организм ребенка с материнским молоком, становится уже недостаточно. С этого периода создание положительного баланса железа в организме во многом обусловлено характером прикорма и пищевой коррекцией. Установлено, что при выборе продуктов для восполнения запасов железа необходимо учитывать не только суммарное количество Fe в продуктах, но и качественную форму его соединений (Идельсон Л.И., 1981). Так, несмотря на то, что общее содержание железа в сухофруктах, примерно, в 5-6 раз выше, чем в мясе говядины (соответственно, 15 мг/100 г и 2,6 мг/100 г) все же из одинакового количества сравниваемых продуктов больше Fe усваивается из мяса. Объясняется это значительно большей эффективностью абсорбции гемового железа по сравнению с другими соединениями пищевого железа (WHO,1973). Железо-порфириновый комплекс (гем) соединяется со специфическими рецепторами слизистых тонкого кишечника и активно всасывается в неизмененном виде. Процессы абсорбции тема в кишечнике не зависят от кислотности среды и пищевых факторов ингибиции всасывания железа. В то же время имеются убедительные доказательства, что всасывание железа из злаков, фруктов и овощей значительно снижается в присутствии оксалатов, фитатов, фосфатов, танина и других ингибиторов абсорбции (Moore C.V., 1968; Callender ST. et al., 1970; Bjorn-Rasmussen E., 1974). Благодаря перечисленным факторам утилизация железа, входящего в состав тема, значительно выше, чем из других соединений. Так, коэффициент абсорбции железа из мяса говядины (гемовое железо) составляет 17-22%, а для железа из сухофруктов - не более 3 %. Установлено, что и из продуктов животного происхождения железо также значительно интенсивнее усваивается из тема, чем из ферропротеинов (ферритин, гемосидерин). Так, несмотря на то, что в печени суммарное содержание Fe в 3 раза выше, более высокий коэффициент утилизации железа имеют мясные продукты. Этот факт становится понятным, если вспомнить, что в печени железо содержится, преимущественно, в виде гемосидерина и ферритина, а в мясных продуктах - в виде тема (см. табл. 6). Таким образом, наиболее эффективно железо усваивается из продуктов, где оно содержится в виде тема (мясные продукты). Необходимо отметить также, что продукты из мяса, печени, рыбы в свою очередь увеличивают всасывание железа из овощей и фруктов при одновременном их применении (Martinez-Torres С. etal., 1970; Colman N., 1974; LayrisseM., 1975). Исследования, проведенные в 60-70 гг. показали, что нормальное значение рН желудочного сока необходимо для усвоения только некоторых форм железа (3-х валентных его соединений) и не является основным фактором всасывания для всего пула пищевого железа (Рябов С.И., Рысс Е.И., 1976; Heinrich H.C., 1975; Jacobs A. et al., 1965). Поскольку в желудочно-кишечном тракте всасывается, преимущественно, 2-х валентное железо, то, в целом, можно считать, что кислотность желудочного сока не оказывает определящего влияния на процессы абсорбции Fe (Идельсон Л.И., 1985).
Скорость утилизации железа в ЖКТ зависит также от белкового состава пищи. На уровень кишечной абсорбции железа влияют как общее количество пищевого белка, так и его качественный состав. Всасывание пищевого железа значительно усиливается при повышении содержания белка в рационе (Мягкова Л.П., 1963). Отмечено, что казеин в 2-4 раза интенсивнее влияет на скорость утилизации железа (Кручакова Ф.А., 1957). Б. Транспорт железа в организме. Транспорт железа в организме осуществляется трансферрином. Этот белок переносит железо из ЖКТ к эритрокариоцитам костного мозга, в тканевые депо. Также трансферрин осуществляет обратный транспорт железа в костный мозг из тканевых депо и из макрофагов, где происходит реутилизация Fe из естественно разрущающихся эритроцитов. Всосавшееся в ЖКТ железо связывается с трансферрином и доставляется к эритрокариоцитам костного мозга, железосодержащие ферментативные системы в клеточные и в тканевые депо. Основная масса реутилизированного эндогенного железа поступает в костный мозг из фагоцитирующих макрофагов. В нормальных условиях "стареюшие" эритроциты разрушаются фагоцитами селезенки и, в значительно меньшей степени, фагоцитирующими мононуклеарами печени и костного мозга (Воробьев А.И., 1985). Одновременно с разрушением стромы эритроцитов происходит естественный распад гемоглобина. При этом, из разрушающегося гемоглобина образуются непрямой билирубин, окись углерода и железо (Идельсон Л.И., 1981). Обратный транспорт железа в костный мозг из макрофагов, где происходит реутилизация Fe из естественно "отмирающих" эритроцитов, также осуществляется трансферрином. Скорость реутилизации и количество "освобожденного" железа из ферритина и гемосидерина паренхиматозных клеток значительно ниже, чем из макрофагов (Cook J.D. et al., 1970; Hershko С., 1974). Железо, доставленное трансферрином в костный мозг, поступает в митохондрии нормобластов. Там происходит взаимодействие железа с протопорфирином с образованием тема. Соединение тема с полипептидными цепями глобина приводит к синтезу в нормобластах гемоглобина. Гуморальная регуляция эритропоэза осуществляется эритропоэтином. Эритропоэтин в нормальных условиях синтезируется, в основном, в почках. Однако, при анемии - 10-15% эритропоэтина синтезируется дополнительно в печени (Boudurunt M.C., 1988). Эритропоэтин поддерживает пролиферативный пул эритроидных коммитированных предшественников, способствует их дифференцировке и ускоряет освобождение ретикулоцитов из костного мозга (Reissman K.R., 1950). Обсуждается вопрос о стимулирующем влиянии эритропоэтина на процессы синтеза гемоглобина (Danielson B.G., 1991). Установлено снижение синтеза эритропоэтина у новорожденных детей, что связывают с возрастанием рО2 крови в постнатальный период. В. Депонирование железа осуществляется благодаря ферритину и гемосидерину, которые захватывают "избыточное" железо и откладываются, практически, во всех тканях организма, особенно интенсивно в печени и мышцах (ферритин), макрофагах костного мозга и паренхиматозных органов (гемосидерин).
В естественных условиях железо выделяется с калом, мочой, потом, а также теряется с волосами и ногтями. Физиологические потери железа у детей составляют 0,1 - 0,3 мг/сутки, увеличиваясь до 0,5 - 1,0 мг/сутки у подростков. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
