Руководство к практическим занятиям по микробиологии. Руководство к практическим занятиям по микробиологии ( малый практикум) Ульяновск 2003 удк 619 616. 9
 Скачать 4.08 Mb. Скачать 4.08 Mb.
|
ЗАНЯТИЕ 4. Окраска спорообразующих и капсулообразующих бактерий. Определение подвижности микроорганизмов.Цель занятия. Усвоить методы окраски спорообразующих, капсулообразующих бактерий, а также определение подвижности бактерий. Материалы и оборудование. Взвеси бактерий с вакцинным штаммом сибирской язвы, клостридиями, готовые препараты с капсулообразующими бактериями, подвижные бульонные культуры эшерихий 18 часового роста, предметные и покровные стекла, плакаты, 2% раствор сафранина, водный раствор малахитовой зелени, карболовый фуксин Циля. Методические указания. Каждый студент готовит мазки из взвесей микроорганизмов и окрашивает их по методу Трухильо, Ольта, микроскопирует и зарисовывает; готовит препарат для изучения подвижности микроорганизмов методом «раздавленная» и «висячая» капля. Окраска спор. При неблагоприятных условиях для микробов (отсутствие питательной среды, высушивание, неблагоприятная температура и др.) в цитоплазме некоторых микроорганизмов образуются споры. Формируются они внутри вегетативной клетки, являясь эндоспорами. Палочковидные грамположительные микроорганизмы, образующие округлые споры, диаметр которых не превышает ширину микробной клетки, относятся к роду Bacillus и называются бациллами. Микроорганизмы рода Clostridium имеют споры диаметр которых превышает ширину микробной клетки и называются клостридиями. По форме они бывают овальные и круглые (рис. 5). Споры устойчивы к воздействию высоких температур, химических веществ, к высыханию, длительно сохраняются в почве, что объясняется их особым строением и химическим составом, в особенности ее оболочки. Поэтому споры стойки к действию красителей. Все методы окраски спор основаны на обеспечении проникновения красителя через трудноокрашиваемую оболочку споры. Поэтому применяют протраву. После охлаждения оболочка вновь становится плотной и не пропускает дополнительный краситель. Техника окраски спор методом Трухильо. На фиксированный мазок накладывают небольшой кусочек фильтровальной бумаги и на нее наносят водный раствор малахитовой зелени. 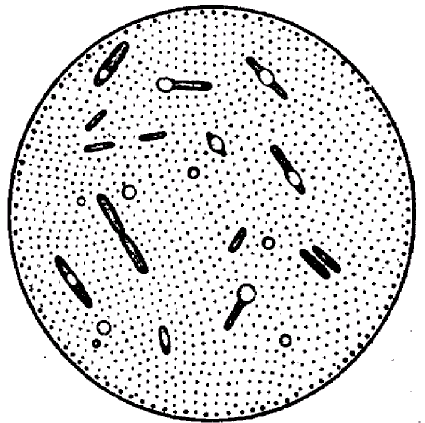 Рис. 5. Споры микроорганизмов различных типов Рис. 5. Споры микроорганизмов различных типовПодогревают препарат на пламени горелки до появления паров и выдерживают в течение 3 минут, промывают водой и докрашивают 0,25%-ным водным раствором основного фуксина 1 минуту. Промывают водой и высушивают. Микрокартина: споры зеленые, а вегетативные клетки красные. Окраска капсул. Тело микробной клетки покрыто рыхлым слизистым слоем. У некоторых видов микроорганизмов этот слой развивается очень сильно и тогда он называется капсулой. Капсула - муциноподобное вещество, высокомолекулярный полисахарид, является производным наружного слоя оболочки. Наличие капсулы является важным диагностическим признаком при идентификации и дифференциации возбудителей некоторых инфекций (сибирской язвы, пневмококковой пневмонии и др.) (рис. 6). Патогенные микроорганизмы образуют капсулу в инфицированном организме. Она является фактором вирулентности и защищает бактериальную клетку от фагоцитоза и бактерицидного действия сыворотки крови. Капсульное вещество плохо окрашивается. Поэтому при приготовлении препарата для обнаружения капсулы выполняют следующие правила: а) мазок готовят из свежего материала, так как капсула быстро лизируется; б) фиксируют мазок химическим способом, для окраски применяют метохромотические краски, то есть при использовании, которых цитоплазма окрашивается в один цвет, а капсула - в другой; в) промывать мазок водой следует слабо и кратковременно. Техника окраска капсул по методу Ольта. Свежий горячий 2%-ный раствор сафранина наносят на фиксированный мазок, окрашивают 5-7 минут. Быстро промывают водой и высушивают. Тело клетки окрашивается в краснокирпичный цвет, капсула в - желто-оранжевый. Определение подвижности бактерий. Подвижности бактерий важный видовой признак и производиться при диагностических исследованиях: результат учитывают при идентификации микроорганизмов. У подвижных видов способность самостоятельного поступательного (и вращательного) движения обусловлена наличием жгутиков - специальных тонких нитевидных образований. 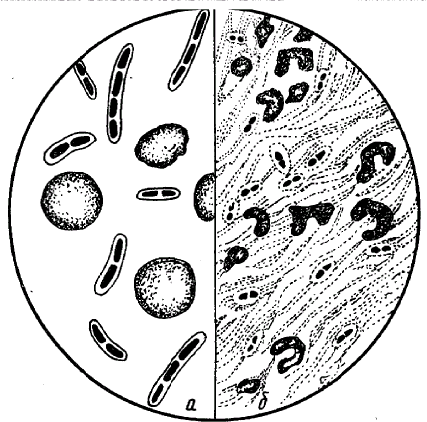 Рис.6.Капсула у бактерий а бацилла сибирской язвы; б - диплококк Жгутики бывают различной длины. Их диаметр настолько мал, что они невидимы в световом микроскопе (менее 0,2 мкм). У разных групп бактерий количество и расположение жгутиков неодинаково. Жгутики плохо воспринимают красители. Методы сложной окраски искажают подлинный вид жгутиков, поэтому в лабораториях окраску жгутиков не осуществляют, а исследуют бактерии в живом состоянии. В зависимости от расположения и количества жгутиков микробы подразделяют (рис. 7): а) монотрихи - микроорганизмы, имеющие на одном из полюсов один жгутик, движения активные, поступательные (псевдомонас); 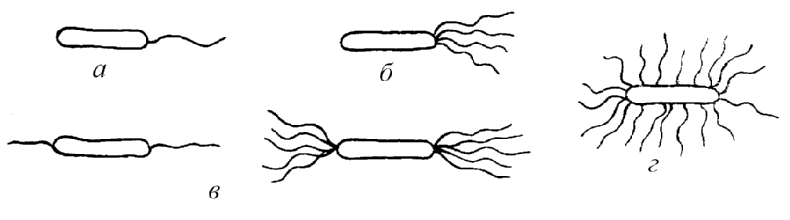 Рис. 7. Типы расположения жгутиков у бактерий б) лофотрихи - микробы, имеющие на одном из полюсов пучок жгутиков (листерии); в) амфитрихи - микробы, имеющие жгутики на обоих полюсах микробной клетки; г) перитрихи - микробы, у которых жгутики расположены по всей поверхности клетки(E.coli). Есть виды микроорганизмов, обладающие подвижностью, но жгутиков не имеют (спирохеты, лептоспиры). Их движение обусловлено импульсивными сокращениями двигательного фибриллярного аппарата микробной клетки. Для определения подвижности у бактерий необходимо использовать культуру не старше суточного возраста, так как старые культуры утрачивают способность передвигаться. Определение подвижности бактерий методом «висячая капля». Каплю молодой (18-20 часовой) бульонной культуры бактерий бактериологической петлей наносят на покровное стекло. Специальным предметным стеклом с углублением (луночкой) накрывают каплю культуры так, чтобы покровное стекло с каплей находилось в центре луночки и прилипло к предметному стеклу (края луночки предварительно слегка смазывают вазелином). Препарат перевертывают стеклом вверх, и капля «повисает» над луночкой (рис. 8). Препарат микроскопируют при затемненном поле зрения, сначала при малом, затем при среднем или большом увеличении. На светлом фоне микробы темно-серые. Методом Шукевича. Для этого каплю микробной взвеси наносят в конденсат скошенной плотной питательной среды в пробирке. Подвижные микроорганизмы, передвигаясь из конденсата, растут на поверхности среды; неподвижные виды размножаются только в конденсате среды («не заходя» на поверхность агара). 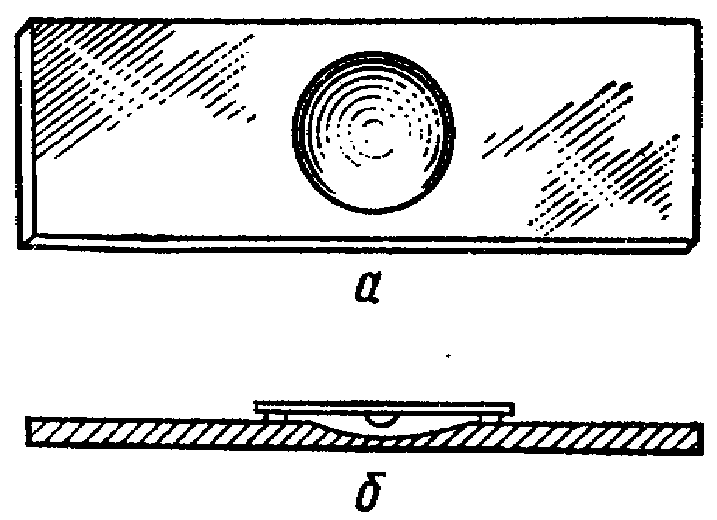 Рис. 8. Исследование микробов на подвижность а стекло с луночкой; б «висячая капля» Метод «раздавленная капля». Каплю бактериальной взвеси наносят на обычное предметное стекло, осторожно накрывают покровным стеклом и слегка придавливают пальцем. Микроскопию проводят, так же как и в методе «висячая капля». Метод посева уколом в полужидкий агар. Для этого бактериологической петлей производят посев исследуемой культуры уколом до дна пробирки с полужидкой питательной средой. Подвижная культура растет по всей питательной среде, образуя равномерное помутнение, а неподвижная - только по уколу в виде стержня, сохраняя прозрачность незасеянного участка среды. ЗАНЯТИЕ 5. Лабораторная посуда и её подготовка. Питательные среды. Методы приготовления и стерилизации питательных сред. Методы стерилизации лабораторной посуды. Цель занятия. Подготовить посуду. Приготовить питательные среды. Определить рН сред. Ознакомиться с методами стерилизации питательных сред и лабораторной посуды. Оборудование и материалы. Штативы, пробирки, микробиологические петли, пипетки, чашки Петри, бумага. Автоклав, сушильный шкаф. Набор сред и химических реактивов. рН -метр. МЫТЬЕ И ОБРАБОТКА ЛАБОРАТОРНОЙ ПОСУДЫ Для мытья лабораторной посуды в микробиологических лабораториях отводится отдельное помещение — моечная. Сильно загрязненную посуду со следами жира обрабатывают в хромовой смеси. Хромовая смесь, будучи сильным окислителем, разрушает органические вещества с образованием растворимых или газообразных продуктов. Перед употреблением хромовую смесь подогревают до температуры 45 - 50°С, а затем заливают ею грязную посуду. Мытье новой лабораторной посуды. В ведре с теплой водой растворяют хозяйственное мыло, чтобы образовалось небольшое количество пены, погружают в нее посуду и ставят на слабый огонь. После 15-минутного кипячения посуду вынимают, ополаскивают чистой водой, погружают в теплый 1—2% раствор хлористоводородной кислоты, доводят до кипения и вываривают 10—15 мин, чтобы нейтрализовать избыток щелочи, который мог остаться при изготовлении стекла. После кипячения в кислоте посуду прополаскивают водопроводной водой и дважды дистиллированной. При мытье посуды, служащей для постановки серологических реакций, кислоты и щелочи использовать не рекомендуется, так как даже следы этих веществ, оставшиеся на стенках, могут исказить результат реакции. Такую посуду моют горячей водой, кладут на сетки, чтобы с нее стекла вода, затем несколько раз ополаскивают дистиллированной водой и сушат в сушильном шкафу. Мытье лабораторной посуды, бывшей в употреблении. Посуда, в которой содержался зараженный материал, автоклавируют в режиме гарантирующим гибель находящихся в ней патогенных микробов. Перед мытьем из пробирок, чашек и матрацев обеззараженную жидкость выливают. Не очень загрязненную посуду моют ершом в горячей воде с мылом, содой или в растворе горчицы. Очень загрязненную жирную посуду, не поддающуюся мытью обычным способом, заливают на 30—40 мин хромовой смесью, а затем в течение продолжительного времени промывают проточной водопроводной водой. Простой и надежный способ мытья и обеззараживания лабораторной посуды предложен Г. П. Кирсановым (1972). Отработанную лабораторную посуду стерилизуют в автоклаве в течение 2 ч при 2 атм. После стерилизации, посуду загружают в бак и заливают раствором, содержащим на 100 мл дистиллированной воды 5 мл нашатырного спирта и 3 г порошка для стирки хлопчатобумажного и льняного белья. Лабораторная посуда хорошо отмывается и обезжиривается в течение 30 мин кипячения в указанном растворе, затем ее прополаскивают водопроводной водой и дважды дистиллированной. После этого, посуду высушивают в сушильном шкафу. Обработка посуды, применявшейся для выращивания микобактерий туберкулеза на яичных питательных средах. А.В. Ивановым и соавт. (1974) предложен простой и экономичный способ. Использованные пробирки со средами автоклавируют при 1,5 атм. в течение 30 мин, затем по 250 - 300 пробирок укладывают в бачки или эмалированные ведра с плотной крышкой, заливают 1 % раствором едкого натра и кипятят 2 ч. Во время кипячения остатки питательной среды растворяются, и образуется однородная жидкая мыльно-щелочная смесь, способствующая освобождению пробирок от плотных остатков среды. После 2 ч кипячения мыльно-щелочной раствор переливают в другое ведро для повторного использования (раствор может быть использован 3—4 раза). Прокипяченные отмытые пробирки несколько раз прополаскивают водопроводной водой и высушивают. Посуду, используемую для приготовления и хранения питательных сред и культивирования микробов, нельзя обрабатывать дезинфицирующими веществами, так как даже следы их делают питательную среду непригодной для размножения микроорганизмов. Мытье градуированных пипеток. Пипетки и другая градуированная посуда, поступающие для работы, должны быть абсолютно чистыми и хорошо обезжиренными. На стенках плохо обезжиренной посуды при вливании жидкости остается большое количество капель, вследствие чего слитый объем жидкости не будет соответствовать той величине, которая указана на шкале деления. Градуированные пипетки, моют следующим образом. С помощью резинового баллончика, надетого на пипетку, насасывают в нее горячую тыльную воду и погружают затем в сосуд с такой же водой. Чтобы вода из пипеток не вытекала, уровень жидкости в сосуде должен соответствовать высоте пипеток. Выдержав 20— 30 мин в мыльном растворе, пипетки прополаскивают водопроводной водой и переносят в 1—2% раствор хлористоводородной кислоты, который постепенно доводят до кипения. Далее пипетки обрабатывают так же, как и остальную стеклянную посуду. Закупорившийся канал пипетки прочищают мандреном от тонких игл шприцов. Промытые пипетки складывают в таз, заливают теплым раствором горчицы или мыльной водой и ставят на слабый огонь. После 20—30-минутного кипячения пипетки вынимают и ополаскивают сначала теплой проточной водой, а затем дистиллированной. Сильно загрязненные пипетки также очищают ершом с мылом или содой, и погружают в хромовую смесь, налитую в ванночку или банку, по высоте соответствующую длине обрабатываемых пипеток. В хромовой смеси пипетки выдерживают 20—30 мин, затем в течение нескольких минут промывают проточной и дважды ополаскивают дистиллированной водой. Сушка и хранение чистой лабораторной посуды.Высушенную посуду просматривают на свет. Стекло ее должно быть совершенно прозрачным, без матового налета и пятен. Вымытую посуду не вытирают, а сушат при комнатной температуре или горячим воздухом в сушильном шкафу при температуре 100—105°C. |
