Руководство к практическим занятиям по микробиологии. Руководство к практическим занятиям по микробиологии ( малый практикум) Ульяновск 2003 удк 619 616. 9
 Скачать 4.08 Mb. Скачать 4.08 Mb.
|
ПИТАТЕЛЬНЫЕ СРЕДЫИзвестно очень много питательных сред для культивирования микроорганизмов (более двух тысяч наименований было классифицировано Левином и Шёнлейном еще в 1930 г.), но число ингредиентов, являющихся их неотъемлемыми компонентами, относительно невелико. Однако качественный диапазон этих сред весьма широк — от растворов неорганических солей, на которых могут расти автотрофы, до сложных питательных сред, приготавливаемых из мясных гидролизатов, обогащенных кровью или сывороткой; ими обычно пользуются для выделения патогенных микроорганизмов типа стрептококков, отличающихся высокой требовательностью к составу питательной среды. Различают два основных типа питательных сред: так называемые синтетические среды, главные составные части которых точно известны (например, глюкозо-солевая питательная среда), и эмпирически подобранные питательные среды природного происхождения, состав которых точно неизвестен (к ним относятся пептоны, приготавливаемые из частично гидролизованного белка). Выбор питательной среды зависит в значительной степени от цели эксперимента. Герберт настойчиво высказывался за повсеместное использование синтетических питательных сред. Однако следует признать, что они обладают рядом практических неудобств. Микроорганизмы, выращенные на таких питательных средах, обычно фенотипически отличаются от выращенных на питательных средах естественного происхождения типа бульона (например, по составу и по скорости деления). Размножение микроорганизмов на таких средах обычно легче подавляется избыточной аэрацией или токсическими катионами; они также более чувствительны к нарушениям баланса между некоторыми составными частями питательной среды, особенно аминокислотами. Многие бактерии нуждаются в большом числе факторов роста, и для некоторых из них до сих пор не найдены искусственные среды, на которых они могли бы размножаться. Возможно, что все эти неудобства ее временем будут преодолены, но пока среды неизвестного состава типа бульонов, приготовленных из перевара, используются весьма широко, хотя они и вносят в эксперимент неконтролируемые факторы. В состав сред, применяемых для выращивания бактерий, входят необходимые для построения белков цитоплазмы органогены: азоты, углерод, водород, кислород, неорганические соединения, содержащие фосфор, калий, серу, натрий, магний, железо, микроэлементы: кобальт, йод, марганец, бор, цинк, молибден, медь и др. Все перечисленные элементы должны находиться в питательной среде в удобоусвояемом для данного микроорганизма соединении, причем требования различных микробов в этом отношении неодинаковы. Потребность в кислороде и водороде бактерии удовлетворяют главным образом за счет поступающей в клетку воды. По характеру усвоения азота патогенные микроорганизмы делятся следующим образом: одни из них извлекают азот из простых аммонийных соединений, другие нуждаются в аминокислотах, третьи расщепляют высокомолекулярные вещества — пептоны, представляющие собой продукты неполного ферментативного переваривания белков. Строго паразитические виды бактерий размножаются только в присутствии нативного, т. е. неизмененного, белка. Источником углерода для бактерий являются главным образом различные углеводы: сахар, многоатомные спирты, органические кислоты и их соли. Потребность бактерий в неорганических элементах удовлетворяется прибавляемыми к питательной среде солями: NaCI, KH2P04, K2HP04 и т. д. Микроэлементы, выполняющие роль катализаторов химических процессов, необходимы в ничтожно малых количествах и поступают в питательную среду с пептоном, неорганическими солями и водой. Наряду с перечисленными органическими и неорганическими элементами бактерии нуждаются в ростовых факторах, которые по своей роли соответствуют витаминам для животных. Источником факторов роста являются прибавляемые к питательной среде продукты растительного и животного происхождения, содержащие в своем составе никотиновую, пантотеновую, парабензойную кислоты, витамины. Питательные вещества могут усваиваться микробами только при определенной реакции питательной среды, так как проницаемость оболочек микробных клеток изменяется в зависимости от рН среды. Потребность в питательных веществах и физических условиях у различных видов микробов неодинакова и этим исключается возможность создания универсальной питательной среды. По консистенции различают плотные и жидкие питательные среды. Плотные питательные среды готовят из; жидких питательных сред посредством прибавления к ним клеевых веществ агара или желатина. Агар-агар (по-малайски желе) - продукт растительного происхождения, добываемый из морских водорослей. В воде агар-агар растворяется при температуре 80 - 86° С, застудневает при 36 - 40° С. Применение агаровых сред благодаря их способности сохранять плотность при температуре 37°С дало возможность выращивать патогенных микробов при оптимальной для большинства из них температуре на плотных средах. Желатин—вещество белковой природы животного происхождения. В теплой воде при температуре 32—34°С он набухает и растворяется, а при более низкой температуре превращается в студень. Однако при рН ниже 6,3 и выше 7,0 плотность желатина уменьшается, и он плохо застывает. Требования, предъявляемые к питательным средам. Питательные среды должны:1. Содержать необходимые для питания микроба питательные вещества. 2. Иметь реакцию рН, оптимальную для выращиваемого вида микроба. 3. Иметь достаточную влажность, так как микробы питаются по законам диффузии и осмоса. 4. Обладать изотоничностью. 5. Быть стерильными, обеспечивая тем самым возможность выращивания чистых культур микробов. Питательные среды подразделяются на среды общего назначения и специальные. К первой группе относятся мясопептонные: агар, бульон, питательный желатин. Среды общего назначения используют для выращивания многих патогенных микробов и применяют в качестве основы для приготовления специальных сред, добавляя к ним кровь, сахар, молоко, сыворотку и другие ингредиенты, необходимые для размножения того или иного вида микроба. К специальным питательным средам относятся элективные (избирательные) и дифференциально-днагностическне. Элективные (избирательные) среды. Принцип создания элективных питательных сред основан на удовлетворении основных биохимических и энергетических потребностей того вида микроба, для культивирования которого они предназназначены. Определенный состав и концентрация питательных микроэлементов, ростовых факторов при строго значении рН обеспечивают оптимальные условия для выращивания одного или нескольких видов микроорганизмов. При посеве на них материала, содержащего смесь различных микроорганизмов, раньше всего будет проявляться рост того вида, для которого данная среда будет элективной. Дифференциально-диагностические среды. Дифференциально-диагностические питательные среды используют для определения видовой принадлежности исследуемого микроба, основываясь на особенностях его обмена веществ. По своему назначению дифференциально-диагностические питательные среды подразделяются следующим образом: 1. Среды для выявления протеолитической и гемолитической способности микробов, содержащие в своем составе белковые вещества: кровь, молоко, желатин и т. п. 2. Среды с индифферентными химическими веществами, которые служат источником питания для одних видов микробов и не усваиваются другими видами. 3. Среды с углеводами и многоатомными спиртами для обнаружения соответствующих ферментов. 4. Среды для определения редуцирующей способности микробов. В состав дифференциально-диагностических сред, предназначенных для выявления сахаролитических и окислительно-восстановительных ферментов, вводят индикаторы: нейтральную красную, метиленовый синий, лакмусовую настойку, кислый фуксин, бромтимоловый синий, водный голубой краситель и розоловую кислоту. Изменяя свою окраску при различных значениях рН, индикатор указывает на наличие или отсутствие расщепления, окисления или восстановления введенного в среду ингредиента. Однако индикатор не является обязательной составной частью сред, предназначенных для выявления ферментов. Так, наличие желатиназы и других протеолитических ферментов в культуре определяют по разжижению желатина, свернутого яичного или сывороточного белка. Сухие питательные среды. Приготовление питательных сред — один из наиболее ответственных участков работы бактериологической лаборатории. В связи с этим биопромышленность выпускает стандартные, консервированные, сухие питательные среды, различного назначения, для культивирования микроорганизмов. Готовят среды по прописи, указанной на этикетке. Постоянство состава, стандартность среды, простота и удобство в работе, легкость транспортировки и хранения являются большим преимуществом сухих питательных сред. После установления соответствующего рН среду кипятят, фильтруют, осветляют, разливают во флаконы, пробирки и стерилизуют. Следует учитывать, что после стерилизации среда становится более кислой. Стерилизация питательных сред. Стерилизацию питательных сред осуществляют различными способами в зависимости от тех ингредиентов, которые входят в их состав. 1. Синтетические среды и все агаровые среды, не содержащие в своем составе нативного белка и углеводов, стерилизуют 15—20 мин в автоклаве при температуре 115—120°С. 2. Среды с углеводами и молоком (в состав которого входит лактоза), питательный желатин стерилизуют текучим паром при температуре 100°С дробно или в автоклаве при 112° С. 3. Среды, в состав которых входят белковые вещества (сыворотка крови, асцитическая жидкость), обеспложиваются тиндализацией или фильтрованием. 4. Для стерилизации питательных сред, содержащих в своем составе нативные белки, пользуются фильтрацией через мембранные фильтры Зейтца. Подготовленные питательные среды проверяют на стерильность. Для этого их ставят в термостат при температуре 37° С. Среды, простерилизованные в автоклаве, выдерживают в термостате 1 сут, простерилизованные текучим паром -3 сут. ЗАНЯТИЕ 6. Методы и техника культивирования микроорганизмов на питательных средах. Методы выделения чистых культур микроорганизмов. Изучение культуральных свойств микроорганизмов. Цель занятия. Изучить способы посевов и пересевов микроорганизмов на питательные среды. Изучить методы выделения чистых культур микроорганизмов. Ознакомиться с формами колоний. Произвести посев культур микробов на МПБ и МПА (в пробирки), а также посев смеси микробных культур (для выделения чистых) методом рассева на чашки Петри с МПА. Оборудование и материалы. Штативы, пробирки со средами, микробиологические петли, шпатели, пипетки, чашки Петри с МПА. Культуры микроорганизмов. ТЕХНИКА ПОСЕВА МИКРООРГАНИЗМОВБактериологический метод—выделение чистых культур микробов и их последующая идентификация — имеет большое значение в диагностике инфекционных заболеваний, при изучении санитарно-гигиенического состояния объектов внешней среды (вода, воздух, почва, продукты питания). Однако первым этапом этой методики является посев или пересев бактериальной культуры на различные типы питательной среды. Материалом для посева могут быть пересеваемые культуры бактерий, различные выделения животных и человека, ткани трупа, вода, почва, продукты питания. Жидкий материал для посева берут петлей или пипеткой. При взятии петлей жидкость должна образовать в кольце петли тонкую прозрачную пленку - “зеркало”. Пипетками пользуются в том случае, когда материал засевают в большом или точно отмеряемом объеме. Способ взятия плотного материала определяется его консистенцией. При посевах чаще всего пользуются бактериальной петлей. Все манипуляции, связанные с посевом и выделением микробных культур, производят над пламенем горелки. Бактериальную петлю прокаливают над пламенем непосредственно перед взятием материала, затем петлю остужают. Для этого при пересеве микробной культуры с пробирки горячую петлю погружают в конденсационную жидкость, а при пересеве с чашек Петри прикасаются к поверхности питательной среды, свободной от микробного роста. Достаточно остуженная петля не вызывает шипения конденсационной жидкости и не растапливает агар при соприкосновении со средой. После окончания посева петлю прожигают повторно для уничтожения находящейся на ней микробной культуры или инфицированного микроорганизмами материала. Пипетки и шпатели, используемые для посевов и опускают в дезинфицирующий раствор. После посева на чашках Петри со стороны дна, на пробирках в верхней трети надписывают название засеянного материала, ставят номер анализа и дату посева. Техника посевов на плотные и жидкие питательные среды: 1. При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его 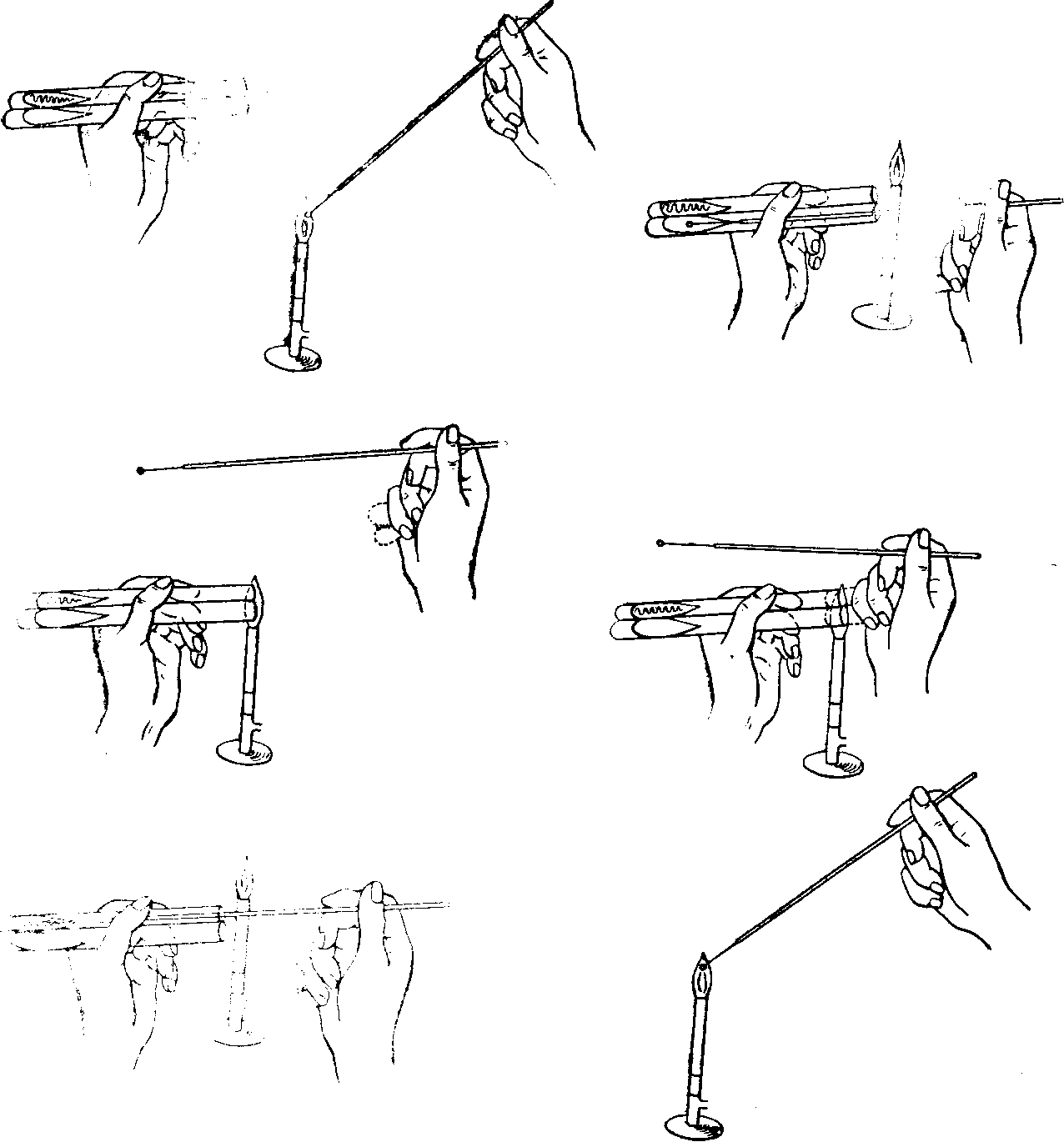 Рис.11. Схема пересева микробов из пробирки в пробирку. растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду. 2. При посеве на скошенный мясопептонный агар пробирку берут в левую руку между 1 и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой V и IV пальцами, не прикасаясь к той части пробки, которая входит внутрь пробирки. Остальные 3 пальца правой руки остаются свободными для взятия бактериальной петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха. Петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрих снизу вверх, от одной стенки пробирки к другой (рис.). 3. При посеве на поверхность плотной питательной среды в чашки Петри чашку держат в левой руке. Дно ее с одной стороны придерживают 1 и II пальцами, а с другой —IV и V пальцами. Крышку, приоткрытую настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель, фиксируют 1 и III или 1 и II пальцами (рис.). Небольшое количество исследуемого материала втирают бактериальной петлей в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериальную петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхности, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на несколько равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем. 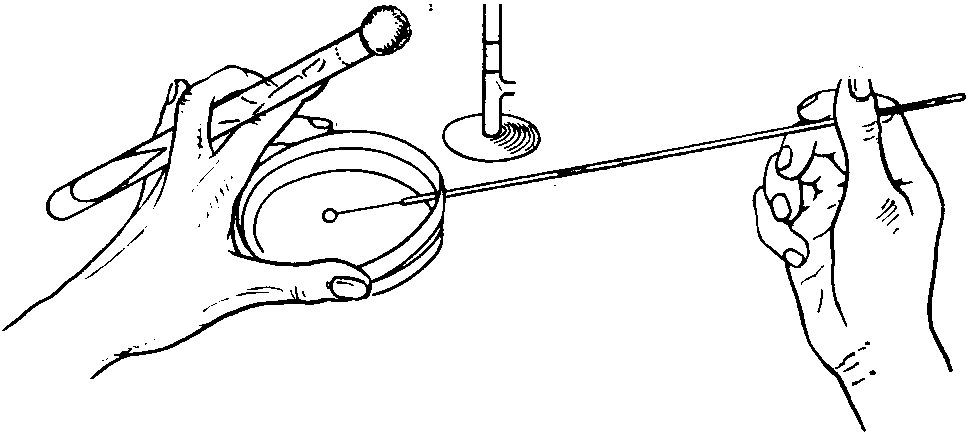 Рис. 12. Посев на плотную питательную среду в чашки Петри. При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного, или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида. 4. Из материала, подлежащего посеву в толщу плотной питательной среды, готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1—1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15 - 20 мл мясопептонного агара, расплавленного и остуженного до температуры 40 - 45 °С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола. 5. Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку, как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом. ПОЛУЧЕНИЕ ЧИСТЫХ КУЛЬТУР. Чистой культурой микробов называют популяцию микроорганизмов одного вида, полученную из изолированной микробной колонии. Под микробной колонией подразумевается потомство бактерий, возникающее в результате размножения одной микробной клетки. Выделение чистой культуры микробов является обязательным этапом всякого бактериологического исследования. Чистая культура необходима для изучения морфологических, культур культуральных, биохимических и антигенных свойств, по совокупности которых определяется видовая принадлежность исследуемого микроорганизма.Для выделения чистых культур микробов из материалов, содержащих обильную смешанную микрофлору, предложено много различных методов. Наибольшее распространение получил метод механического разъединения микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на поверхности или в глубине питательной среды. Очень широко применяются элективные питательные среды, стимулирующие развитие тех микроорганизмов, чистую культуру которых предполагается выделить. Некоторые виды микробов обладают высокой чувствительностью к воздействию определенных факторов внешней среды. Индивидуальная устойчивость микробов к тому или иному фактору была использована для разработки методов выделения чистых культур путем умерщвления сопутствующей микрофлоры. Этим способом производится выделение споровых форм микробов, устойчивых к действию высокой температуры, микобактерий туберкулеза, безразличных к действию концентрированных растворов минеральных кислот, в отличие от остальных микробов, содержащихся в мокроте. При выделении чистой культуры патогенных микробов из патологического материала, загрязненного посторонней микрофлорой, прибегают иногда к заражению лабораторных животных, восприимчивых к тому виду микроба, который предполагается выделить из исследуемого материала. Биологический метод выделения чистой культуры применяется при исследовании мокроты на содержание в ней пневмококков, микобактерий туберкулеза. Для выделения бактерий в виде чистых культур известно сравнительно мало методов. Чаще всего это делают путем изолирования отдельных клеток на твердой питательной среде, используя метод посева штрихом. Из чистой культуры обычно вырастают одинаковые колонии и при микроскопировании выявляются похожие клетки, в частности по размеру и окраске по Граму. Однако возможны исключения, например, колонии, вырастающие из чистой культуры, могут быть гладкие (S) и шероховатые (R). Кроме того, в чистых культурах различных микроорганизмов могут появиться кокковидные клетки, цисты и споры. Наконец, некоторые микроорганизмы проявляют грамвариабельность. Посев штрихом. Существует много методов посева штрихом в чашки с твердыми средами (“штрихованные чашки”), но лишь некоторые из них почти всегда дает хорошо изолированные колонии даже при отсутствии навыков у экспериментатора. Кроме того, можно наливать разведенные растворы смешанной культуры на поверхность твердых сред в чашках. При работе с анаэробами “штрихованные чашки” или чашки с внесенной в них жидкой культурой в атмосфере воздуха инкубируют затем в анаэростате. Для анаэробов необходимы свежеприготовленные среды, и посев штрихом следует проводить в течение первых 4 ч после их автоклавирования, чтобы избежать накопления растворенного кислорода. Рис.13. Удобный метод посева штрихом в чашки для получения отдельных колоний. А. Для маркировки на обратной стороне чашки Петри карандашом наносят букву Т, разделяющую дно на 3 сектора. Б. Петлей с культурой зигзагом наносят штрихи на поверхности агара в секторе 1, как показано на рисунке. Для этого крышку чашки сначала приподнимают, а после нанесения штриха сразу закрывают. Петлю стерилизуют в пламени и дают ей остыть (15 с). В. Проводят петлей по поверхности среды в секторе 1, как показано на рисунке, и затем немедленно наносят ею зигзагом штрихи на поверхности среды в секторе 2. Прогревают петлю в пламени и дают ей остыть. Г. Проводят петлей по поверхности среды в секторе 2, как показано, и затем наносят ею зигзагом штрихи на поверхности среды в секторе 3. Д. Инкубируют опрокинутые вверх дном чашки, как показано на рисунке, для того чтобы конденсирующаяся вода с крышки не попала на поверхность агара. В секторе 1 вырастает большое число колоний, тогда как в секторах 2 и 3 появляются отдельные хорошо изолированные колонии. Получение чистой культуры методом рассева в глубине среды (по Коху). Три пробирки, содержащие по 15 мл мясопептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43— 45°С. В пробирку вносят одну бактериальную петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого прокаленной и остуженной петлей содержимое 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок. После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала. Выделение чистой культуры по способу Дригальского. Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливающегося роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во вторую и третью чашки, втирая в поверхность питательных сред оставшийся на нем материал. Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 180°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся на петле, расходуется постепенно, и по линиям сетки, нанесенным в конце посева, вырастают изолированные колонии микробов. ИЗУЧЕНИЕ КУЛЬТУРАЛЬНЫХ СВОЙСТВ МИКРООРГАНИЗМОВ Культуральные признаки микробов определяются характером роста их на питательных средах. Будучи постоянными, для каждого вида микроба, они являются важным диагностическим признаком. Рост микробов на плотной питательной среде. Для изучения свойств колоний микробы культивируют на плотных питательных средах в чашках Петри. При посеве материала стараются получить изолированный рост колоний. Чашки с посевом просматривают сначала невооруженным глазом или через лупу, затем помещают их на столик микроскопа вверх дном и просматривают колонии в проходящем свете с объективом малого увеличения и с суженной диафрагмой. Колонии характеризуют по величине, форме, контуру края, рельефу, поверхности, цвету, структуре и консистенции. Величина колонии определяется ее диаметром. В зависимости от диаметра различают колонии точечные (диаметр меньше 1 мм), мелкие (диаметр 1—2 мм), средние (диаметр 2—4 мм) и крупные (диаметр 4—6 мм и более). Форма колонии бывает правильная — круглая, неправильная — амебовидная, ризоидная — корневидная, напоминающая переплетающиеся корни деревьев. Характер контура края определяют при рассмотрении колонии под лупой или микроскопом с малым увеличением. Различают ровные края в виде четко выраженной линии и неровные. Последние делят на:
В некоторых случаях четко выраженная линия, отграничивающая колонию от поверхности среды, отсутствует. Такой край колонии называется расплывчатым. Рельеф колонии характеризуется приподнятостью ее над поверхностью питательной среды и контуром формы в вертикальном разрезе. Определяется рельеф колонии невооруженным глазом или с лупой при рассматривании сверху и сбоку. 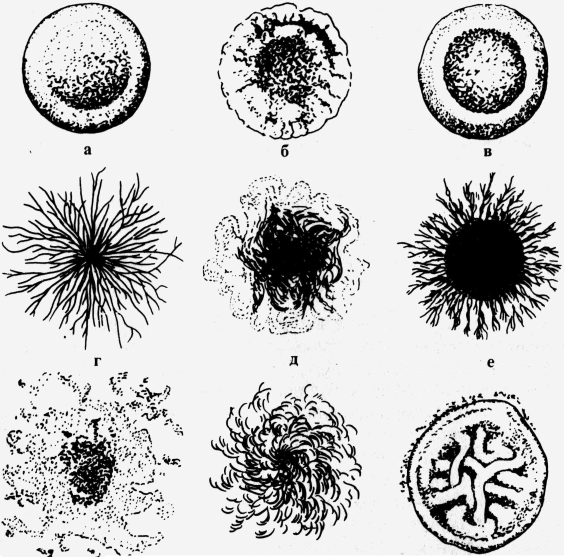 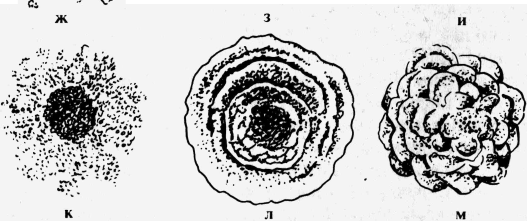 Рис.14. Форма колоний: а - круглая; б - круглая с фестончатым краем; в - круглая с валиком по краям; г, д - ризоидные; е - круглая с ризоидным краем; ж - амебовидная; з - нитевидная; и - складчатая; к - неправильная; л - концентрическая; м - сложная Различают: 1) каплеобразные и куполообразные колонии правильной круглой формы с различно выраженной степенью выпуклости, которые в вертикальном разрезе представляют собой сегмент шара и отличаются только длиной радиуса. Колонии слабовыпуклые имеют большую длину радиуса; куполообразные — меньшую; 2) колонии плосковыпуклые с плоским верхом, пологими или круто обрывающимися краями; имеют в вертикальном разрезе форму трапеции; 3) колонии конусообразные, имеющие в вертикальном разрезе форму треугольника: 4) колонии с приподнятой в виде соска серединой и валиком по периферии; 5) колонии с вдавленным центром; 6) колонии плоские, стелющиеся по поверхности среды. Поверхность колонии изучают с помощью лупы или под микроскопом при малом увеличении. Поверхность колоний бывает матовая или блестящая с глянцем, сухая или влажная, гладкая или шероховатая. Гладкие колонии обозначают буквой S (smooth), шероховатые — буквой R (rough), что означает соответственно “гладкий” и “шероховатый”. Механизм формирования гладких и шероховатых форм колоний обусловлен различием процессов клеточного деления. Микробные клетки в колониях S-форм располагаются, соприкасаясь своими боковыми поверхностями, клетки R-форм, сохраняя при делении цитоплазматические мостики, образуют цепочки, которые, накладываясь, друг на друга, обусловливают шероховатую поверхность и неровный край колонии. Переход S-форм в R-формы наблюдается при диссоциации. Явление диссоциации у патогенных микробов наблюдается под действием антибиотико - и химиотерапии, факторов специфического иммунитета, формирующихся в течение инфекционного процесса, а также факторов внешней среды. Среди шероховатых форм колоний различают: складчатые, гирозные, по виду напоминающие исчерченную извилинами поверхность мозга; бородавчатые, концентрически или радиально исчерченные; шагреневые, т. е. мелкозернистые. Цвет колонии определяется пигментом, который продуцирует культура микробов. Преобладающее большинство патогенных бактерий пигмента не образует, вследствие чего колонии их бесцветны или молочно-мутного цвета, похожи на опал. В проходящем свете такие колонии в большей или меньшей степени прозрачны. Пигментообразующие виды микробов дают колонии различных цветов: кремовые, желтые, золотисто-оранжевые, синие, красные, сиреневые, черные и др. Структура колоний определяется в проходящем свете при слабом увеличении микроскопа, суженной диафрагме или при несколько опущенном конденсоре. У пигментированных колоний и колоний, не пропускающих света, она не определяется. По характеру структуры различают следующие виды колоний: 1) гиалиновые — бесцветные, прозрачные, без видимой определенной структуры; 2) зернистые, которые в зависимости от величины зерен разделяются на мелко - и грубозернистые; 3) нитевидные или волокнистые, характеризующиеся наличием длинных, густо переплетающихся нитей в толще колонии. Колонии бывают однородные и неоднородные. Строение первых одинаково во всех частях, у вторых центральная часть отличается от периферической или отдельные сектора имеют строение, неодинаковое с остальной массой. Консистенцию колонии, определяющую ее физическое состояние, исследуют посредством прикосновения или взятия из нее части материала бактериальной петлей. По характеру консистенции колонии бывают: 1) пастообразные, легко снимающиеся и размывающиеся по поверхности питательной среды наподобие сливочного масла; 2) вязкие или слизистые, прилипающие и тянущиеся за петлей; 3) волокнистые или кожистые, плотные, снимающиеся с поверхности питательной среды в виде упругой пленки, соответствующей величине и форме колонии; 4) хрупкие, сухие, рассыпающиеся при прикосновении петли. Особенности микробного роста на жидких питательных средах. На жидких питательных средах характер роста микробов менее разнообразен, чем на плотных питательных средах. Однако и здесь выявлены следующие формы роста бактерий. 1. Рост бактерий с равномерным помутнением среды, цвет которой остается неизмененным или изменяется в соответствии с цветом водорастворимого пигмента, образующегося в культуре микроба. Такой рост характерен для многих патогенных бактерий, относящихся к группе факультативных анаэробов. 2. Придонный рост бактерий характеризуется образованием осадка на дне пробирки с жидкой питательной средой. Осадок может быть скудным или обильным, крошковидным, гомогенным, волокнистым или в виде крупных рыхлых хлопьев, по консистенции вязким, слизистым, хрупким или пастообразным. Питательная среда над осадком может быть прозрачной или мутной. Цвет осадка и среды, находящейся над ним, определяется наличием пигмента, продуцируемого культурой микробов. Если культура пигмента не образует, цвет среды не изменяется, а осадок приобретает, как правило, серовато-белый или желтоватый цвет. Придонный рост специфичен для бактерий с анаэробным типом дыхания. 3. Пристеночный рост бактерий выражается в том, что питательная среда, находящаяся в пробирке, остается совершенно прозрачной. Бактерии растут, образуя более или менее крупные рыхлые хлопья или, наоборот, компактные зерна, прикрепленные к внутренней поверхности стенок сосуда, с которых в зависимости от вида бактерий снимаются легко или с трудом. 4. Поверхностный рост бактерий характеризуется появлением на поверхности жидкой питательной среды пленки, внешний вид и характер которой могут быть различны: а) пленка тонкая, нежная, бесцветная, имеет вид едва заметного налета, исчезающего при встряхивании пробирки и взбалтывании среды; б) пленка влажная, толстая, хорошо видимая простым глазом, вязкой, слизистой консистенции, прилипает к петле и тянется за ней; в) пленка плотная, сухая, внешним видом напоминает кусочки кожи и при попытке взятия из нее материала снимается целиком в виде круглого диска, соответствующего диаметру пробирки: г) пленка плотная, сухая, со сморщенной, а иногда бородавчатой поверхностью, краями прикрепленная к стенкам сосуда; при взбалтывании жидкости или прикосновении бактериальной петли разбивается на кусочки, погружающиеся в глубь жидкости. Цвет пленки, как и питательной среды, зависит от пигмента, вырабатываемого растущей культурой микробов. Рост бактерий в виде поверхностной пленки характерен для микробов-аэрофилов. Рост на полужидкой питательной среде. Для выявления особенностей микробного роста на полужидкой питательной среде исследуемую культуру засевают в столбик 0,2—0,5% полужидкого агара. Для того чтобы особенности роста проявлялись наиболее четко, прокол среды делают в непосредственной близости к стенке пробирки. Посев, произведенный таким образом, дает возможность выявить подвижные расы микробов и дифференцировать их от неподвижных. Подвижные микробы в столбике полужидкого агара вызывают выраженное помутнение, распространяющееся более или менее равномерно по всей толщине среды. Неподвижные формы микробов растут только по ходу прокола среды, напоминая сосульки цилиндрической или конической формы. При этом окружающая среда остается совершенно прозрачной. ЗАНЯТИЕ 7. Методы изучения биохимических свойств микроорганизмов. Цель занятия. Изучить биохимическую дифференциацию микроорганизмов. Материалы и оборудование. Набор питательных сред. Изучаемая культура микроорганизмов. МЕТОДЫ ИЗУЧЕНИЯ БИОХИМИЧЕСКИХ СВОИСТВ МИКРООРГАНИЗМОВ В жизнедеятельности микробов ферменты играют большую роль. Они являются обязательными участниками разнообразных биохимических реакций, лежащих в основе функций питания, дыхания, размножения. Каждый вид микроорганизмов продуцирует постоянный для него набор ферментов, одни из которых расщепляют в разной степени белки и углеводы, а другие вызывают окисление и восстановление различных субстратов. Стабильность ферментативных систем бактерий позволяет использовать биохимические свойства бактерий в сочетании с их морфологическими, культуральными и другими постоянными признаками для определения видов и типов бактерий. Для обнаружения ферментов исследуемую культуру микробов засевают на специальные дифференциально-диагностические питательные среды. Сахаролитические свойства микроорганизмов. Свойство расщеплять углеводы и высокоатомные спирты, которые принято объединять в одну группу, именуемую сахарами, присуще многим микробам. Под действием сахаролитических ферментов бактерий сахара расщепляются на альдегиды и кислоты. Конечными продуктами их расщепления являются газообразные вещества: С02 и Н2. Характерно, что различные виды и даже разновидности микробов относятся по-разному к одним и тем же сахарам. Так, например, одни бактерии, ферментируя лактозу, остаются нейтральными в отношении глюкозы, другие, наоборот, сбраживают глюкозу, а третьи, наиболее активные, вызывают расщепление и глюкозы, и лактозы. Для обнаружения сахаролитических ферментов исследуемую культуру бактерий засевают в питательные среды Гисса, называемые также “пестрым” рядом. Короткий “Пестрый” ряд Гисса содержит обычно 5 пробирок: с глюкозой, лактозой, маннитом, мальтозой и сахарозой. При некоторых исследованиях для более углубленного изучения биохимических свойств выделенного микроба ряд Гисса дополняют дульцитом, сорбитом, ксилозой, арабинозой и некоторыми другими сахарами. Название “пестрый” ряд обусловлено тем, что под действием ферментов микроба одни углеводы остаются неизменными и, следовательно, цвет питательной среды не меняется, в то время как другие сахара расщепляются, образуя кислые продукты распада, которые изменяют цвет индикатора и соответственно цвет питательной среды. Среды Гисса бывают жидкими и полужидкими (с добавлением 0,2—0,5% агар-агара). В пробирки с жидкими средами Гисса для обнаружения газов, являющихся конечными продуктами распада сахаров, опускают “поплавок” — трубочку диаметром 0,5—0,7 см, запаянную с одного конца. “Поплавок” помещают запаянным концом кверху; при стерилизации он полностью заполняется питательной средой. При образовании в среде газообразных продуктов они вытесняют часть жидкости, находящейся в “поплавке”, вследствие чего у запаянного конца его собирается воздушный пузырек. В полужидких средах Гисса газообразование определяют по наличию мелких пузырьков газа в толще среды и стойкой пены на ее поверхности. Таким образом, при изучении сахаролитических ферментов, выделяемых микробами, учитывают не только явления расщепления тех или иных Сахаров по кислотообразованию, но и глубину ферментативного процесса по наличию в питательной среде конечных газообразных продуктов. Пробирки с набором сред Гисса ставят в штатив в один ряд. На каждой пробирке надписывают название сахара, содержащегося в среде. На первой пробирке каждого ряда, кроме названия сахара, указывают номер или вид исследуемой микробной культуры. Культуру берут на кончик петли в очень небольшом количестве и засевают по общепринятой методике. Протеолитические свойства микроорганизмов. Некоторые виды микроорганизмов продуцируют и выделяют во внешнюю среду протеолитические ферменты — протеазы, катализирующие расщепление белков. В результате расщепления молекулы белка образуются высокомолекулярные промежуточные продукты распада — пептоны, альбумозы и полипептиды. Под действием других протеолитических ферментов пептоны в свою очередь расщепляются на полипептиды (соединения двух или нескольких аминокислот) и отдельные аминокислоты. Для выявления протеолитических ферментов исследуемую культуру микроба засевают в питательную среду, содержащую тот или иной белок. Чаще всего для этой цели применяют желатин, реже — свернутую лошадиную сыворотку, коагулированный яичный белок, молоко или кусочки вареного мяса. Протеолитическая активность одного и того же микроба при определении ее на разных питательных средах будет проявляться неодинаково, что обусловлено специфичностью ферментов. Поэтому для разных видов микробов рекомендуют питательные среды различного состава. Определение протеолитической активности микробов а) На желатине. Мясопептонный желатин разливают в пробирки столбиком по 5— 6 мл. Посев производят уколом, погружая петлю с исследуемой культурой в глубь питательной среды до дна пробирки. Микробы, способные расти при низкой температуре, оставляют стоять в комнате при 20—22°С. Остальные посевы инкубируют в термостате при 37 °С. Вместе с опытными пробирками в термостат ставят одну или две пробирки с незасеянным желатином для контроля. При температуре 37 °С желатин плавится, поэтому после инкубации пробирки, вынутые из термостата, опускают в холодную воду или ставят в холодильник. После застудневания желатина в контрольных пробирках приступают к просмотру роста и учету изменений в питательной среде опытных пробирок. Там, где под действием фермента желатиназы произошло расщепление белков желатина, отмечается разжижение питательной среды. Пробирки, в которых после суточного инкубирования среда остается без изменения, оставляют в термостате, наблюдение за изменением среды ведется в течение 20 сут. В протоколе исследования обязательно отмечают день появления признаков разжижения среды, степень и характер ее разжижения. б) На молочном агаре Эйкмана. Молочный агар Эйкмана, разлитый и остуженный в чашках Петри, засевают исследуемой культурой микробов. Посев делают петлей или шпателем так, чтобы получить изолированные колонии. Через 24—48 ч инкубации в термостате культуры, продуцирующие протеолитический фермент, обусловливают пептонизацию молочного белка — казеина, в результате чего вокруг таких колоний образуются прозрачные зоны, четко выделяющиеся на общем молочно-мутном фоне среды. в) На свернутой кровяной сыворотке. Культуру исследуемых аэробных микробов засевают на чашки, анаэробных — уколом в столбик свернутой лошадиной сыворотки, инкубируют в термостате при 37 °С. Штаммы, продуцирующие протеолитические ферменты, разжижая питательную среду, образуют углубления вокруг колоний или на поверхности столбика среды. г) В бульоне с куриным яичным белком. В пробирку с мясопептонным бульоном или бульоном Хоттингера, содержащим кусочек свернутого куриного белка, вносят одну петлю исследуемой культуры микроба. Посевы просматривают ежедневно в течение 5 дней. Протеолитически активные культуры микробов расщепляют коагулированный яичный белок; кусочки белка, содержавшиеся в среде, заметно уменьшаются в размере, превращаясь в крошкообразную массу, или полностью растворяются. Аналогичным образом проявляются протеолитические свойства микробов в средах с кусочком вареного мяса. Некоторые виды патогенных микробов с выраженной протеолитической активностью обладают способностью расщеплять белок и пептон до продуктов глубокого распада: индола, сероводорода, мочевины и аммиака. При определении видов и дифференциации разновидностей патогенных микробов наибольшее значение имеет выявление двух первых продуктов: индола и сероводорода. Определение индола в культуре микроорганизмов. Индол образуется при расщеплении сложной гетероциклической кислоты - триптофана. Для выявления индолообразования петлю исследуемой культуры засевают в среду Строгова или другие среды, рекомендуемые для обнаружения индола. Тотчас после посева в пробирку вносят полоску индикаторной бумаги, пропитанную раствором щавелевой кислоты, так, чтобы индикаторная бумага не касалась питательной среды. Для этого верхнюю треть бумажной полоски прижимают пробкой к стенке пробирки. Посевы инкубируют 24—48 ч при температуре 37°С. Образование индола определяют по окрашиванию нижнего конца индикаторной бумаги в бледно-розовый цвет, хорошо заметный в проходящем свете. Определение сероводорода. Сероводород является конечным продуктом расщепления аминокислот: цистина, цистеина и метионина, содержащих серу. Петлю исследуемой культуры микробов засевают в пробирку с мясопептонным бульоном или бульоном Хоттингера. Тотчас после посева в пробирку вносят пропитанную ацетатом свинца полоску индикаторной бумаги на определение сероводорода. В положительных случаях образующийся в культуре сероводород вступает в соединение с бесцветным ацетатом свинца и превращается в сульфат свинца, который придает индикаторной бумаге черно-бурое окрашивание. Окончательный учет результатов на образование индола и сероводорода проводят на 7—10-й день после посева, так как процесс ферментативного расщепления белка и образования конечных продуктов распада происходит иногда в течение длительного времени. Окислительно-восстановительные свойства микроорганизмов. В культуре микробов могут быть обнаружены окислительно-восстановительные ферменты, связанные главным образом с дыхательной функцией микроорганизма. Как известно, процесс окисления субстрата может происходить посредством присоединения к нему кислорода с участием ферментов оксидаз или в результате отщепления от него водорода с участием ферментов дегидраз. Для этого типа реакции характерно то, что окисление какого-либо одного вещества всегда сопровождается восстановлением (редукцией) другого органического вещества. Первое вещество, от которого отщепляется водород, называют донором, а то вещество, к которому он присоединяется, - акцептором. Акцептором водорода чаще всего является кислород воздуха, однако им могут быть также многие органические соединения, способные легко окисляться и восстанавливаться. С целью выявления ферментов дегидраз и определения их активности в практике микробиологических исследований предложен метод, основанный на введении в питательную среду органической краски, выполняющей роль акцептора водорода. В результате присоединения водорода краситель восстанавливается, превращаясь в бесцветное соединение, называемое лейкобазой. При обильном доступе кислорода оно может вновь окислиться и приобрести прежний цвет. В качестве акцептора водорода используют метиленовый синий, лакмусовую настойку, малахитовый зеленый, индиго-кармин, нейтральный красный и др. Для выявления редуцирующих свойств микроорганизмов указанные красители добавляют к обычным питательным средам: мясопептонному бульону, мясопептонному агару, молоку. Один и тот же вид микроба ведет себя неодинаково по отношению к краскам разного состава. Это свойство микроба использовано в микробиологической практике в качестве дифференциального признака. Бактерии брюшного тифа редуцируют метиленовый синий, но не редуцируют лакмуса и не изменяют нейтрального красного в противоположность кишечной палочке, которая остается нейтральной в отношении метиленового синего, но восстанавливает лакмус и нейтральный красный. Определение редуцирующей способности. 1. В 5 мл среды - молока с метиленовым синим - засевают петлю исследуемой культуры с плотной питательной среды или 0,1 мл 18-часовой бульонной культуры н после ч инкубации учитывают результаты роста. При положительной реакции на редукцию метиленового синего среда из голубой становится кремового цвета, а при слабоположительной — приобретает зеленоватое окрашивание. 2. .Пробирки с лакмусовым молоком, средой Минкевича засевают так же, как молоко с метиленовым синим, суточной культурой с плотной или жидкой питательной среды. Посевы инкубируют в термостате в течение 10 дней, ежедневно наблюдая за изменением цвета среды. Редукция лакмуса проявляется полным обесцвечиванием молока, имеющего розовато-сиреневый цвет до посева. В протоколе исследования редукцию лакмуса обозначают буквой Р. Среда Минкевича позволяет также выявлять кислото - или щелочеобразование, выражающееся соответственно в покраснении или посинении молочной среды. Образование кислоты обозначается буквой К, щелочи — буквой Щ. Определение фермента каталазы. Некоторые виды микроорганизмов, принадлежащие к группе аэробов, в процессе дыхания образуют перекись водорода, являющуюся клеточным ядом. Количество перекиси водорода в культуре никогда не достигает высоких концентраций, так как по мере образования перекись расщепляется на воду и молекулярный кислород при участии фермента каталазы. На поверхность микробной культуры, выращенной на плотной питательной среде в чашке Петри, наносят 1—2 мл 1% раствора перекиси водорода так, чтобы она покрывала поверхность культуры тонким слоем. Появление пузырьков газа в слое нанесенной жидкости свидетельствует об образовании кислорода в результате расщепления перекиси водорода под действием каталазы. Подобный результат в протоколе опыта отмечается знаком + как положительный результат реакции на каталазу. ЗАНЯТИЕ 8. Методы микробиологического исследования воды, воздуха и почвы. Цель занятия. Ознакомиться с правилами взятия и пересылки проб воды и почвы для исследования. Определить общее количество живых микроорганизмов в 1 г или 1 мл. Исследовать воздух седиментационным (метод Коха). Оборудование и материалы. Стерильные колбы с пробкой, пробирки с 9 мл стерильной воды в каждой, стерильных чашки Петри, завернутые в бумагу. Стерильные пипетки (на 2 мл каждая). Пробирки с расплавленным МПА, по 12 мл в каждой. Микробиологические петли. Предметные и покровные стекла. Раствор Люголя. Кедровое масло. Горелки. |
