Сборник заданий. Сборник заданий Республиканской олимпиады по общеобразовательным. Сборник заданий Республиканской олимпиады по общеобразовательным предметам
 Скачать 2.33 Mb. Скачать 2.33 Mb.
|
|
Тема: Изучение закона распределение случайных чисел. Задание: используя табличные данные найдите законы распределение случайных чисел. Ниже представлены результаты, полученные в двух сериях бросаний двух игральных костей. Как вы знаете, игральные кости имеют шесть граней, и каждая нумеруется от 1 до 6. Результаты случайны, но распределение случайных чисел тоже имеет свои закономерности. Вам предлагается выполнить следующее: Часть 1. 1. Для обоих выборок постройте столбчатые диаграммы количества каждого результата (по оси откладывается значение результата (сумма значений двух костей) 2, 3, …,11,12, длина столбика – количество результатов (количество раз, когда сумма двух костей равняется числу по абсциссе). 2. Рассчитайте и сравните для обоих серий среднее значение результата. 3. Рассчитайте и сравните долю каждого результата от общего количества. 4. Рассчитайте и сравните для обоих серий средний квадрат значение результата. Средний квадрат величины – это среднее арифметическое квадратов величины. Серия 1: 3, 8, 5, 7, 7, 11, 12, 9, 9, 8, 10, 8, 6, 7, 9, 11, 3, 4, 7, 7, 7, 2, 7, 10, 9, 7, 7, 2, 8, 6, 9, 8, 5, 9, 6, 10, 9, 4, 8, 6, 6, 10, 11, 6, 5, 6, 8, 8, 8, 12, 2, 6, 3, 5, 11, 4, 4, 5, 9, 8, 8, 12, 4, 9, 6, 3, 5, 12, 2, 8, 6, 5, 3, 7, 9, 4, 4, 6, 6, 7, 11, 5, 5, 10, 9, 5, 11, 2, 3, 5, 7, 4, 10, 12, 10, 7, 10, 3, 5, 7 Серия 2: 7, 10, 4, 8, 4, 6, 7, 4, 6, 10, 10, 5, 7, 10, 3, 6, 12, 3, 7, 5, 3, 9, 5, 9, 7, 11, 9, 7, 7, 6, 8, 11, 6, 6, 8, 8, 10, 4, 6, 11, 7, 2, 7, 5, 8, 7, 2, 5, 12, 4, 7, 5, 7, 6, 6, 12, 3, 9, 10, 5, 11, 10, 8, 3, 2, 9, 8, 9, 9, 9, 11, 6, 5, 5, 4, 8, 2, 4, 6, 8, 11, 5, 12, 10, 8, 3, 9, 7, 5, 8, 6, 8, 4, 12, 9, 2, 9, 10, 2, 6. Часть 2. Теперь, когда вы получили диаграммы, и увидели, что случайные числа тоже имеют свои закономерности. Проверим эти закономерности на более сложной системе. У вас имеется пять игральных костей. И для точности, увеличим количество бросков всех костей, которое равно 10 000 раз. 1. Рассчитайте среднее значение результата. 2. Рассчитайте средний квадрат значения результата. 3. Приближённо рассчитайте долю выпадения цифр от 20 до 30 включительно. ІІ Задание. В некотором опыте смесь гелия (одноатомный газ He c молярной массой 4 г/моль) и водяного пара ( H2O, молярная масса 18 г/моль) участвует в адиабатическом процессе, изображённом на графике. Основываясь на опытных данных, определите массовое содержание водяного пара в смеси, если он всё время остаётся ненасыщенным. Предложите метод расчёта, дайте результат и определите его погрешность. 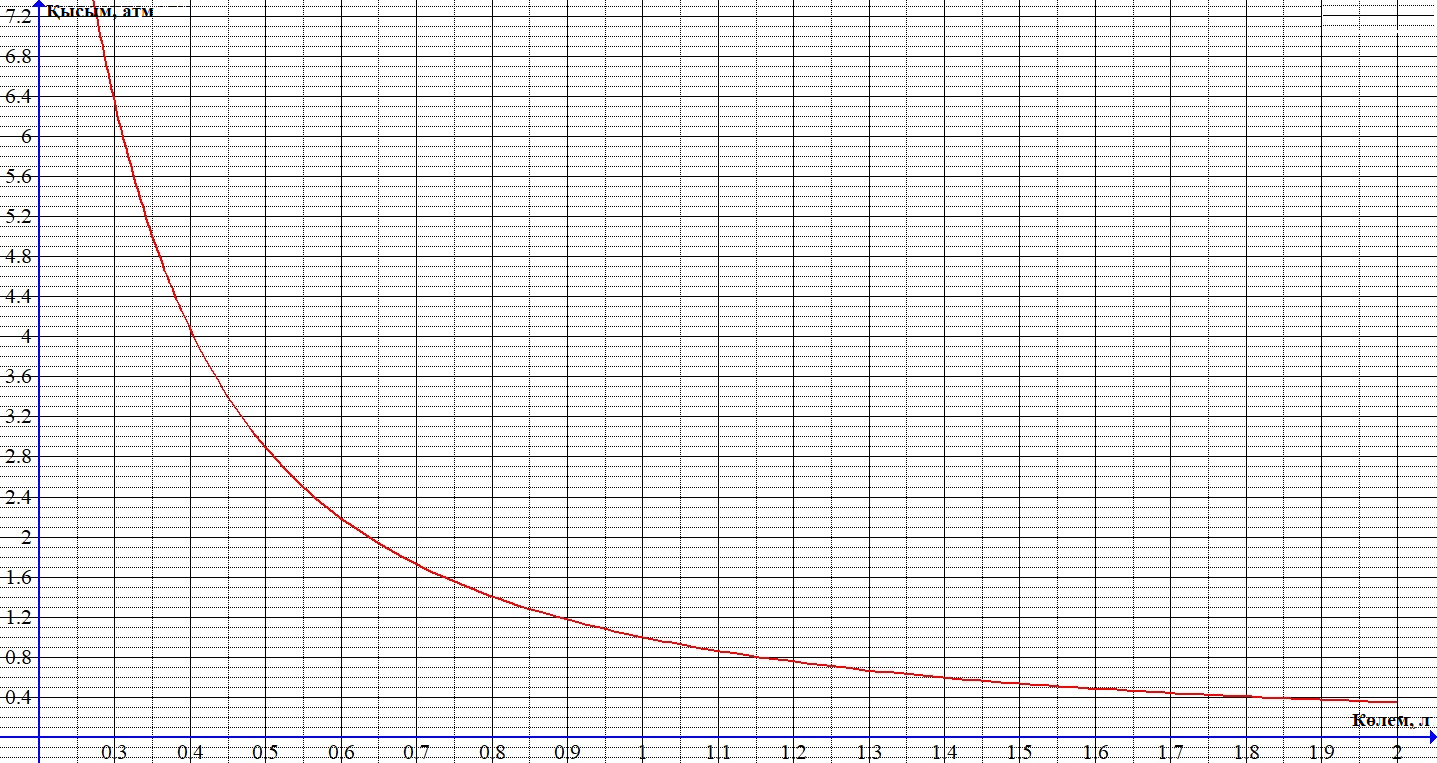 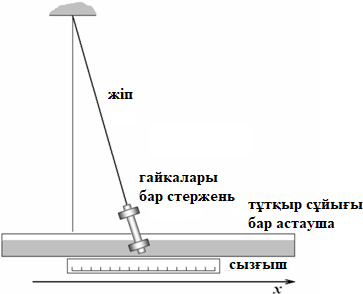 III Задание. На рисунке показана установка к потолку: привязана длинная нить, к нижнему концу которой прикрепляется стержень, на который можно накручивать идентичные гайки гайка может двигаться в желобе с вязкой жидкостью с помощью линейки измеряем точное положение стержня с гайкой в различные моменты времени, то есть нужно будет изучать закон ее движения x(t). III Задание. На рисунке показана установка к потолку: привязана длинная нить, к нижнему концу которой прикрепляется стержень, на который можно накручивать идентичные гайки гайка может двигаться в желобе с вязкой жидкостью с помощью линейки измеряем точное положение стержня с гайкой в различные моменты времени, то есть нужно будет изучать закон ее движения x(t). Предположим, что сила сопротивления, действующая на гайку со стороны жидкости, пропорциональна скорости гайки Fкед.= - β (1) где β - коэффициент лобового сопротивления 1) Используя формулу (1) и предварительные наблюдения над движением гайки в жидкости, покажите, что закон движения гайки x(t) описывается уравнениями 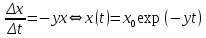 (2) (2) де x0 - начальное отклонение положения гайки от положения равновесия. 2) Выразите значение коэффициента y через параметры установки. 3) Период колебаний маятника 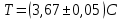 . Рассчитайте длину маятника вместе с погрешностью . Ускорение свободно о падения считайте равным ց=9,81 м/с2 . Рассчитайте длину маятника вместе с погрешностью . Ускорение свободно о падения считайте равным ց=9,81 м/с2 В таблице представлены измерения зависимости координаты гайки от времени x(t) в двух случаях с одной гайкой внизу и с двумя гайками. 4) Постройте графики законов движения для двух случаев. 5) Покажите через возможную линеаризацию , что результаты измерений закона движения соответствуют теоретической модели (2). 6 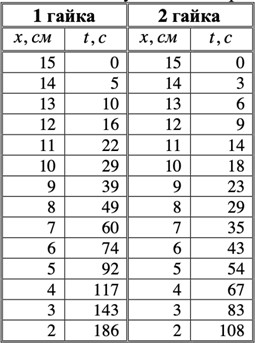 ) Рассчитайте значения коэффициентов у в формулах (2) для двух экспериментально изученных случаев. ) Рассчитайте значения коэффициентов у в формулах (2) для двух экспериментально изученных случаев. 7) Рассчитайте коэффициент лобового сопротивления β при движении гайки в вязкой жидкости. Значение массы гайки 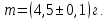 и стержня и стержня 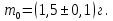 ХИМИЯ Задача 1. К 30%-ному раствору NaOH массой 250 г добавили Na2O. В результате, массовая доля NaOH в конечном растворе увеличилась до 40%. Вычислите массу и количество вещества NaOH в исходном растворе. Определите массу Na2O. Рассчитайте массу NaOH в конечном растворе. Задача 2. Найдите энтальпию реакции димеризации диоксида азота при температуре 273 К на основании следующих данных: N2O(газ) + O2(газ) = N2O3(газ) , ∆H1 = 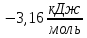 2N2O4(газ) + O2(газ) = 2N2O5(газ) , ∆H2 = 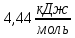 N2O5(газ) + N2O3(газ) = 4NO2(газ) , ∆H3 = 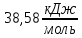 2N2O(газ) + 3O2(газ) = 4NO2(газ) , ∆H4 = 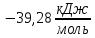 Нарисуйте схему димеризации диоксида азота. Напишите три реакции образования азотной кислоты в присутствии любого оксида. Задача 3. А) В процессе электролиза на электродах происходят так называемые полуреакции. Обычно на катоде происходит полуреакция с участием катиона более пассивного металла, а на аноде происходит полуреакция с участием аниона, содержащего меньшее число атомов кислорода. В этой части мы рассмотрим обычный электролиз раствора сульфата меди. Через 250 г. 12,8%-ного раствора сульфата меди провели ток до тех пор, пока вся медь не выделилась из раствора. а.1) Запишите общую реакцию электролиза. а.2) Рассчитайте количество выделившихся на электродах веществ. а.3) Найдите конечную массу раствора. а.4) Рассчитайте массовые доли веществ в растворе после электролиза. Б) При электролизе раствора соли металла средней активности могут происходить дополнительные процессы в зависимости от концентрации соли. При этом решение задачи на такой электролиз будет не столь прямолинейным, как в случае с солями активных или пассивных металлов. В этой части задачи вам предлагается попробовать выяснить, что же в итоге происходит при электролизе раствора соли свинца. Примечание: свинец является металлом средней активности. Через 300 г 33,1%-ного раствора нитрата свинца провели ток и на аноде выделился кислород объемом 3,36 л (н.у.). Электролиз остановили, когда массовая доля нитрата свинца в растворе стала равной 24,15%. б.1) Рассчитайте количество кислорода, выделившегося на аноде. б.2) Найдите массу раствора после электролиза. б.3) Какое вещество останется в растворе помимо воды и нитрата свинца? Найдите его массовую долю. Задача 4. Принято считать, что соли, образованные элементами одной группы периодической системы, хорошо растворимы в воде, но в каждом правиле есть исключения. Одним из таких исключений является соль A (содержит 26.75% металла X по массе), которую можно получить тремя способами: Взаимодействием 2.81 г соли B с кислотой C (реакция 1), при этом выделяется газ, при пропускании которого через избыток раствора гидроксида кальция выделяется 3.8 г белого осадка. Реакцией обмена между соединениями D (ω(X) = 16,35%) и E (реакция 2). В ходе данной реакции из 1.426 г E получается 1.000 г A. Реакцией нейтрализации между кислотой C и основанием F (реакция 3). Установите элемент X. Как называется группа элементов, к которой он относится? Ответ подтвердите расчетом. Для расчетов берите точные атомные массы элементов. Расшифруйте соединения A-F, подтвердив ответ расчетами. Напишите уравнения реакций1-3. Другая малорастворимая соль G, также содержащая элемент X, может быть получена смешиванием растворов вещества D и вещества H (реакция 4). Соединение H состоит из 3 элементов, окрашивает пламя горелки в фиолетовый цвет и дает желтый осадок с нитратом серебра (реакция 5). Соль G образует кристаллогидрат, который при прокаливании при 120oC теряет 65.1% своей массы (реакция6). Установите формулы веществ G, H, а также упомянутого кристаллогидрата. Напишите уравнения реакций 4-6. Низкая растворимость солей элемента X объясняется схожими размерами его катионов с катионами элемента Y, образующего множество нерастворимых солей. 4. Определите элемент Y. Как называется такой вид сходства? Задача 5. Анализ водных проб является важным этапом в процессе водоподготовки. Количественный анализ содержания различных ионов в образце воды позволяет оценить качество воды и предотвращает от использования воды с опасным для здоровья содержанием ионов. Одним из важных для контроля содержания элементов является иод. В воде он представлен в виде двух основных форм: иодида и иодата. Общее содержание иода в воде варьируется от 0.005 до 1 мг/л, поэтому для точного определения данного элемента в воде необходимо брать большие пробы. В аналитическую лабораторию привезли образец морской воды. Отобрав пробу объемом 0.80 л, лаборант путем выпаривания и нескольких экстракций получил из нее сухой остаток, содержащий все растворенные в пробе неорганические соединения. Далее лаборант аккуратно растворил полученный сухой остаток в 5 мл дистиллированной воды, добавил в него необходимое количество серной кислоты, а в полученный подкисленный раствор добавил необходимое количество бромной воды. После нагревания и охлаждения полученного раствора все формы иода (иодид и иодат) перешли в молекулярный иод, на титрование которого лаборанту потребовалось 9.85 мл 0.0001 М раствора тиосульфата натрия 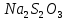 . Суммарно весь ход анализа можно описать с помощью следующих реакций: . Суммарно весь ход анализа можно описать с помощью следующих реакций: 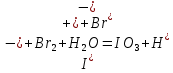 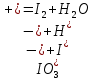 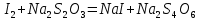 1. Расставьте коэффициенты в уравнениях реакций, описывающих ход анализа. 2. Рассчитайте общую концентрацию иода (как элемента) в анализируемой воде в мг/л. Соотношение количества иодата к количеству иодида в морской воде напрямую зависит от концентрации растворенного в ней кислорода. Концентрацию растворенного кислорода можно определить с помощью титрования по Винклеру: К пробе морской воды объемом 250 мл добавляют необходимый объем сульфата марганца (II) и небольшое количество гидроксида натрия. Полученный гидроксид марганца связывается с растворенным в пробе кислородом, при этом выпадает осадок оксида марганца (IV). К полученному в растворе осадку добавляют определенное количество серной кислоты и иодида калия, при этом через некоторое время после растворения осадка выделяется иод, который титруют 0.01 М раствором тиосульфата натрия. На титрование ушло 7.65 мл раствора тиосульфата. 3. Запишите уравнения описанных реакций. 4. Рассчитайте концентрацию растворенного кислорода в пробе воды в мг/л. Задача 6. Скорость большинства химических реакций зависит от температуры. Чаще всего эта зависимость прямая: чем выше температура, тем быстрее протекает реакция. Объяснить это можно с точки зрения теории активных столкновений: с повышением температуры повышается скорость и энергия сталкивающихся частиц, тем самым увеличивается вероятность того, что при столкновении произойдет химическое превращение. Самую первую зависимость скорости реакции от температуры открыл нидерландский химик Якоб Хендрик Вант-Гофф, который, к слову, был самым первым лауреатом Нобелевской премии по химии в 1901 году. Эта зависимость носит название «Правила Вант-Гоффа» и имеет следующий вид: 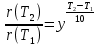 Иными словами, при повышении температуры на 10°С, скорость химической реакции увеличится в у раз. у – температурный коэффициент скорости. Как правило, значение находится в диапазоне от 2 до 4. Важно заметить, что данное правило носит эмпирический характер, т.е. оно было получено в ходе анализа экспериментальных данных. 1. Скорость реакции между этиловым спиртом и уксусным ангидридом при 290 равна 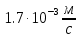 Найдите скорость этой реакции при 390 если температурный коэффициент равен 2. 2. При увеличении температуры на 40 , скорость некоторой реакции увеличилась в 1.55 раз. Найдите температурный коэффициент. 3. Скорость некоторой реакции A + 2B → продукты имеет второй порядок по веществу . При увеличении концентрации в два раза и повышении температуры на 7°С, время протекания реакции сократилось с 480 минут до 60 минут. Найдите температурный коэффициент. Вы можете считать, что изначально вещество было в избытке. В силу эмпирического характера «Правила Вант-Гоффа» его можно применять к физическим процессам, состоящим из множества различных химических реакций. Например, известно, что тигровые креветки могут храниться в морозильнике при -200 в течение месяца. 4. Как долго могут пролежать креветки в холодильнике при температуре 100 прежде чем они испортятся, если температурный коэффициент равен 2. 2? А если положить их в нулевую зону (с температурой 00 )? (Конечно, хоть правило Вант-Гоффа и может хорошо описывать экспериментальные данные и давать довольно точные предсказания, оно не несет под собой теоретического обоснования, а поэтому мы не можем остановиться на нем. Другой лауреат Нобелевской премии по химии, шведский ученый Сванте Август Аррениус в 1889 году предложил концепцию энергии активации – энергии, которой необходимо обладать реагентам, чтобы превратиться в продукты. Если обозначить эту энергию как Еа , то из формул статистической механики следует, что доля молекул, обладающих энергией Еаили Т выше при температуре пропорциональна:  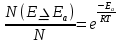 Таким образом, константа скорости любой реакции имеет следующй вид:  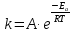 Где А – константа пропорциональности, также известная как преэкспоненциальный или частотный фактор, а Т – температура в кельвинах. Примечание: T(K) = T (°C) + 273. 5. Найдите температурный коэффициент Вант-Гоффа для реакции с энергией активации в 60 кДж/моль при температурах вблизи комнатной (25°С). |
